Sprawdź się

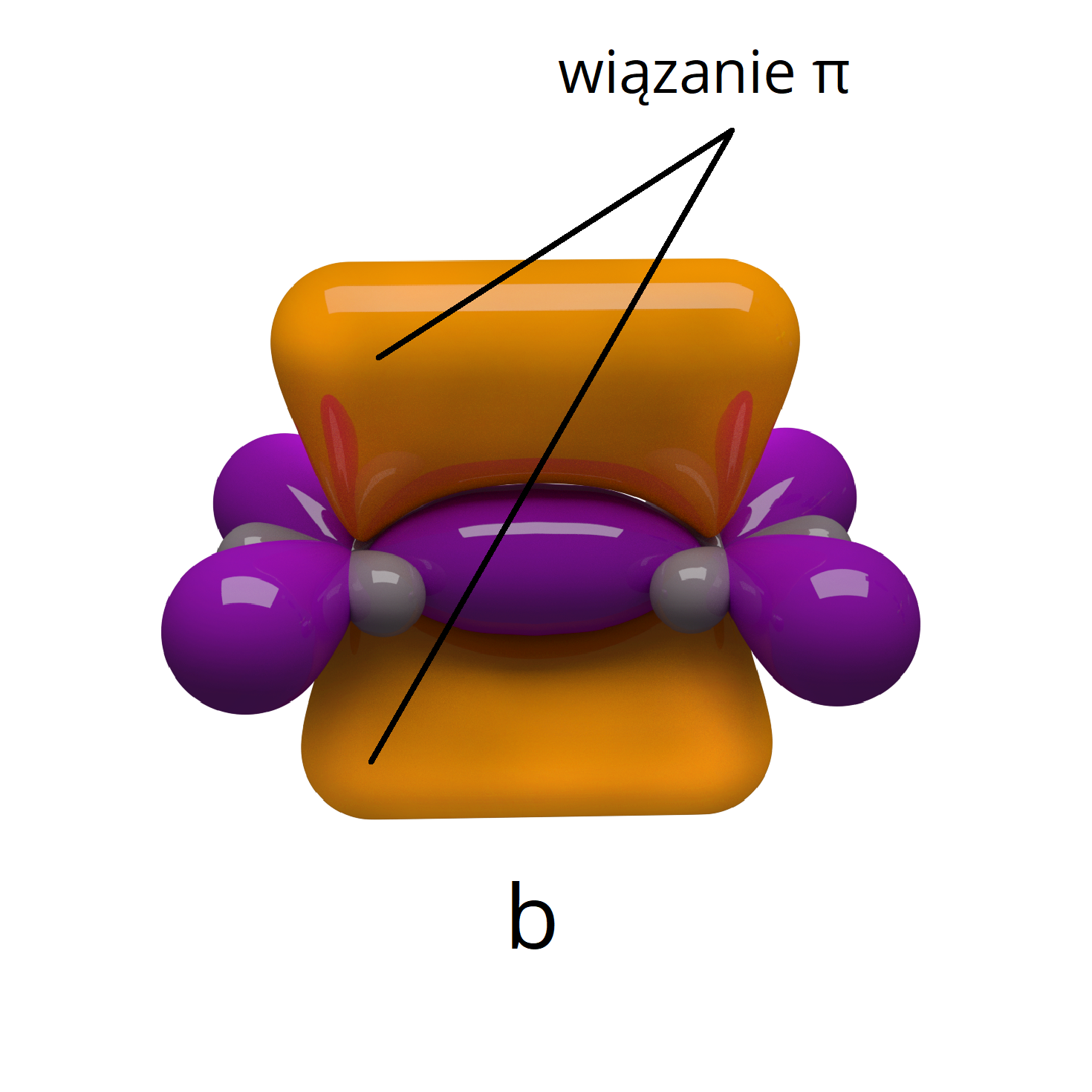
Rysunek a przedstawia orbitale, które prowadzą do utworzenia wiązań i w cząsteczce. Zaznacz na rysunku b orbitale molekularne typu .
Buta–, –diyn (diacetylen) jest przedstawicielem szeregu poliynów, czyli związków, zawierających naprzemiennie ułożone wiązania pojedyncze i potrójne. Diacetylen można otrzymać przez dehydrochlorowanie –dichloro––butynu wodorotlenkiem potasu w niskiej temperaturze.

Cząsteczka diacetylenu zawiera trzy wiązania 1. , 2. potrójne, 3. , 4. , 5. , 6. , 7. , 8. , 9. podwójne, 10. , 11. węgla, 12. , 13. pojedyncze, 14. , 15. pojedyncze, 16. , 17. , 18. , 19. i dwa wiązania 1. , 2. potrójne, 3. , 4. , 5. , 6. , 7. , 8. , 9. podwójne, 10. , 11. węgla, 12. , 13. pojedyncze, 14. , 15. pojedyncze, 16. , 17. , 18. , 19. . Orbital typu 1. , 2. potrójne, 3. , 4. , 5. , 6. , 7. , 8. , 9. podwójne, 10. , 11. węgla, 12. , 13. pojedyncze, 14. , 15. pojedyncze, 16. , 17. , 18. , 19. atomu wodoru z orbitalem zhybrydyzowanym typu atomu 1. , 2. potrójne, 3. , 4. , 5. , 6. , 7. , 8. , 9. podwójne, 10. , 11. węgla, 12. , 13. pojedyncze, 14. , 15. pojedyncze, 16. , 17. , 18. , 19. tworzy wiązania pojedyncze typu 1. , 2. potrójne, 3. , 4. , 5. , 6. , 7. , 8. , 9. podwójne, 10. , 11. węgla, 12. , 13. pojedyncze, 14. , 15. pojedyncze, 16. , 17. , 18. , 19. . Niezhybrydyzwoane orbitale oraz atomów węgla, prostopadłe do osi łączącej oba atomy węgla, nakładają się na siebie tworząc 1. , 2. potrójne, 3. , 4. , 5. , 6. , 7. , 8. , 9. podwójne, 10. , 11. węgla, 12. , 13. pojedyncze, 14. , 15. pojedyncze, 16. , 17. , 18. , 19. wiązania typu 1. , 2. potrójne, 3. , 4. , 5. , 6. , 7. , 8. , 9. podwójne, 10. , 11. węgla, 12. , 13. pojedyncze, 14. , 15. pojedyncze, 16. , 17. , 18. , 19. .
W cząstecze diacetylenu, pomiędzy atomem węgla (1. , 2. potrójne, 3. , 4. , 5. , 6. , 7. , 8. , 9. podwójne, 10. , 11. węgla, 12. , 13. pojedyncze, 14. , 15. pojedyncze, 16. , 17. , 18. , 19. ) a (), występuje wiązanie pojedyncze, które powstaje na skutek nałożenia się orbitali zhybrydyzowanych typu .
Ustal liczbę elektronów, które tworzą orbitale molekularne w cząsteczce diacetylenu.
Poniżej zaprezentowano wzór wielofunkcyjnego związku organicznego pochodzenia naturalnego o nazwie ,,lowastatyna'' (łac. lovastatinum). Substancja ta może być stosowana jako lek zmniejszający stężenie lipidów we krwi.

Odpowiedz na pytania:
Ile łącznie elektronów tworzy orbitale molekularne typu w cząsteczce lowastatyny?
Ile wiązań jest w cząsteczce lowastatyny?
Ile atomów węgla wykorzystuje orbitale do utworzenia wiązań ?
Orbitale jakiego typu tworzą wiązanie podwójne w grupie karbonylowej, oznaczonej czerwonym kółkiem na rysunku?
Wyjaśnij, jak powstają wiązania typu w cząsteczce etenu.