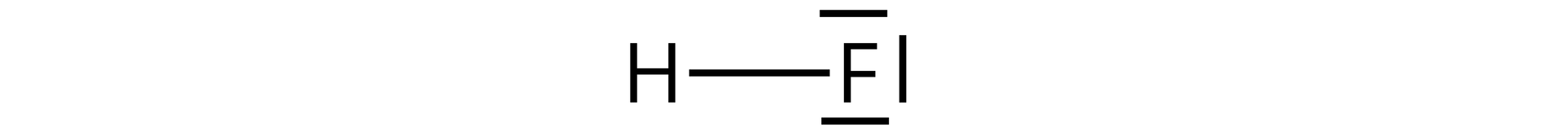Sprawdź się
Fluorowodór można otrzymać z jego soli. W tym celu wykorzystuje się minerał o nazwie fluoryt (fluorek wapnia). Reakcję tę przeprowadza się w naczyniu wykonanym z platyny lub ołowiu ze względu na właściwości produktu.
Ile fluorowodoru w gramach można otrzymać z 50 g fluorytu? Załóż 100% wydajności reakcji chemicznej. Prawidłowa odpowiedź podana jest z dokładnością do 0,1 g.
Do reakcji otrzymania fluorowodoru z fluorytu użyto 100 cmIndeks górny 33 stężonego kwasu siarkowego(VI) (96%) o gęstości 1,83 oraz stechiometryczną ilość fluorytu. Proces zachodzi z wydajnością 90%. Jaka była masa otrzymanego fluorowodoru? Wynik podaj z dokładnością do 0,01 g.
Fluorowodór, jako jedyny spośród fluorowcowodorów, w warunkach normalnych jest cieczą. Jego temperatura wrzenia wynosi 19,5°C, podczas gdy temperatury wrzenia , i wynoszą odpowiednio: -85°C, -66,38°C i -35,55°C. W stanie gazowym fluorowodór tworzy cząsteczki .
Podaj wzór elektronowo‑kreskowy cząsteczki fluorowodoru i wytłumacz, z czego wynika jego wysoka temperatura wrzenia.
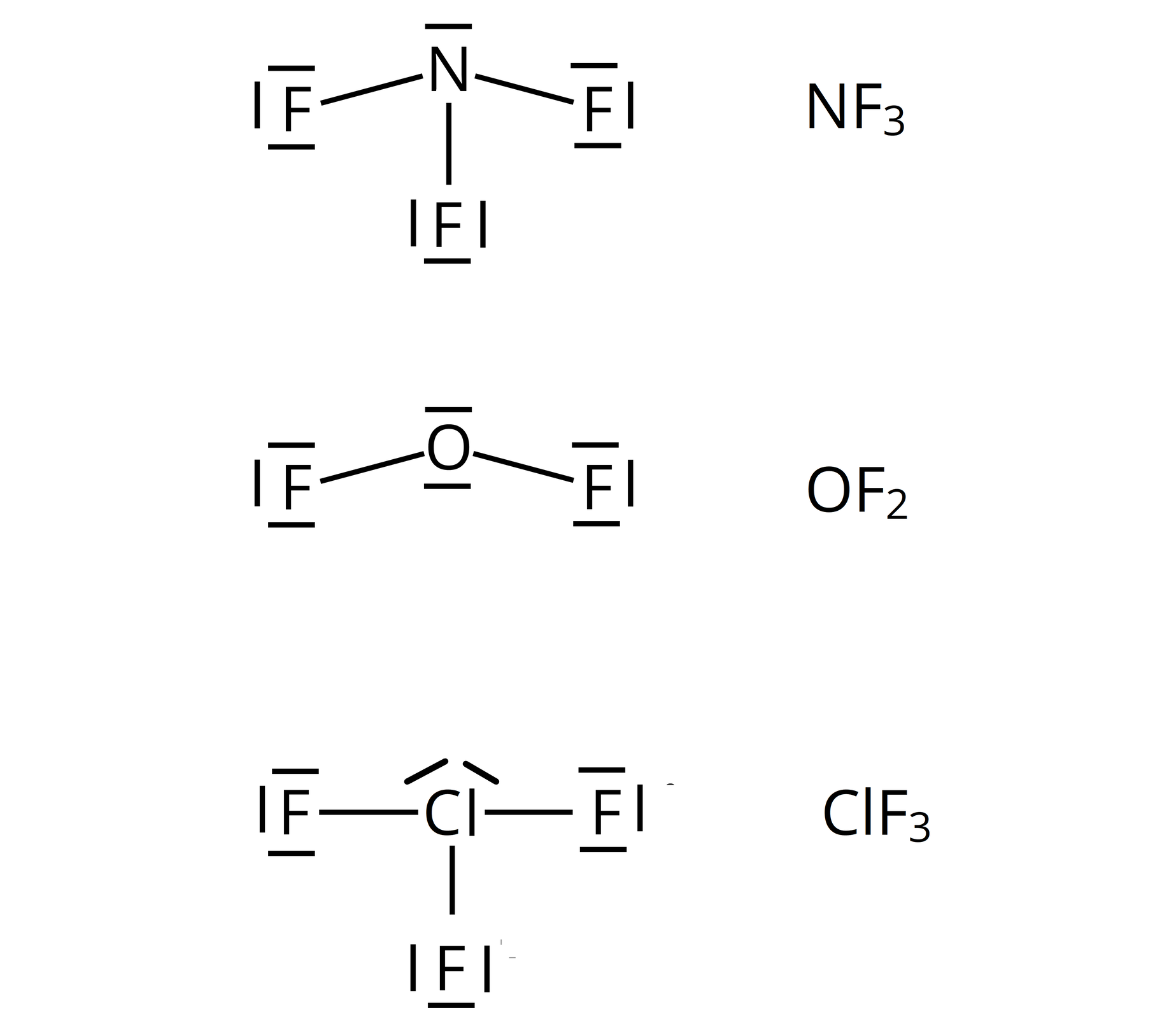
Narysuj wzory elektronowo‑kreskowe dla związków: , , .
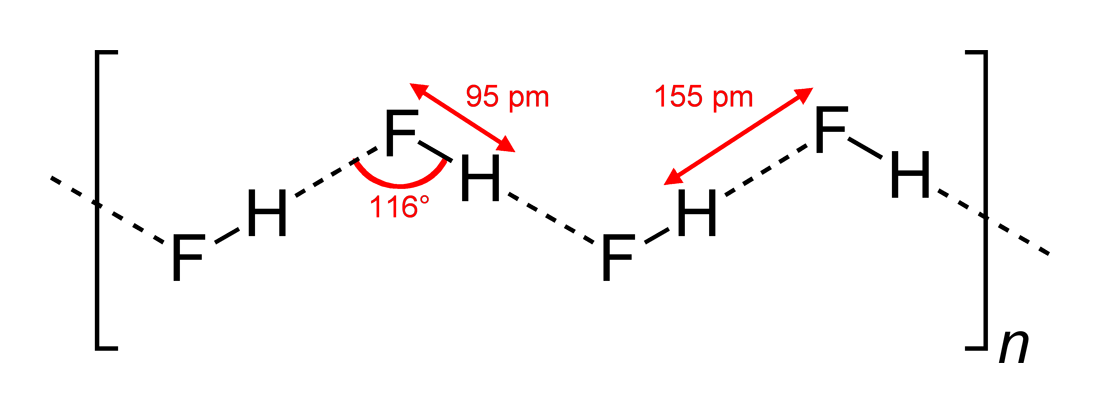
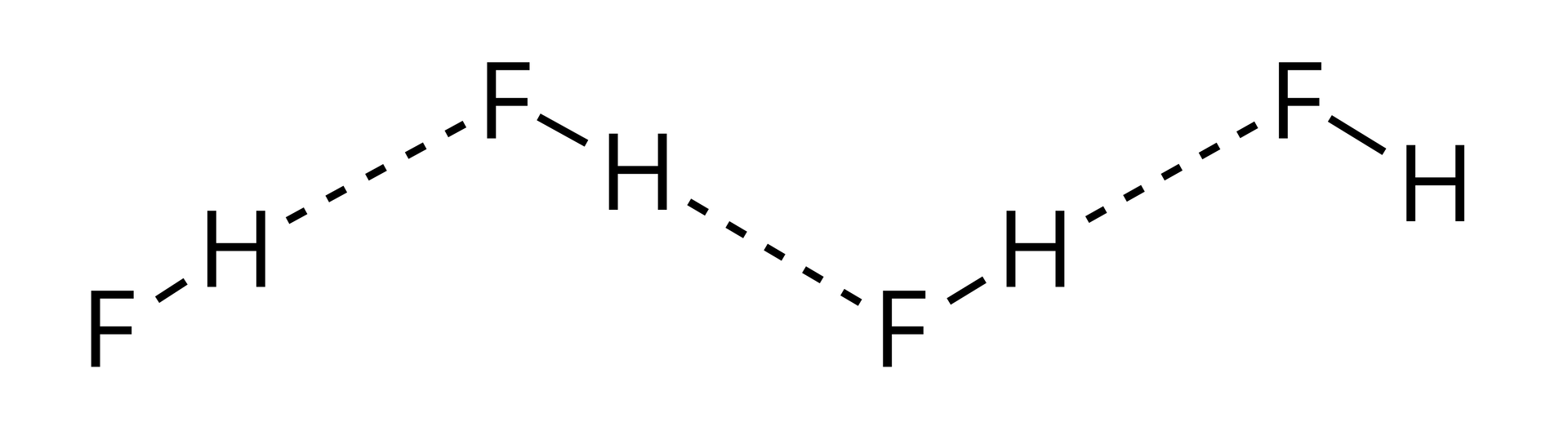
Cząsteczki fluorowodoru mają zdolność do asocjacji, czyli łączenia się w długie łańcuchy z wykorzystaniem wiązań wodorowych. Wywołuje to znaczące podwyższenie temperatury wrzenia fluorowodoru w stosunku do innych wodorków fluorowców. W temperaturze ok. 20°C (temperatura zbliżona do temperatury wrzenia ) oraz pod ciśnieniem 1013 hPa, gęstość par fluorowodoru jest równa 4,98. Oblicz, ile cząsteczek uległo asocjacji, wiedząc, że w opisanych warunkach objętość molowa gazu jest równa 24,1 .
Indeks dolny Źródło: Opracowano na podstawie matury - czerwiec 2017, poziom rozszerzony Indeks dolny koniecŹródło: Opracowano na podstawie matury - czerwiec 2017, poziom rozszerzony