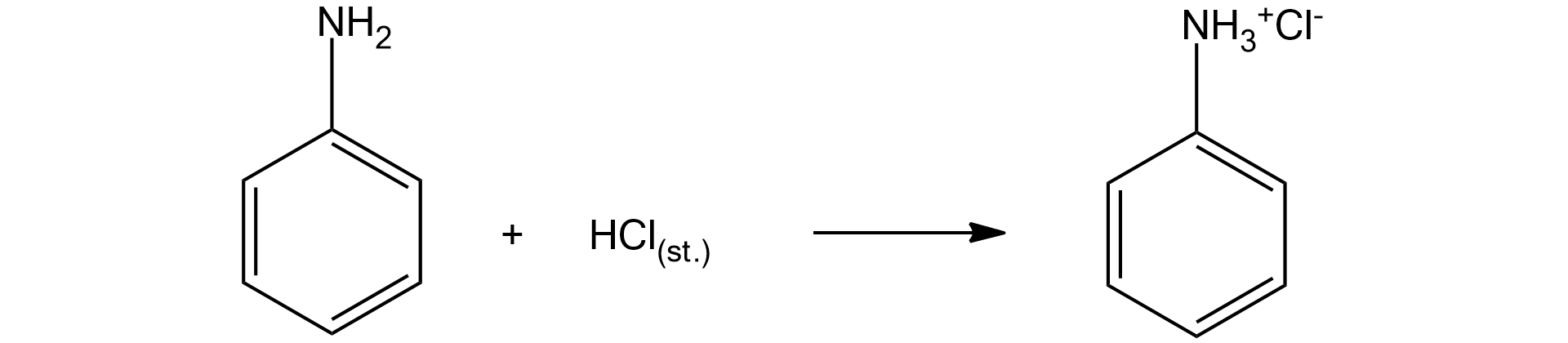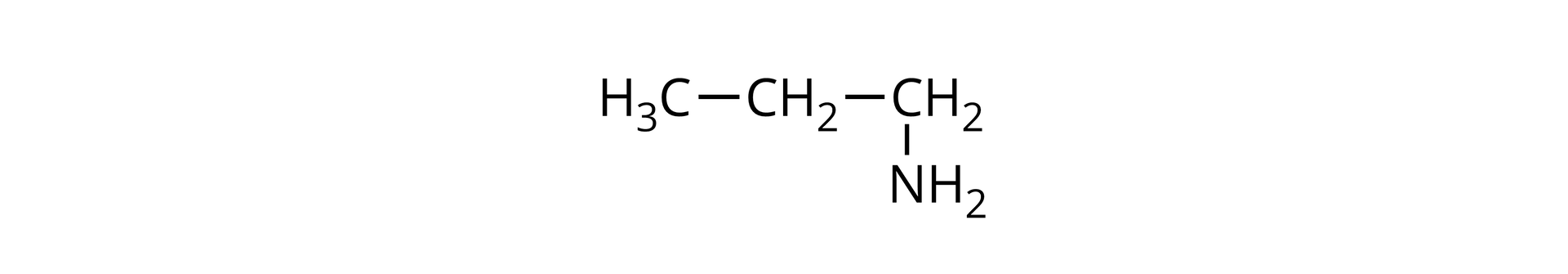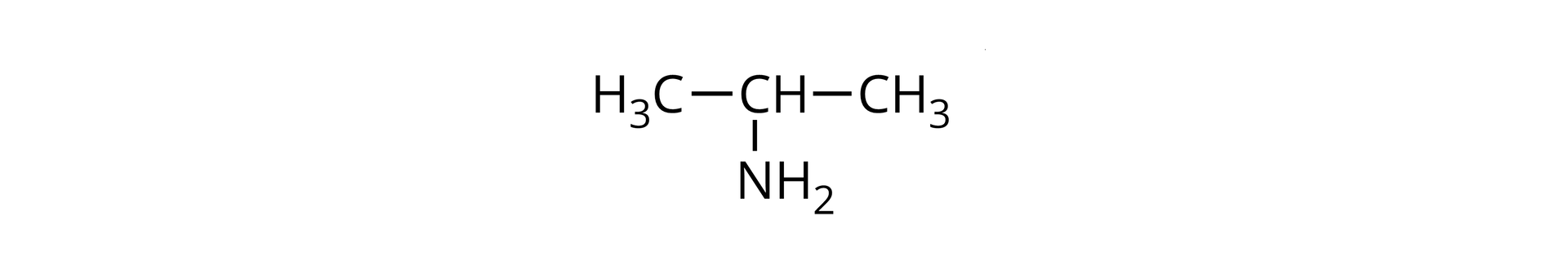Sprawdź się
Które z poniższych równań reakcji chemicznych wyjaśnia odczyn roztworu wodnego odczynu metanoaminy? Zaznacz poprawną odpowiedź.
W czterech probówkach znajduje się po roztworu wodnego N-metylometanoaminy o stężeniu . Do pierwszej probówki dodano kwasu chlorowodorowego o stężeniu , do drugiej wodnego roztworu wodorotlenku potasu o stężeniu , do trzeciej wody, a do czwartej dodano wodnego roztworu N-metylometanoaminy o stężeniu . Określ, jak zmieniło się (zmalało, wzrosło, pozostało bez zmian) pH wyjściowego roztworu.
Uszereguj podane związki chemiczne wg malejącego charakteru zasadowego ich wodnych roztworów (na górze umieść związek o najsilniejszym charakterze zasadowym).
Oblicz pH wodnego roztworu etanoaminy o stężeniu , jeżeli stała dysocjacji w temperaturze wynosi .
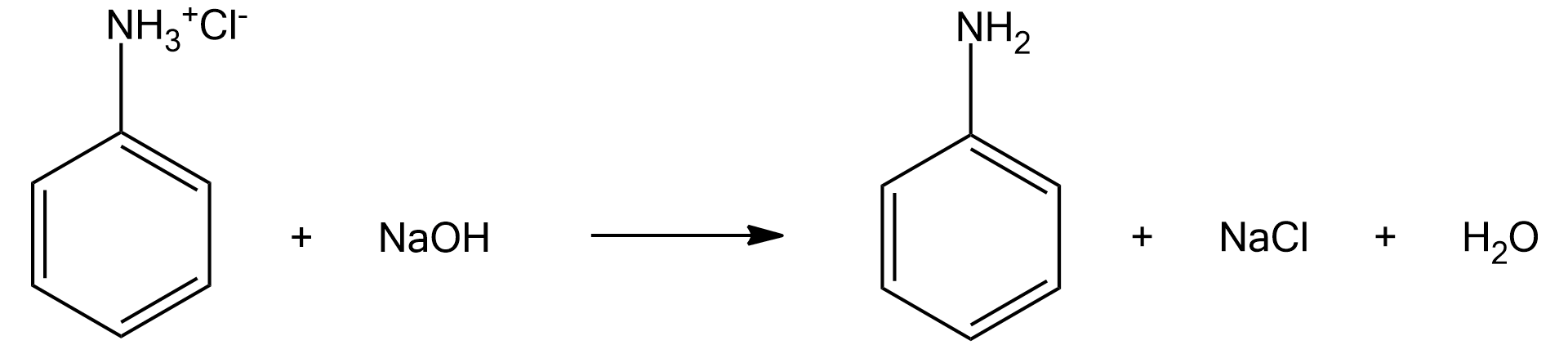
W laboratorium chemicznym uczniowie mieli za zadanie wykazać, że anilina jest słabą zasadą. W tym celu przeprowadzili doświadczenie chemiczne składające się z dwóch etapów. W pierwszym z nich, działając stężonym kwasem chlorowodorowym na mieszaninę dwufazową aniliny z wodą destylowaną, otrzymali roztwór o kremowym zabarwieniu i doszło do zaniku faz. Następnie dodali do probówki roztwór wodorotlenku sodu i otrzymali ponownie mieszaninę dwufazową.
A. Zapisz równania przeprowadzonych przez uczniów reakcji chemicznych.
B. Zapisz wniosek, jaki można wysunąć po przeprowadzeniu obu doświadczeń.
W laboratorium chemicznym uczniowie mieli za zadanie wykazać, że anilina jest słabą zasadą. W tym celu przeprowadzili doświadczenie chemiczne składające się z dwóch etapów. W pierwszym z nich, działając stężonym kwasem chlorowodorowym na mieszaninę dwufazową aniliny z wodą destylowaną, otrzymali roztwór o kremowym zabarwieniu i doszło do zaniku faz. Następnie dodali do probówki roztwór wodorotlenku sodu i otrzymali ponownie mieszaninę dwufazową.
A. Zapisz równania przeprowadzonych przez uczniów reakcji chemicznych. Zastosuj zapis do oznaczenia pierścienia fenylowego.
B. Zapisz wniosek, jaki można wysunąć po przeprowadzeniu obu doświadczeń.
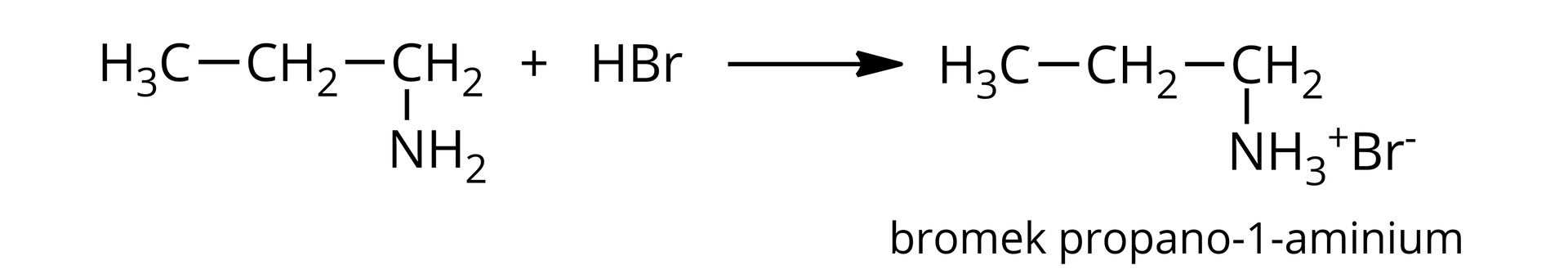
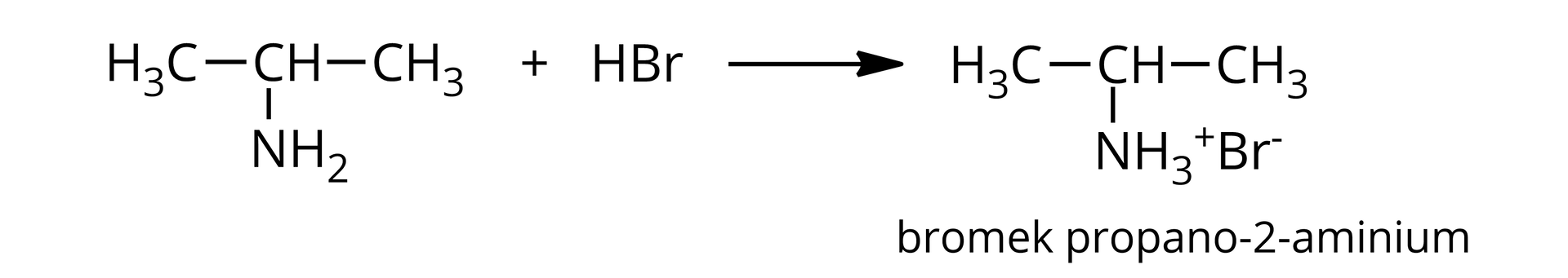
Pewna nasycona, -rzędowa amina alifatyczna reaguje z kwasem bromowodorowym z utworzeniem soli, zawierającej bromu (procent masowy).
A. W oparciu o odpowiednie obliczenia ustal wzory półstrukturalne oraz nazwy amin spełniających warunki zadania.
B. Napisz równanie reakcji wybranej aminy spełniającej warunki zadania z kwasem bromowodorowym. Zapisz nazwę powstającej soli.
C. Określ, jaki będzie odczyn wodnego roztworu tej z amin spełniającej warunki zadania, w cząsteczce której grupa aminowa znajduje się przy pierwszym atomie węgla. Odpowiedź uzasadnij, pisząc równanie odpowiedniej reakcji chemicznej.