Sprawdź się
Zaznacz poprawną odpowiedź.
Przyporządkuj odpowiednie symbole jonów do barwy ich wodnych roztworów.
Uszereguj ligandy zgodnie ze wzrastającą zdolnością do rozszczepiania pola krystalicznego.
Uczeń chciał sprawdzić, czy związki manganu na różnych stopniach utlenienia reagują ze sobą. W tym celu do roztworu siarczanu manganu dodał rozcieńczony roztwór manganianu potasu.
Zanotował, że wytrącił się brunatny osad.
Wiedząc, że poza produktami reakcji są oraz , napisz równanie reakcji w formie cząsteczkowej, a jego współczynniki dobierz metodą bilansu jonowo‑elektronowego.
Jak nazywają się tego typu reakcje utleniania‑redukcji?
Na podstawie modelu kulkowego, określ całkowity ładunek cząsteczki zbudowanej z jednego jonu żelaza i sześciu jonów cyjankowych.
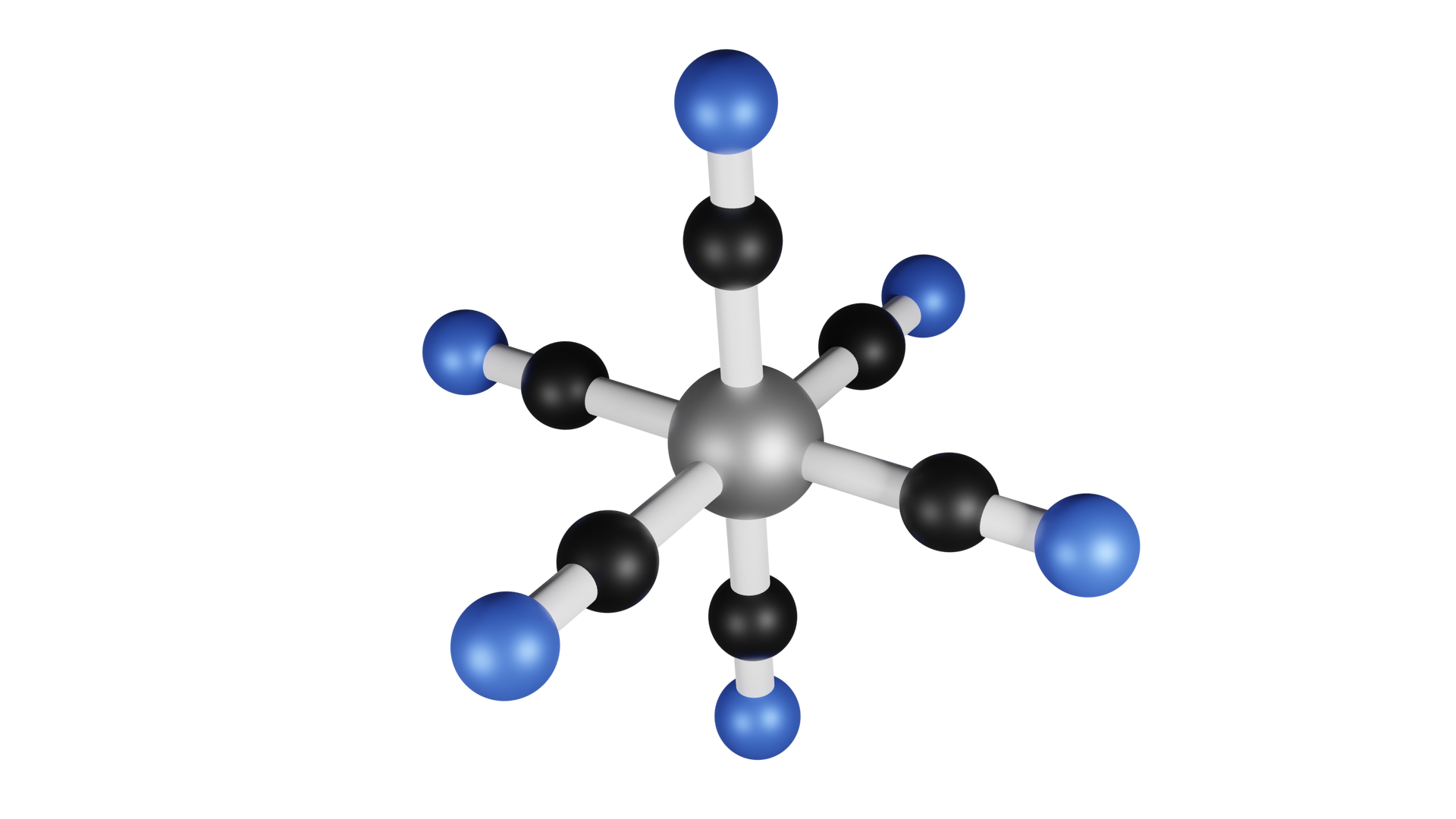
Narysuj diagram poziomów energetycznych jonu w cząsteczce w oktaedrycznym polu ligandów .
Uczeń wykonał dwa doświadczenia.
Doświadczenie
Do kolby zawierającej chlor włożył silnie rozgrzany drut żelazny. Po zakończeniu egzotermicznej reakcji żelaza z chlorem i ostygnięciu kolby dodał do niej wody.
Doświadczenie
Do kolby zawierającej kwas chlorowodorowy wsypał opiłki żelaza.
Opisz obserwacje, jakie powinien zapisać uczeń w trakcie wykonania doświadczeń. Zwróć uwagę na barwy roztworów otrzymanych po reakcji w każdym z doświadczeń. O czym świadczą barwy tych roztworów? Wyciągnij odpowiednie wnioski i zapisz równania reakcji w formie cząsteczkowej.
Uczeń przeprowadził następujące doświadczenie.
Czynność : Do roztworu chromianu potasu dodał niewielką ilość kwasu siarkowego.
Czynność : Następnie dodał roztwór siarczanu potasu.
Jakie obserwacje zapisał uczeń po wykonaniu każdej czynności?
Uczeń zapisał poprawnie we wnioskach, że dichromian potasu utlenił siarczan potasu do siarczanu potasu. Dlaczego ten wniosek jest poprawny? Przecież do doświadczeń użyto chromianu potasu, a nie dichromianu potasu.
Napisz równania zachodzących reakcji w formie cząsteczkowej i jonowej. Jeśli w czasie reakcji zachodziła zmiana stopni utlenienia, to współczynniki takiego równania dobierz metodą bilansu jonowo‑elektronowego.
Jedną z metod odróżniania węglowodorów nienasyconych od nasyconych jest reakcja z wodnym roztworem manganianu potasu. Przykładowo eten utlenia się do etan-,-diolu.
Napisz (w formie cząsteczkowej) równanie reakcji etenu z manganianem potasu, zachodzącej w środowisku obojętnym.
Współczynniki stechiometryczne w równaniu dobierz metodą bilansu jonowo‑elektronowego. Określ barwy odpowiednich związków chemicznych manganu, będących reagentami analizowanej reakcji.
Żelazo ulega pasywacji przy zetknięciu się z zimnymi, stężonymi kwasami: azotowym i siarkowym). Uczeń chciał sprawdzić zachowanie się żelaza wobec rozcieńczonych kwasów: , oraz gorących stężonych kwasów: i . W tym celu wykonał szereg doświadczeń przedstawionych na rysunku.
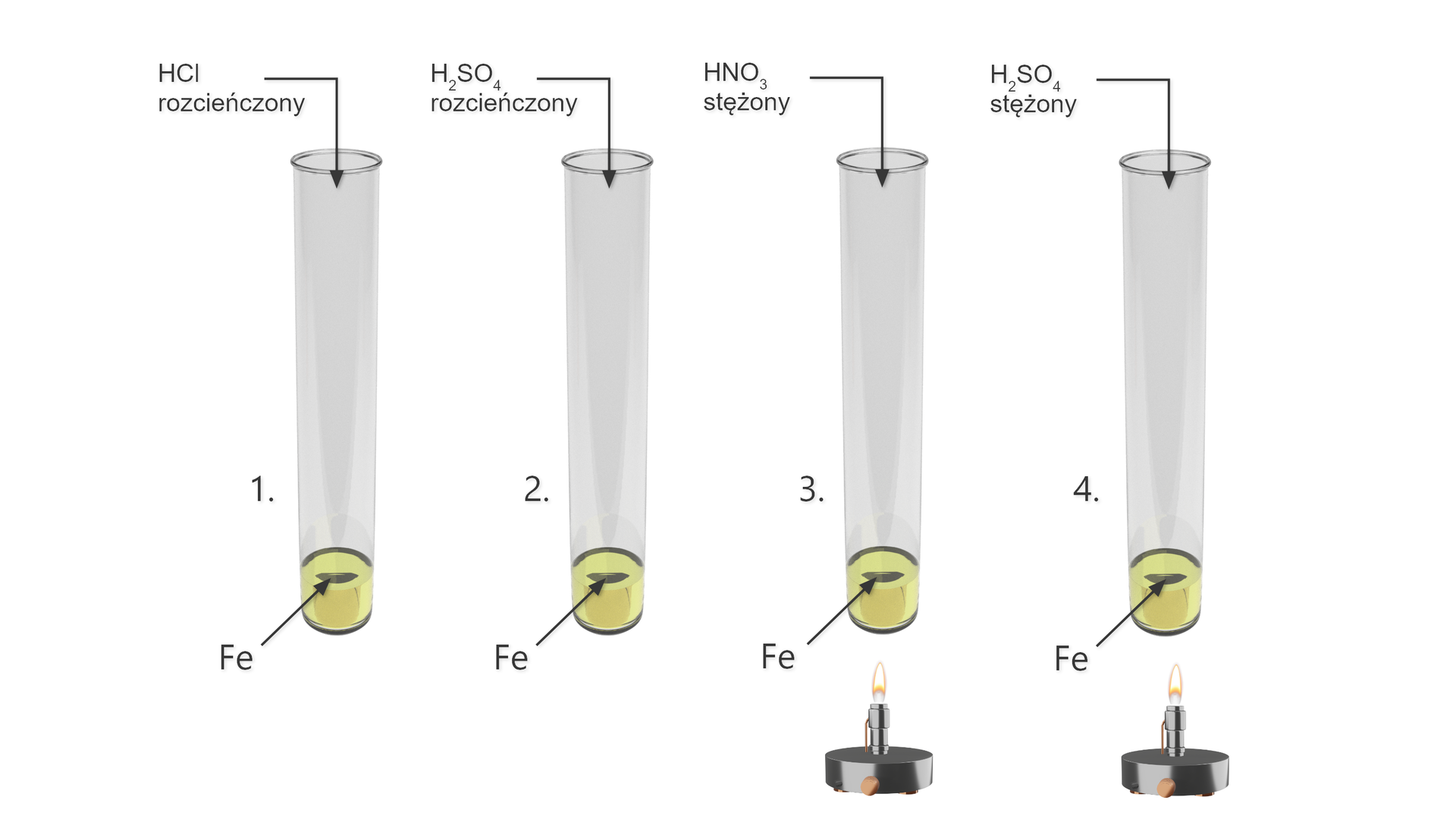
Uczeń zbadał dodatkowo palność wydzielających się z probówek gazów i zapisał obserwacje w tabelce. Na podstawie tych obserwacji napisz cząsteczkowe równania reakcji zachodzących w kolejnych probówkach.
Probówka | Informacje o wydzielającym się gazie | Informacje o barwie roztworu po reakcji |
|---|---|---|
Probówka nr | Bezbarwny, palny gaz | zielona |
Probówka nr | Bezbarwny, palny gaz | zielona |
Probówka nr | Brunatny gaz | żółtopomarańczowa |
Probówka nr | Bezbarwny gaz o duszącym zapachu | żółtopomarańczowa |
Przedstaw projekt doświadczenia, w którym wykażesz, że wodorotlenek chromu ma właściwości amfoteryczne. W tym celu:
naszkicuj odpowiedni rysunek;
opisz przewidywane obserwacje;
zapisz wnioski i uzasadnij je odpowiednimi równaniami reakcji w formie cząsteczkowej i jonowej skróconej.

