Sprawdź się
Wybierz poprawną odpowiedź.
Wybierz poprawną odpowiedź. W tabeli podano wartości stałych dysocjacji KIndeks dolny aa dla wodorków fluorowców:
Związek | ||||
Stała dysocjacji | 6,3 · 10Indeks górny ‑4‑4 | 1,0 · 10Indeks górny 77 | 3,0 · 10Indeks górny 99 | 1,0 · 10Indeks górny 1010 |
Uzupełnij zdania, tak aby były one prawdziwe.
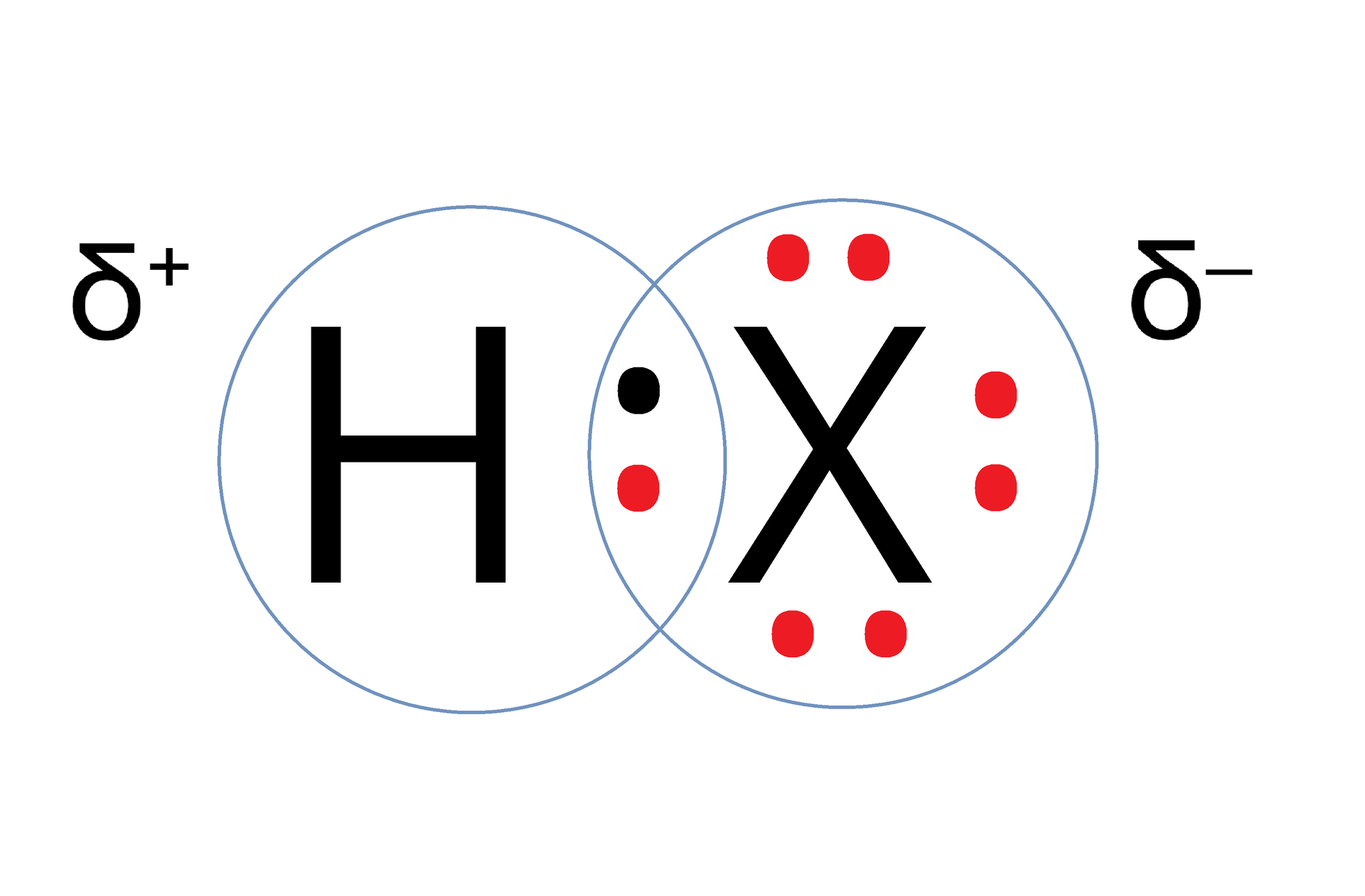
Cząsteczki wodorków 17. grupy wykazują polarną budowę. Na schematycznym rysunku zaznacz część naładowaną dodatnio i ujemnie.
Cząsteczki wodorków 17. grupy wykazują polarną budowę. Na podstawie opisanego rysunku, podaj, który z atomów będzie obdarzony cząstkowym ładunkiem dodatnim, a który cząstkowym ładunkiem ujemnym?
Zapisz równanie reakcji dysocjacji bromowodoru. Nazwij odpowiednie jony.
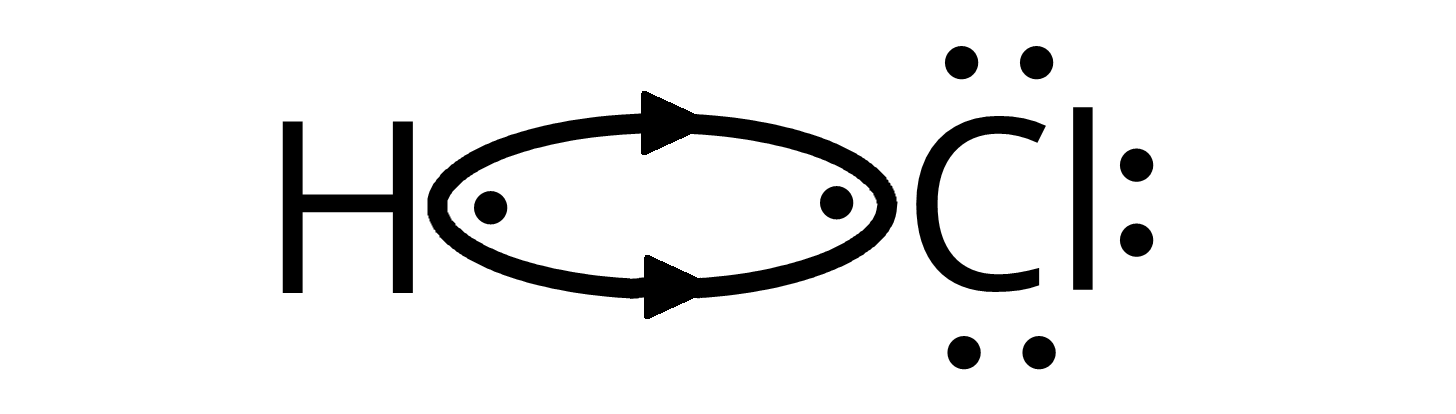
Zaproponuj wzór elektronowy kropkowy chlorowodoru. Uwzględnij polaryzacje wiązania.
Zaprojektuj doświadczenie pozwalające określić odczyn wodnego roztworu bromowodoru. Do dyspozycji masz: alkoholowy roztwór fenoloftaleiny, 10% wodny roztwór bromowodoru, oranż metylowy, probówki, pipety.