Układ okresowy pierwiastków
Ze wszystkich sposobów prezentacji pierwiastków chemicznych tylko jeden zyskał ogromną popularność i jest stosowany w tej samej formie na całym świecie. Jego fenomen polega na tym, że nawet jeśli nie znamy pierwiastka, a wiemy, w którym miejscu tej tabeli się znajduje, jesteśmy w stanie wiele powiedzieć na temat jego właściwości.
że podstawowym składnikiem materii jest atom;
co to jest liczba atomowa;
co to jest masa atomowa;
jakie są symbole i nazwy pierwiastków;
że pierwiastki dzielą się na metale i niemetale.
interpretować prawo okresowości;
opisywać budowę układu okresowego (wskazywać grupy i okresy);
określać położenie pierwiastka w układzie okresowym;
wskazywać metale i niemetale w układzie okresowym;
odczytywać z układu okresowego podstawowe informacje o pierwiastku (liczbę atomową, masę atomową, rodzaj pierwiastka).
1. Jak klasyfikowano pierwiastki?
XIX wiek to czas, kiedy uczeni znali już kilkadziesiąt pierwiastków chemicznych. Były one przez nich zbadane i opisane. Ówcześni naukowcy zauważyli, że wśród pierwiastków są takie, które wykazują podobne właściwości. Poszukiwali więc klucza, według którego mogliby je uporządkować i sklasyfikować. Zauważyli wtedy, że jeśli ułoży się pierwiastki w szeregu zgodnie ze wzrastającą masą atomową, to na początku co ósmy, a potem co osiemnasty pierwiastek wykazuje podobne cechy. To spostrzeżenie pozwoliło jednemu z uczonych sformułować ogólne prawo, które nazwano prawem okresowości (na cześć twórcy Dymitra MendelejewaDymitra Mendelejewa – prawem okresowości Mendelejewa).
właściwości pierwiastków chemicznych uszeregowanych według rosnącej liczby atomowej powtarzają się okresowo

Film dostępny na portalu epodreczniki.pl
Długa droga do systematyki pierwiastków
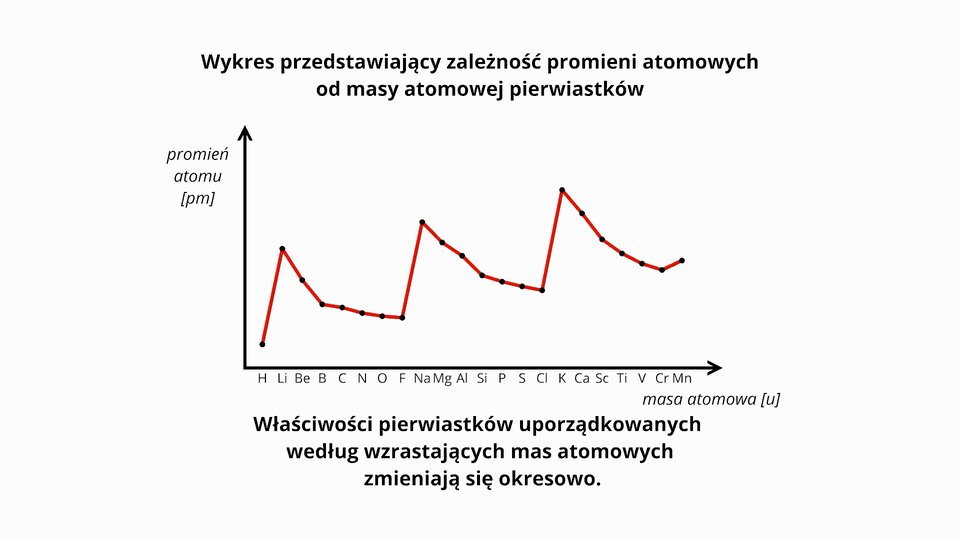
Film dostępny na portalu epodreczniki.pl
Film rozpoczyna tablica z symbolami różnych pierwiastków ułożonych przypadkowo. Na ekranie pojawia się napis: Uporządkowanie pierwiastków według wzrastającej masy atomowej i w tym samym momencie symbole zaczynają się układać w kolejności swoich liczb atomowych: od wodoru po lewej stronie, po mangan po prawej, łącznie 22 pierwiastki. Symbole w tej kolejności zjeżdżają na dół ekranu, a nad nimi pojawia się układ współrzędnych z osią poziomą oznaczoną jako masa atomowa w unitach, a osią pionową oznaczoną: promień atomu w pikometrach. Pojawia się napis Wykres przedstawiający zależność promieni atomowych od masy atomowej pierwiastków i na układ współrzędnych naniesione zostają pozycje dla wszystkich dwudziestu dwóch pierwiastków. Poza wodorem, który odstaje wyraźnie w lewym dolnym rogu wykresu, wszystkie punkty tworzą trzy wyraźne grupy po siedem pierwiastków. Punkty tych grup układają się w krzywe o kształtach zbliżonych do hiperbol. Pojawia się czerwona linia łącząca po kolei ze sobą wszystkie atomy. Okazuje się, że ma regularny, zębaty kształt. Pod wykresem pojawia się napis: Właściwości pierwiastków uporządkowanych według wzrastających mas atomowych zmieniają się okresowo.
2. Jak zbudowany jest układ okresowy pierwiastków?
Układ okresowy pierwiastkówUkład okresowy pierwiastków to zestawienie w tabeli wszystkich pierwiastków chemicznych, uporządkowanych według rosnącej liczby atomowej. Pierwiastki są pogrupowane według cyklicznie powtarzających się podobieństw ich właściwości. Kolumny określa się mianem grup, a wiersze – mianem okresów. Grupy i okresy są ponumerowane.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DRTasMCl1
Zastanów się, jaką minimalnie liczbę parametrów należy podać, aby określić położenie pierwiastka w układzie okresowym? Na ile sposobów można opisać miejsce pierwiastka w tej tabeli?
Weź pod uwagę to, jak uporządkowane są pierwiastki w układzie okresowym. Czy kiedykolwiek grałeś w statki? Jeśli tak, to przypomnij sobie, w jaki sposób podawało się podczas gry położenie celu.
Jaką formę może przyjąć układ okresowy?
Niektórzy uczeni opracowali układy okresowe o różnych kształtach. Jednak sposób prezentowania pierwiastków w formie tabeli jest najpowszechniej stosowany. Został on zaakceptowany przez Międzynarodową Unię Chemii Czystej i Stosowanej – The International Union of Pure and Applied Chemistry, skrót IUPAC – (czyt. internaszional junion of piure and aplajd kemistry) organizację zajmującą się między innymi ujednolicaniem symboliki, nazewnictwa i wzorów stosowanych przez chemików na całym świecie.
Najprostsza wersja układu okresowego zawiera ponumerowane symbole pierwiastków chemicznych, numery grup i okresów. Istnieją jednak i takie jego wersje, które prezentują inne dodatkowe informacje (np. nazwy pierwiastków i ich właściwości, budowę ich atomów, wielkość atomów itp.). Niezależnie od tego, ile informacji o pierwiastkach zawierają układy okresowe, to zawsze kolejność pierwiastków, liczba grup oraz rodzaj pierwiastków w grupie i okresie w każdym układzie okresowym są identyczne.
3. Co łączy pierwiastki należące do jednej grupy?
Czy grupy mają swoje nazwy?
Wszystkim grupom nadano nazwy, które pochodzą od nazw pierwiastków znajdujących się na początku grupy. Pierwiastki należące do tej samej grupy mają podobne właściwości. Wyjątkiem jest wodór. Chociaż jest położony w grupie metali, to w rzeczywistości nie należy do żadnej z grup.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DRTasMCl1
4. Jak układ okresowy odzwierciedla podział pierwiastków na metale i niemetale?
Układ okresowy można umownie podzielić na dwie części. Pierwiastki na lewo od tej linii (oprócz wodoru) są metalami, na prawo zaś znajdują się niemetale.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DRTasMCl1

Film dostępny na portalu epodreczniki.pl
Prezentację rozpoczyna plansza z napisem: Jakie informacje o tlenie można uzyskać z układu okresowego? Pojawia się obraz układu okresowego w którym wyróżnione zostaje pole zawierające informacje o tlenie. Wyróżnione zostają również szesnasta grupa i drugi okres, gdzie pierwiastek ten się znajduje. Po lewej stronie pojawia się czarne pole, na którym znajduje się kwadrat z informacjami o tlenie wycięty z układu okresowego, zawierający nazwę i symbol pierwiastka, liczbę atomową 8 i liczbę masową 16, a także strzałki pozioma i pionowa z liczbami odpowiednio 16 i 2 symbolizujące grupę i okres pierwiastka. Układ okresowy z prawej stronie znika, a pojawia się stopniowo lista właściwości możliwych do odczytania z układu okresowego: okres 2, grupa 16, z 8, masa atomowa 16 oraz to, że tlen jest niemetalem.
Najmniejszy układ okresowy świata – wyczyn wpisany do Księgi rekordów Guinnessa (czyt. ginesa)
Naukowcy w Wielkiej Brytanii zapisali na ludzkim włosie cały układ okresowy pierwiastków. Użyli do tego bardzo precyzyjnych narzędzi (m.in. specjalnego rodzaju mikroskopu) i otrzymali układ o wymiarach 89,67 na 46,39 mikrometrów. Jak wiemy, 1 mikrometr odpowiada jednej tysięcznej milimetra. Tego układu okresowego nie bylibyśmy w stanie zobaczyć nieuzbrojonym w odpowiedni sprzęt okiem.

Podsumowanie
Układ okresowy pierwiastków jest uniwersalnym sposobem prezentacji pierwiastków chemicznych.
W układzie okresowym pierwiastki (ich symbole) są umieszczone kolejno w tabeli zgodnie z rosnącą liczbą atomową.
Pionowe kolumny tabeli nazywa się grupami, zaś poziome rzędy – okresami. Wszystkie grupy i okresy są ponumerowane.
Pierwiastki należące do jednej grupy mają zbliżone właściwości (wyjątkiem jest wodór).
Wyszukaj w układzie okresowym następujące pierwiastki:
pierwiastek z grupy helowców używany do wypełniania niektórych żarówek;
pierwiastek z grupy borowców stosowany do wyrobu puszek do napojów;
pierwiastek z drugiej grupy układu okresowego, główny składnik kości.
Słowniczek

Dymitr Mendelejew
Rosyjski chemik. Sformułował prawo okresowości pierwiastków, nazywane także na jego cześć prawem okresowości pierwiastków Mendelejewa. Korzystając z tego prawa, sklasyfikował ówcześnie znane pierwiastki chemiczne i stworzył tablicę zwaną układem okresowym pierwiastków. Podczas prac nad systematyką pierwiastków przewidział istnienie i trafnie określił właściwości nieznanych jeszcze wtedy pierwiastków.
tablica przedstawiająca wszystkie pierwiastki chemiczne, uporządkowane kolejno według rosnącej liczby atomowej, w grupach (obejmujących pierwiastki o podobnych właściwościach) i okresach (w których właściwości pierwiastków zmieniają się stopniowo)
Zadania
Zaznacz, które zdania są prawdziwe, a które – fałszywe.
| Prawda | Fałsz | |
| Wszystkie pierwiastki w danym okresie mają podobne właściwości. | □ | □ |
| Większość metali znajduje się w lewej części układu okresowego. | □ | □ |
| Pierwiastki należące do tej samej grupy układu okresowego mają jednakową liczbę atomową. | □ | □ |
| W układzie okresowym jest więcej metali niż niemetali. | □ | □ |
| W układzie okresowym są grupy, które zawierają zarówno metale, jak i niemetale. | □ | □ |
Uzupełnij puste miejsca w zdaniach, wybierając brakujące elementy z listy.
liczba atomowa pierwiastka, zbiory, okresy, zespoły, grupy, grupy, wielkość drobin pierwiastka, wykresu, tej samej grupy, zespoły, tego samego okresu, zbiory, listy pierwiastków, okresy, alfabet, tabeli
Układ okresowy pierwiastków przedstawiany jest w formie ........................................................... Kryterium uporządkowania pierwiastków w układzie okresowym jest ........................................................... Pionowe kolumny w układzie okresowym to ........................................................... Poziome rzędy w układzie okresowym to ........................................................... Pierwiastki należące do .......................................................... wykazują podobne właściwości.
Połącz pierwiastki (ich nazwy) z odpowiednim opisem położenia w układzie okresowym.
numer grupy: 11, numer okresu: 4, numer grupy: 17, numer okresu: 3, numer grupy: 14, numer okresu: 2, numer grupy: 2, numer okresu: 3
| magnez | |
| miedź | |
| chlor | |
| węgiel |
Określ liczby atomowe pierwiastków na podstawie informacji o ich położeniu w układzie okresowym. Połącz liczby atomowe z odpowiednim opisem położenia.
numer grupy: 2, numer okresu: 4, numer grupy: 11, numer okresu: 5, numer grupy: 16, numer okresu: 3, numer grupy: 15, numer okresu: 2
| 7 | |
| 16 | |
| 20 | |
| 47 |
Podziel podane pierwiastki na metale i niemetale. Przyporządkuj pierwiastki do odpowiednich kategorii.
cyna, hel, złoto, jod, srebro, miedź, chlor, neon, węgiel, wodór, krzem, potas, azot, tlen, sód, ołów
| metale | |
|---|---|
| niemetale |
Wstaw w odpowiednie miejsca tabeli symbole pierwiastków należących do 15. grupy układu okresowego, uwzględniając ich podział na metale i niemetale.
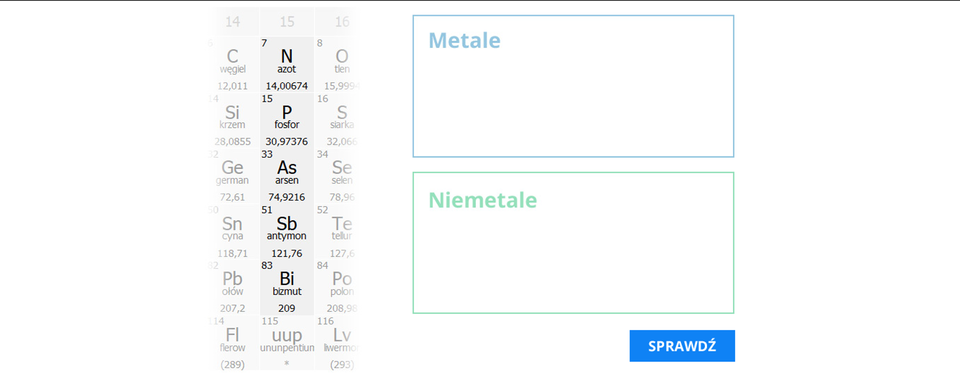
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DRTasMCl1