Wartościowość pierwiastków chemicznych
Podczas zgłębiania wiedzy chemicznej nie trzeba uczyć się wszystkiego na pamięć. Często wystarczy znajomość pewnych ogólnych reguł, które pozwalają na opisywanie nowych faktów. Przykładem są wzory sumaryczne niektórych związków, które w dość prosty sposób można prawidłowo zapisać na podstawie tylko jednej informacji o pierwiastkach tworzących substancję złożoną.
w jaki sposób atomy pierwiastków tworzą wiązania jonowe i kowalencyjne.
definiować pojęcie wartościowości;
odczytywać z układu okresowego maksymalne wartościowości pierwiastków chemicznych grup 1., 2. oraz od 13. do 17. układu okresowego w ich związkach z wodorem lub tlenem;
zapisywać wzory sumaryczne dwupierwiastkowych związków chemicznych na podstawie informacji o wartościowości tworzących ich pierwiastków;
określać wartościowość jednego pierwiastka chemicznego w związku, gdy znana będzie wartościowość drugiego;
rozpoznawać tlenek na podstawie jego wzoru sumarycznego;
zapisywać wzór sumaryczny tlenku, znając jego nazwę;
rysować wzory strukturalne dwupierwiastkowych związków chemicznych, wiedząc, jaka jest wartościowość pierwiastków, które je tworzą.
1. Co to jest wzór strukturalny cząsteczki?
Na podstawie wzorów sumarycznych związków kowalencyjnych można ustalić skład ich cząsteczek: liczbę i rodzaj atomów pierwiastków. Jednak nie jesteśmy w stanie przewidzieć, w jaki sposób atomy są ze sobą połączone. Tej informacji dostarcza inny wzór, zwany wzorem strukturalnymwzorem strukturalnym. Odzwierciedla on sposób połączenia atomów w cząsteczce. We wzorze strukturalnym, podobnie jak we wzorze sumarycznym, posługujemy się symbolami pierwiastków do oznaczenia atomów tworzących cząsteczkę związku chemicznego. Za pomocą kresek przedstawiamy wiązania pomiędzy atomami (jedna kreska symbolizuje jedno wiązanie).
Na przykład cząsteczka wody o wzorze sumarycznym ma następujący wzór strukturalny:

Na jego podstawie możemy stwierdzić, że w cząsteczce wody każdy atom wodoru jest połączony z atomem tlenu wiązaniem pojedynczym oraz że atomy wodoru nie są ze sobą związane. Wzór strukturalny nie określa, jak poszczególne atomy są ułożone w przestrzeni.
Czy można opisywać związki jonowe za pomocą wzorów strukturalnych?
Z uwagi na brak możliwości wyróżnienia w kryształach jonowych izolowanych struktur (cząsteczek) związków jonowych nie opisujemy za pomocą wzorów strukturalnych.

2. Co to jest wartościowość?
Liczbę wiązań, które tworzy atom danego pierwiastka chemicznego, łącząc się z innymi atomami, nazywa się wartościowościąwartościowością. Przy jej opisywaniu posługujemy się liczbami rzymskimi.
Wartościowość pierwiastków tworzących związek kowalencyjny możemy łatwo określić na podstawie wzoru strukturalnego związku.

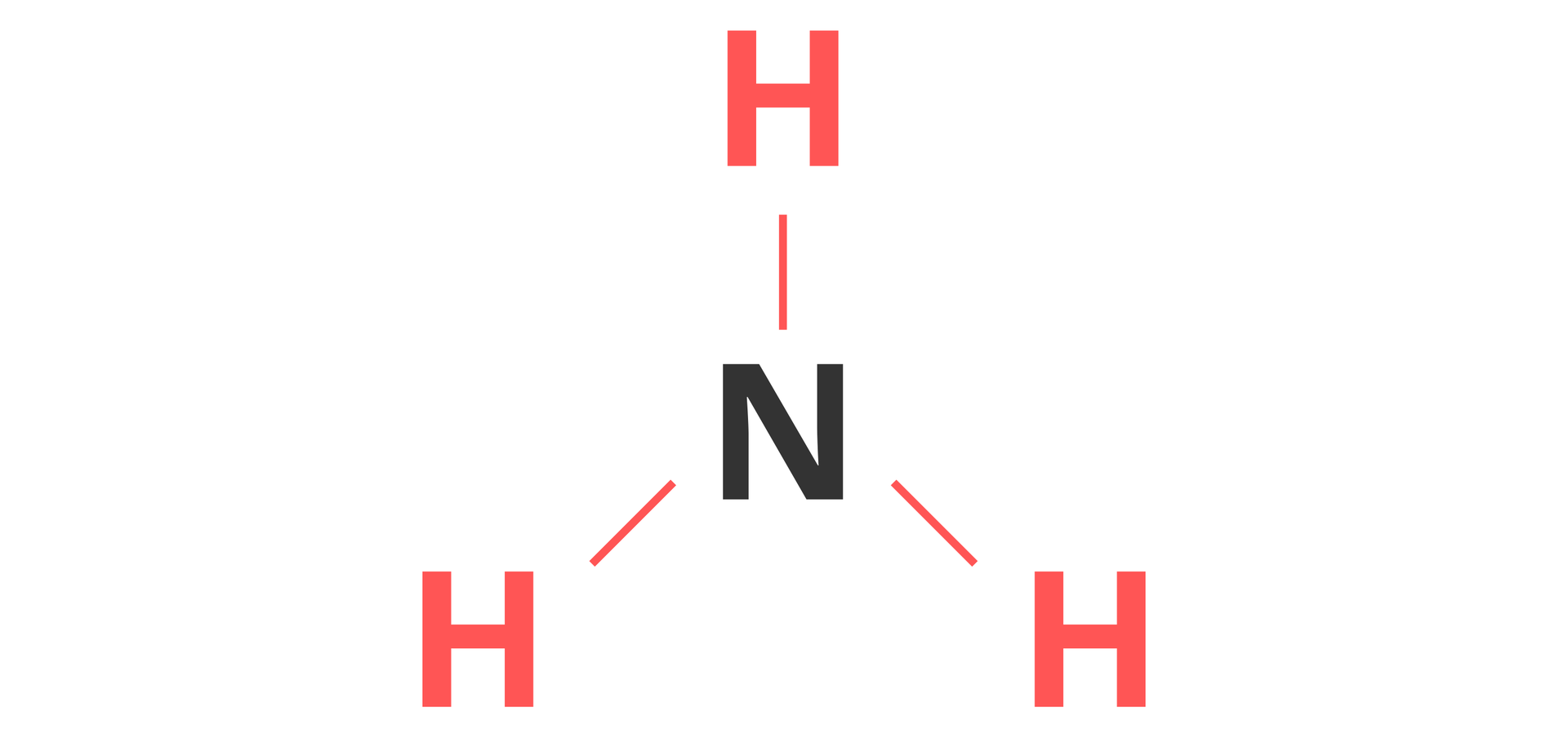
Jak określamy wartościowość pierwiastków chemicznych w związkach jonowych?
W przypadku związków jonowych wartościowość pierwiastka jest równa liczbowo ładunkowi jego jonu, który występuje w krysztale związku. Przy określaniu wartościowości jonów pomijamy znaki dodatnie i ujemne.

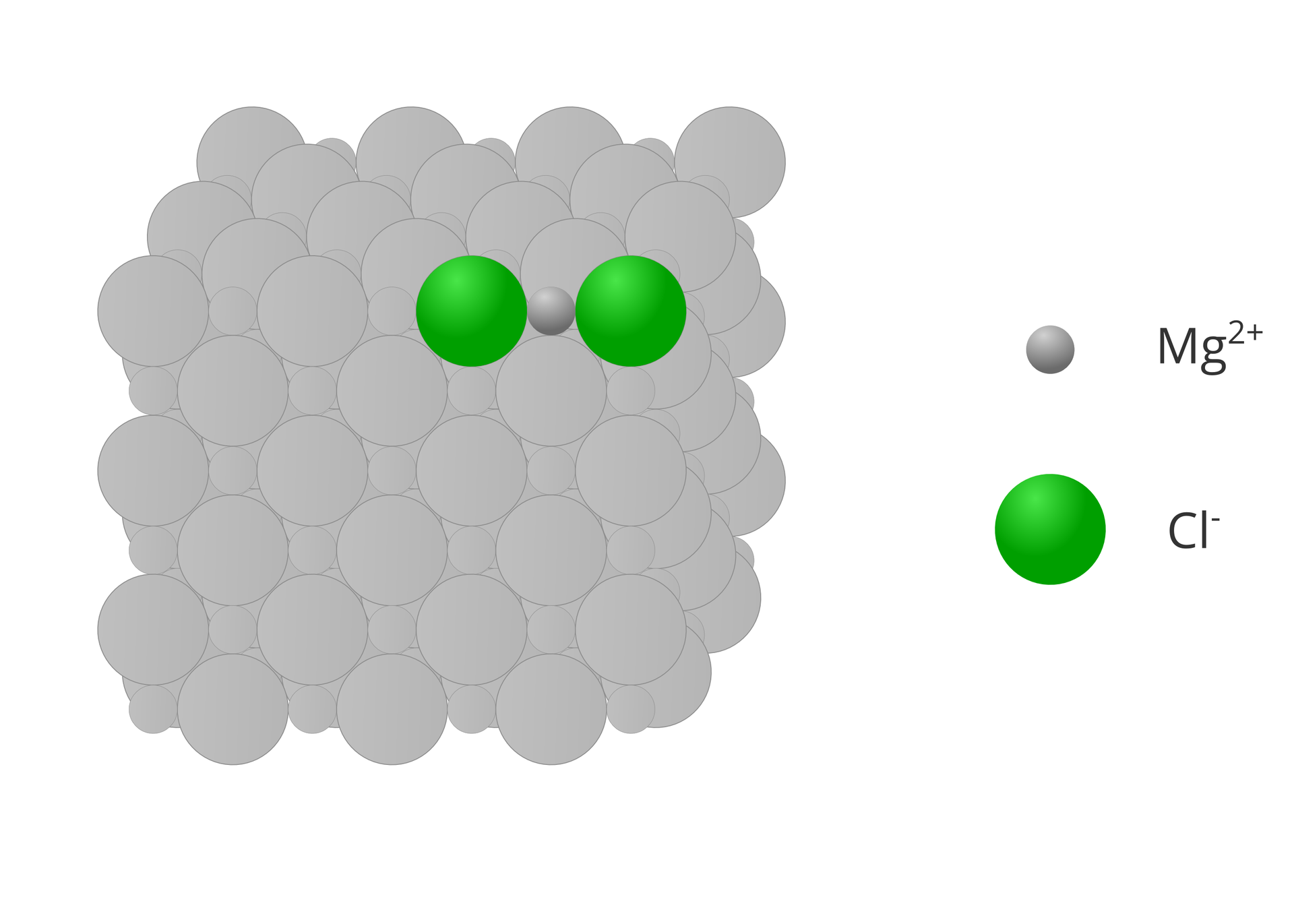
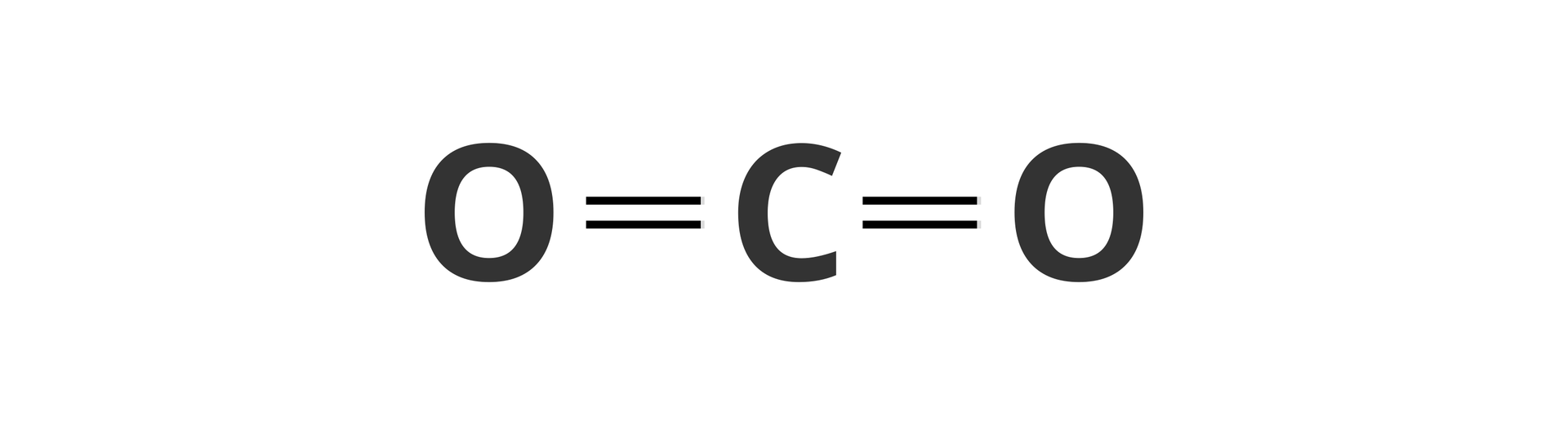
3. Czy pierwiastki mogą mieć dowolną wartościowość?
Są pierwiastki, których wartościowość w większości tworzonych przez nie związków chemicznych jest stała. Na przykład sód czy wodór zawsze mają wartościowość równą jeden (I). Istnieją również i takie pierwiastki, które w zależności od rodzaju związku mogą wykazywać różną wartościowość. Na przykład węgiel w związku o wzorze przyjmuje wartościowość równą dwa (II), a w dwutlenku węgla jego wartościowość wynosi cztery (IV).
Układ okresowy może stanowić pewną pomoc w przewidywaniu maksymalnej wartościowości niektórych pierwiastków w związkach z wodorem lub tlenem.
Numer grupy | 1. | 2. | 13. | 14. | 15. | 16. | 17. |
Najwyższa wartościowość w związkach z wodorem | I | II | III | IV | III | II | I |
Numer grupy | 1. | 2. | 13. | 14. | 15. | 16. | 17. |
Najwyższa wartościowość w związkach z tlenem | I | II | III | IV | V | VI | VII |
Na podstawie danych zawartych w tabelach można stwierdzić, że pierwiastki należące do grup: 1., 2., 13. i 14. mają jednakowe najwyższe wartościowości w związkach zarówno z tlenem, jak i wodorem. Natomiast różne są liczby określające wartościowości pierwiastków z pozostałych grup w związkach z tlenem i wodorem.
We wszystkich związkach pierwiastki należące do grupy 1. mają wartościowość równą jeden (I), natomiast pierwiastki z grupy 2. wykazują wartościowość dwa (II).
Określ największą wartościowość wapnia wobec wodoru i tlenu.
Skorzystaj z informacji zamieszczonych w tabelach.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DJcOxSKpe
4. Czy można określić wzór sumaryczny związku chemicznego na podstawie wartościowości tworzących go pierwiastków?
Jeśli znamy wartościowość dwóch pierwiastków, które razem tworzą związek chemiczny, to praktycznie w każdym przypadku jesteśmy w stanie określić wzór sumaryczny tego związku. Nie musimy przy tym wiedzieć, jaki rodzaj wiązań występuje w związku. W wielu wypadkach otrzymany wzór sumaryczny jest zgodny z rzeczywistością i dobrze opisuje skład cząsteczki lub najmniejszy zbiór powtarzających się jonów w związku jonowym. Ustalenie kolejności symboli we wzorze sumarycznym może stanowić pewien problem. Nie ma on znaczenia, jeśli związek jest utworzony przez metal i niemetal. Wtedy we wzorze sumarycznym jako pierwszy piszemy symbol metalu, a następnie z jego prawej strony wstawiamy symbol drugiego pierwiastka.
Jeden z prostszych sposobów określania wzorów sumarycznych poznamy na przykładach.
Zapisujemy poprawnie symbole pierwiastków we wzorze sumarycznym. Jako pierwszy wpisujemy symbol metalu, a jako drugi – symbol niemetalu. Potrzebne informacje możemy znaleźć w układzie okresowym.
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DJcOxSKpe
Nad każdym symbolem zapisujemy wartościowość pierwiastka (która jest podana w tytule instrukcji):

Następnie przenosimy do indeksów dolnych – sposobem „na krzyż” – cyfry odpowiadające wartościowościom. Zatem liczbę określającą wartościowość sodu zapisujemy w indeksie dolnym z prawej strony symbolu siarki, natomiast wartościowość siarki – po prawej stronie symbolu sodu:
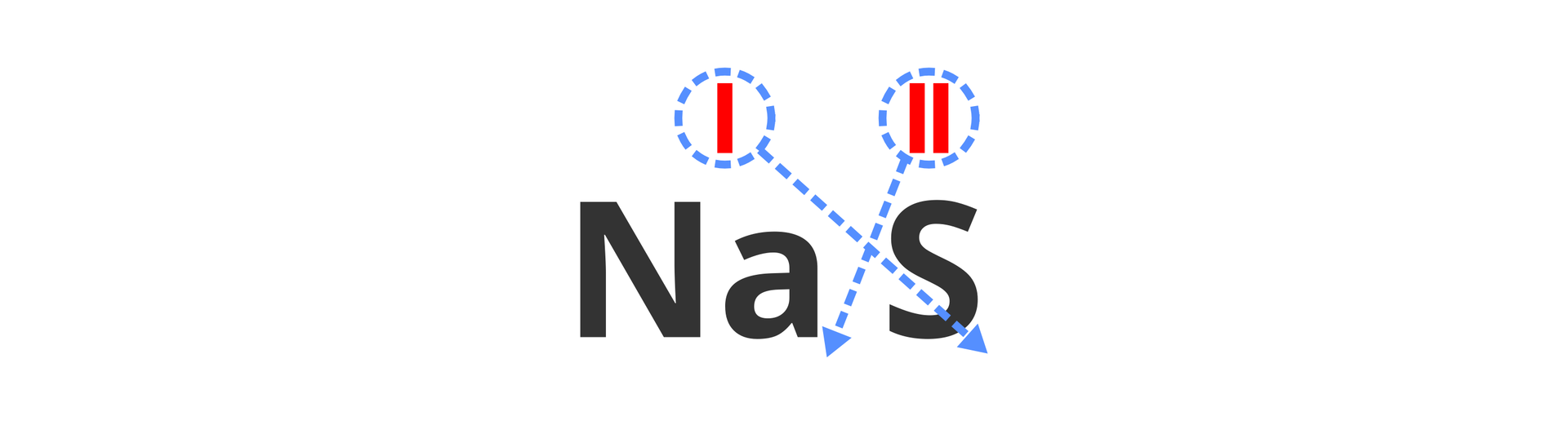
Przy przenoszeniu liczb zamieniamy liczby rzymskie na arabskie:
Cyfrę 1 we wzorze pomijamy. Prawidłowo zapisany wzór sumaryczny ma postać:
Zapisywanie wartościowości pierwiastków
Wartościowość pierwiastków możemy opisywać słownie, np. „węgiel ma wartościowość cztery”. Innym sposobem jest użycie chemicznych skrótów. Przy symbolu pierwiastka w nawiasie zapisuje się jego wartościowość, np. węgiel o wartościowości cztery to (IV) lub węgiel(IV). Trzeba pamiętać, że między symbolem a nawiasem nie powinno być odstępu (spacji).
Zapisujemy poprawnie symbole pierwiastków we wzorze sumarycznym. Jako pierwszy wpisujemy symbol metalu, na drugim miejscu – symbol niemetalu.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DJcOxSKpe
Nad każdym symbolem zapisujemy wartościowość pierwiastka (która jest podana w tytule instrukcji):

Następnie przenosimy do indeksów dolnych – sposobem „na krzyż” – cyfry odpowiadające wartościowościom:
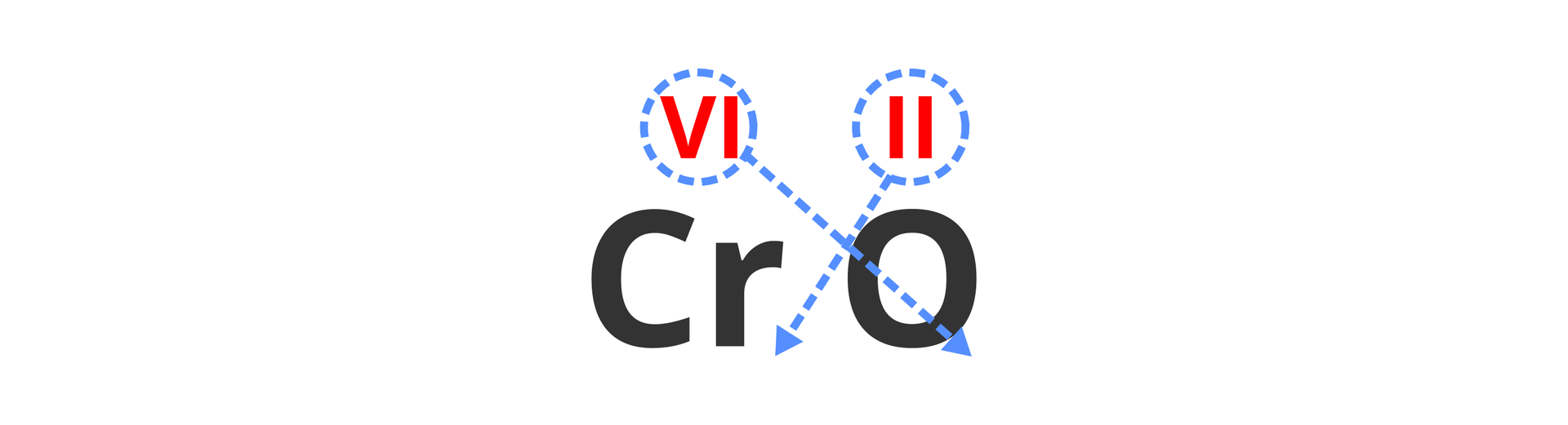
Przy przenoszeniu liczb zamieniamy liczby rzymskie na arabskie:
Staramy się, aby we wzorze sumarycznym w indeksach stechiometrycznych występowały liczby o jak najmniejszej wartości. Dlatego sprawdzamy, czy obie liczby nie mają wspólnego dzielnika (liczby, przez którą można je podzielić bez reszty). Liczby 2 i 6 dzielą się bez reszty przez dwa:

Po dokonaniu właściwych obliczeń (pamiętając, że liczbę 1 we wzorze pomijamy) otrzymujemy wzór sumaryczny związku:
Pierwiastki | Symbole zestawione z wartościowościami | Wzór po przeniesieniu wartościowości | Liczba – największy wspólny dzielnik | Ostateczny wzór sumaryczny związku |
węgiel(IV) i tlen(II) | 2 | |||
miedź(II) i siarka(II) | 2 | |||
azot(V) i tlen(II) | brak | |||
wapń(II) i chlor(I) | brak | |||
żelazo(III) i siarka(II) | brak | |||
mangan(VII) i tlen(II) | brak |
Połączenie fosforu(V) z tlenem(II)
Gdybyśmy chcieli zapisać wzór sumaryczny związku fosforu(V) i tlenu(II) zgodnie z poznanymi zasadami, to otrzymalibyśmy następujący zapis: . Mimo to zapisujemy: . Dlaczego? Badania wykazały, że cząsteczka tego związku składa się z czterech atomów fosforu i dziesięciu atomów tlenu. Wzór nie odzwierciedla tego faktu.
5. W jaki sposób ustalamy wartościowość jednego z pierwiastków w związku dwupierwiastkowym?
W związkach dwupierwiastkowych (utworzonych przez dwa pierwiastki) można określić wartościowość jednego pierwiastka, jeśli zna się wartościowość drugiego.
Jeśli we wzorze sumarycznym związku nie występują żadne indeksy stechiometryczne (lub w rzadkich przypadkach są sobie równe), to pierwiastki tworzące dany związek mają jednakową wartościowość. W związkach, które obecnie poznajecie (tlenki, chlorki, siarczki), tlen ma wartościowość dwa (II), chlor jeden (I), a siarka dwa (II).
Na przykład w związku o wzorze , w którym wartościowość tlenu wynosi dwa (II), miedź ma identyczną wartościowość (II). W chlorku sodu sód i chlor mają taką samą wartościowość – jeden (I).
W innych przypadkach należy dokonać odpowiednich przekształceń i obliczeń. Najprostszy ze sposobów poznamy na przykładzie.
Postępujemy odwrotnie niż w przypadku ustalania wzorów. Tym razem przenosimy współczynniki stechiometryczne „na krzyż” nad symbole pierwiastków.

Po przeniesieniu wartości indeksów zapisujemy za pomocą cyfr rzymskich:

Sprawdzamy, czy liczby zapisane nad symbolem pierwiastka o znanej wartościowości są zgodne z treścią zadania. W naszym wypadku tak jest, ponieważ chlor ma wartościowość jeden (I). Wtedy liczba zapisana nad symbolem drugiego pierwiastka określa jego wartościowość. Dla wapnia jest ona równa dwa (II).
Podajemy odpowiedź:
Wartościowość wapnia w związku o wzorze wynosi dwa (II).

Film dostępny na portalu epodreczniki.pl
Film rozpoczyna się planszą z tematem zadania: Jaka jest wartościowość osmu w związku OsO4, w którym wartościowość tlenu wynosi dwa. Po wygaszeniu napisu centralną część kadru zajmuje wzór związku, z którego indeksy 1 za symbolem osmu i 4 za symbolem tlenu zostają oznaczone na zielono i przeniesione na krzyż ponad symbole sąsiednich pierwiastków i zamienione z liczb arabskich nad rzymskie. Wyróżniona zostaje liczba jeden nad symbolem tlenu, a lektor wygłasza komentarz o konieczności pomnożeniu obu liczb tak, aby wartościowość tlenu zgadzała się z założoną. Po pomnożeniu przez dwa wartościowość tlenu zamienia się na dwa, a wartościowość osmu na osiem. Na ekranie pojawia się wniosek końcowy: Wartościowość osmu w związku z tlenem o wzorze OsO4 wynosi osiem.
6. W jaki sposób tworzymy nazwy tlenków na podstawie ich wzorów sumarycznych?
Związki tlenu z innymi pierwiastkami są nazywane tlenkami. Jedynym wyjątkiem jest związek tlenu z fluorem, zwany fluorkiem tlenu. We wszystkich tlenkach tlen ma wartościowość równą dwa. Na tej podstawie, znając wzór tlenku, możemy określać wartościowość pierwiastków w tlenkach.
Wzór sumaryczny tlenku | Wartościowość tlenu w tlenku | Wartościowość pierwiastka w tlenku |
tlen(II) | węgiel(IV) | |
węgiel(II) | ||
siarka(IV) | ||
siarka(VI) | ||
miedź(II) | ||
srebro(I) | ||
mangan(IV) | ||
chlor(VII) |
Nazwy tlenków są dwuczłonowe. Pierwszy człon to wyraz tlenek, a drugi – nazwa pierwiastka w dopełniaczu, np. tlenek sodu. Wiele pierwiastków tworzy po kilka tlenków, w których ich wartościowość jest różna. Przykładem są związki ołowiu z tlenem o wzorach sumarycznych: i .
W pierwszym tlenku ołów ma wartościowość cztery, w drugim zaś – dwa. Dlatego, aby jednoznacznie określić rodzaj związku, np. tlenku, w jego nazwie podaje się często wartościowość połączonego z tlenem pierwiastka. Omawiane powyżej związki o wzorach i to odpowiednio: tlenek ołowiu(IV) i tlenek ołowiu(II). W nazwach tlenków nie określa się wartościowości tlenu, gdyż zawsze wynosi ona dwa (II).
Wzór sumaryczny związku | Wartościowość tlenu w tlenku | Wartościowość pierwiastka w tlenku | Nazwa tlenku |
tlen(II) | węgiel(IV) | tlenek węgla(IV) | |
węgiel(II) | tlenek węgla(II) | ||
siarka(IV) | tlenek siarki(IV) | ||
siarka(VI) | tlenek siarki(VI) | ||
ołów(II) | tlenek ołowiu(II) | ||
ołów(IV) | tlenek ołowiu(IV) | ||
srebro(I) | tlenek srebra(I) | ||
miedź(II) | tlenek miedzi(II) | ||
mangan(IV) | tlenek manganu(IV) | ||
chlor(VII) | tlenek chloru(VII) |
Tworząc nazwy tlenków metali należących do grup 1. i 2., nie podaje się ich wartościowości, gdyż pierwiastki te mają w związkach chemicznych zawsze tylko jedną charakterystyczną wartościowość: metale grupy 1. – jeden, grupy 2. – dwa. Podobna zasada dotyczy glinu: z uwagi na to, że pierwiastek ten ma wartościowość trzy, przyjęło się nie podawać w nazwie związków jego wartościowości.
Żelazo znajduje się w układzie okresowym w grupie innej niż 1. i 2., dlatego w nazwie tlenku należy podać jego wartościowość. W związku z tym na początku ustalamy ten parametr.
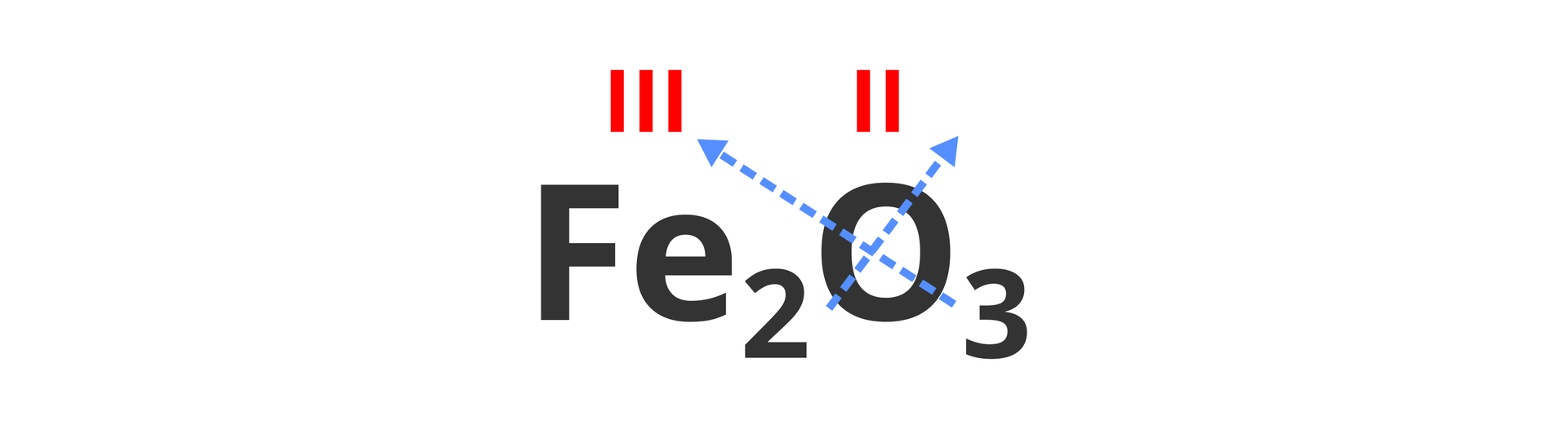
Po ustaleniu wartościowości żelaza, która wynosi trzy, możemy napisać nazwę tlenku.
Tlenek o wzorze sumarycznym nazywa się tlenkiem żelaza(III).
Grupa, do której należy pierwiastek | Wzór sumaryczny | Nazwa tlenków |
1. | tlenek sodu | |
tlenek potasu | ||
tlenek litu | ||
2. | tlenek wapnia | |
tlenek magnezu | ||
tlenek baru | ||
13. | tlenek glinu | |
14. | tlenek węgla(II) | |
tlenek węgla(IV) | ||
tlenek cyny(II) | ||
tlenek cyny(IV) | ||
tlenek ołowiu(II) | ||
tlenek ołowiu(IV) | ||
15. | tlenek azotu(II) | |
tlenek azotu(III) | ||
tlenek azotu(V) | ||
tlenek fosforu(V) | ||
16. | tlenek siarki(IV) | |
tlenek siarki(VI) | ||
17. | tlenek chloru(I) | |
tlenek chloru(IV) | ||
tlenek chloru(VII) |
7. W jaki sposób ustalamy wzory sumaryczne na podstawie nazwy?
Na podstawie pełnej nazwy tlenku w łatwy sposób można napisać jego wzór sumaryczny. Pamiętajmy, że wartościowość tlenu w tych związkach jest równa dwa. Wartościowość drugiego pierwiastka trzeba znać bądź też jest ona podana w nazwie. Jeśli pierwiastek należy do grupy 1. układu okresowego, to jego wartościowość będzie równa jeden, jeśli jest to pierwiastek położony w 2. grupie, to będzie miał wartościowość dwa.
Ustalamy wartościowość poszczególnych pierwiastków wchodzących w skład tlenku:
Pierwiastek | Reguła | Wartościowość |
tlen | tlen w tlenkach ma wartościowość równą dwa | II |
bar | bar leży w 2. grupie układu okresowego; pierwiastki tej grupy mają wartościowość dwa | II |
Zapisujemy wzór sumaryczny:
Ustalamy wartościowość poszczególnych pierwiastków wchodzących w skład tlenku:
Pierwiastek | Reguła | Wartościowość |
tlen | tlen w tlenkach ma wartościowość równą dwa | II |
azot | w nazwie podano wartościowość niemetalu | V |
Zapisujemy wzór sumaryczny tlenku azotu(V):
8. W jaki sposób tworzymy wzory strukturalne związków kowalencyjnych na podstawie znajomości wartościowości pierwiastków?
Ustalenie wzoru strukturalnego cząsteczki związku na podstawie jego wzoru sumarycznego nie zawsze jest możliwe. Na przykład bez wiedzy na temat istniejących połączeń pomiędzy poszczególnymi atomami nie narysujemy wzoru cząsteczki związku składającego się z trzech pierwiastków o wzorze sumarycznym . W przypadku związków dwupierwiastkowych jest to możliwe, jeśli zna się wartościowość obu pierwiastków. Najłatwiej narysować wzór cząsteczki zbudowanej z dwóch atomów. Przykładem jest cząsteczka powstała w wyniku połączenia azotu i tlenu, których wartościowość wynosi dwa. Ma ona następujący wzór strukturalny:
Oba atomy pierwiastków mają wartościowość równą dwa i tworzą po dwa wiązania.

Film dostępny na portalu epodreczniki.pl
Film rozpoczyna się planszą z tematem zadania: Narysuj wzór strukturalny związku cząsteczkowego zbudowanego z dwóch pierwiastków - azotu o wartościowości trzy i wodoru. Wyrazy azot i wodór zostały wyróżnione czerwonym kolorem. Na ekranie pojawiają się symbol azotu z zaznaczonymi trzema wolnymi wiązaniami na środku planszy oraz po lewej stronie symbol wodoru z jednym wolnym wiązaniem. Kreski symbolizujące wolne wiązania przy obu atomach są numerowane. Atom wodoru przemieszcza się i zajmuje miejsce przy jednym z wolnych wiązań azotu, a chwilę później zza dolnej i prawej krawędzi ekranu wyjeżdżają jeszcze dwa atomy uzupełniając wzór cząsteczki. W prawym dolnym rogu ekranu pojawia się wzór sumaryczny NH3.
Podsumowanie
Wartościowość jest cechą wszystkich pierwiastków tworzących związki chemiczne i jest to liczba wiązań, które tworzy atom danego pierwiastka, łącząc się z innymi atomami. Opisuje się ją przy użyciu liczb rzymskich.
Wartościowość pierwiastka w związkach kowalencyjnych jest równa liczbie wiązań, które tworzą w cząsteczkach jego atomy z innymi atomami.
Wartościowość pierwiastka w związkach jonowych jest równa ładunkowi jego jonów, z pominięciem znaków ujemnego i dodatniego.
Na podstawie układu okresowego można określić maksymalną wartościowość względem wodoru i tlenu dla pierwiastków z grup 1. i 2. oraz 13., 14., 15., 16. i 17.
Pierwiastki znajdujące się w grupie 1. układu okresowego w tworzonych związkach mają wartościowość równą jeden, z grupy 2. mają wartościowość dwa.
Tlen w tlenkach ma wartościowość dwa. Na podstawie tej informacji i wzoru sumarycznego związku można określić wartościowość drugiego pierwiastka w połączeniach z tlenem.
W nazwach tlenków podaje się wartościowość pierwiastka, który w związkach chemicznych może mieć różną wartościowość.
Podaj nazwę wody, używając w nazwie tego związku słowa „tlenek”.
Określ wartościowość węgla w jego związku z wodorem na podstawie wzoru sumarycznego i strukturalnego.
Czy zawsze na podstawie wzoru sumarycznego można wyznaczyć wartościowość?
Wzór sumaryczny związku:
Wzór strukturalny:

Słowniczek
wzór, który odzwierciedla sposób połączenia atomów w cząsteczce; na jego podstawie można określić liczbę, rodzaj atomów oraz ich wartościowość
liczba wiązań, które tworzy atom danego pierwiastka chemicznego, łącząc się z innymi atomami
Zadania
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| W związkach jonowych wartościowość pierwiastka można określić na podstawie ładunku jego jonów. | □ | □ |
| Wartościowość zapisujemy przy użyciu rzymskich liczb. | □ | □ |
| Wzory strukturalne pozwalają na ustalenie wartościowości. | □ | □ |
| Maksymalna wartościowość jaką może osiągnąć azot względem tlenu wynosi siedem. | □ | □ |
| Wartościowość chloru w związku z wodorem wynosi jeden. | □ | □ |
| Wartościowość metalu w związku o wzorze równa jest cztery. | □ | □ |
| Wartościowość chloru w chlorku sodu wynosi minus jeden. | □ | □ |
| Wzór sumaryczny tlenku pozwala określić wartościowość pierwiastka tworzącego tlenek. | □ | □ |
Uzupełnij luki w tekście. Wybierz właściwe określenia spośród podanych.
14., 15., 14., 2., 2., zawsze mają, III, 14., 13., 13., wodorkami, VII, 16., mogą mieć, 13., IV, 16., 17., II, 1., 15., 17., 16., I, tlenkami, VI, V, 1., VIII, metalikami, 15., 17.
Pierwiastki ........................ jednakową wartościowość we wszystkich związkach. Pierwiastki należące do grupy 1. układu okresowego mają we wszystkich związkach wartościowość ......................... Wartościowość równą dwa jest charakterystyczna dla pierwiastków ........................ grupy układu okresowego. Związki metali z tlenem nazywa się ......................... W nazwie tlenku nie podaje się wartościowości pierwiastków grupy ........................ i .........................
Uzupełnij luki w tekście. Wybierz właściwe określenie spośród podanych.
można, nie można, tylko jonowych, wszystkich, cząsteczkowej, tylko cząsteczkowych, jonowej
Wzór sumaryczny można zapisać dla .......................................... związków. Wzoru strukturalnego nie można przedstawić dla związków o budowie ........................................... Na podstawie wzoru strukturalnego .......................................... określić wartościowość atomów tworzących cząsteczkę.
Połącz wzory tlenków z ich nazwami.
<span aria-label="Mn indeks dolny, 2, O indeks dolny, 7" role="math"><math><mrow><msub><mtext>Mn</mtext><mtext>2</mtext></msub><msub><mtext>O</mtext><mtext>7</mtext></msub></mrow></math></span>, <span aria-label="PbO" role="math"><math><mrow><mi>PbO</mi></mrow></math></span>, <span aria-label="SO indeks dolny, trzy" role="math"><math><mrow><msub><mi>SO</mi><mn>3</mn></msub></mrow></math></span>, <span aria-label="PbO indeks dolny, dwa" role="math"><math><mrow><msub><mi>PbO</mi><mn>2</mn></msub></mrow></math></span>, <span aria-label="MnO indeks dolny, dwa" role="math"><math><mrow><msub><mi>MnO</mi><mn>2</mn></msub></mrow></math></span>
| tlenek ołowiu(II) | |
| tlenek ołowiu(IV) | |
| tlenek manganu(IV) | |
| tlenek manganu(VII) | |
| tlenek siarki(VI) |
Który zapis przedstawia wzór tlenku jodu(V)?
Wskaż nazwę związku o wzorze .
- tlenek ceru(III)
- tlenek ceru(II)
- tlenek ceru
- cerek tlenu(II)
- cerek(III) tlenu(II)
- tlenek ceru(V)
Wskaż nazwę związku o wzorze .
- tlenek rtęci(II)
- tlenek rtęci(I)
- tlenek rtęci(IV)
- tlenek wodoru
- tlenek magnezu
- tlenek helu
Jaką wartościowość ma tytan w tlenku o wzorze .
- IV
- I
- II
- VI
- VIII
Jaką wartościowość ma wanad w tlenku o wzorze .
- V
- I
- II
- III
- VI
Przyjmując, że symbolem metalu jest , wskaż wzór tlenku pierwiastka z 2. grupy układu okresowego.
Uporządkuj tlenki, kierując się rosnącą wartościowością metalu.
Uporządkuj tlenki zgodnie z wartościowością pierwiastka połączonego z tlenem.
<span aria-label="ZnO" role="math"><math><mrow><mi>ZnO</mi></mrow></math></span>, <span aria-label="CdO" role="math"><math><mrow><mi>CdO</mi></mrow></math></span>, <span aria-label="La indeks dolny, 2, O indeks dolny, 3" role="math"><math><mrow><msub><mtext>La</mtext><mtext>2</mtext></msub><msub><mtext>O</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="Cr indeks dolny, 2, O indeks dolny, 3" role="math"><math><mrow><msub><mtext>Cr</mtext><mtext>2</mtext></msub><msub><mtext>O</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="CO" role="math"><math><mrow><mi>CO</mi></mrow></math></span>, <span aria-label="Ag indeks dolny, 2, O" role="math"><math><mrow><msub><mtext>Ag</mtext><mtext>2</mtext></msub><mtext>O</mtext></mrow></math></span>, <span aria-label="N indeks dolny, 2, O indeks dolny, 3" role="math"><math><mrow><msub><mtext>N</mtext><mtext>2</mtext></msub><msub><mtext>O</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="Ce indeks dolny, 2, O indeks dolny, 3" role="math"><math><mrow><msub><mtext>Ce</mtext><mtext>2</mtext></msub><msub><mtext>O</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="CuO" role="math"><math><mrow><mi>CuO</mi></mrow></math></span>, <span aria-label="Na indeks dolny, 2, O" role="math"><math><mrow><msub><mtext>Na</mtext><mtext>2</mtext></msub><mtext>O</mtext></mrow></math></span>, <span aria-label="H indeks dolny, 2, O" role="math"><math><mrow><msub><mtext>H</mtext><mtext>2</mtext></msub><mtext>O</mtext></mrow></math></span>
| I | |
|---|---|
| II | |
| III |
Uporządkuj tlenki zgodnie z wartościowością pierwiastka połączonego z tlenem.
<span aria-label="PbO indeks dolny, dwa" role="math"><math><mrow><msub><mi>PbO</mi><mn>2</mn></msub></mrow></math></span>, <span aria-label="Nb indeks dolny, 2, O indeks dolny, 5" role="math"><math><mrow><msub><mtext>Nb</mtext><mtext>2</mtext></msub><msub><mtext>O</mtext><mtext>5</mtext></msub></mrow></math></span>, <span aria-label="ZrO indeks dolny, dwa" role="math"><math><mrow><msub><mi>ZrO</mi><mn>2</mn></msub></mrow></math></span>, <span aria-label="ClO indeks dolny, dwa" role="math"><math><mrow><msub><mi>ClO</mi><mn>2</mn></msub></mrow></math></span>, <span aria-label="I indeks dolny, 2, O indeks dolny, 5" role="math"><math><mrow><msub><mtext>I</mtext><mtext>2</mtext></msub><msub><mtext>O</mtext><mtext>5</mtext></msub></mrow></math></span>, <span aria-label="V indeks dolny, 2, O indeks dolny, 5" role="math"><math><mrow><msub><mtext>V</mtext><mtext>2</mtext></msub><msub><mtext>O</mtext><mtext>5</mtext></msub></mrow></math></span>, <span aria-label="CeO indeks dolny, dwa" role="math"><math><mrow><msub><mi>CeO</mi><mn>2</mn></msub></mrow></math></span>
| IV | |
|---|---|
| V |

