Interpretacja zapisów chemicznych
Język chemiczny nie służy do codziennej komunikacji, a jednak ma status języka międzynarodowego. Niezależnie od miejsca na kuli ziemskiej chemicy stosują te same znaki i symbole chemiczne do wyrażania ilości i rodzaju substancji. Rozkodowanie tych zapisów nie jest trudne, o ile zapamięta się kilka ważnych reguł.
że związki chemiczne to substancje złożone z co najmniej dwóch pierwiastków chemicznych połączonych trwale ze sobą;
że istnieją związki kowalencyjne zbudowane z cząsteczek i związki jonowe zbudowane z jonów;
że wzór sumaryczny substancji opisuje skład jej cząsteczki (substancje kowalencyjne) lub najmniejszy zbiór tworzących ją jonów (związki jonowe);
jakie są wzory sumaryczne następujących substancji: azotu, chloru, wodoru, wody, dwutlenku węgla, chlorowodoru, amoniaku, chlorku sodu, chlorku magnezu, chlorku glinu;
jak powstają jony sodu, magnezu, glinu, chlorkowe i siarczkowe.
odczytywania zapisów chemicznych przedstawiających atomy, cząsteczki i zespoły jonów.
1. Czy możemy określić budowę cząsteczki związku kowalencyjnego na podstawie jego wzoru?
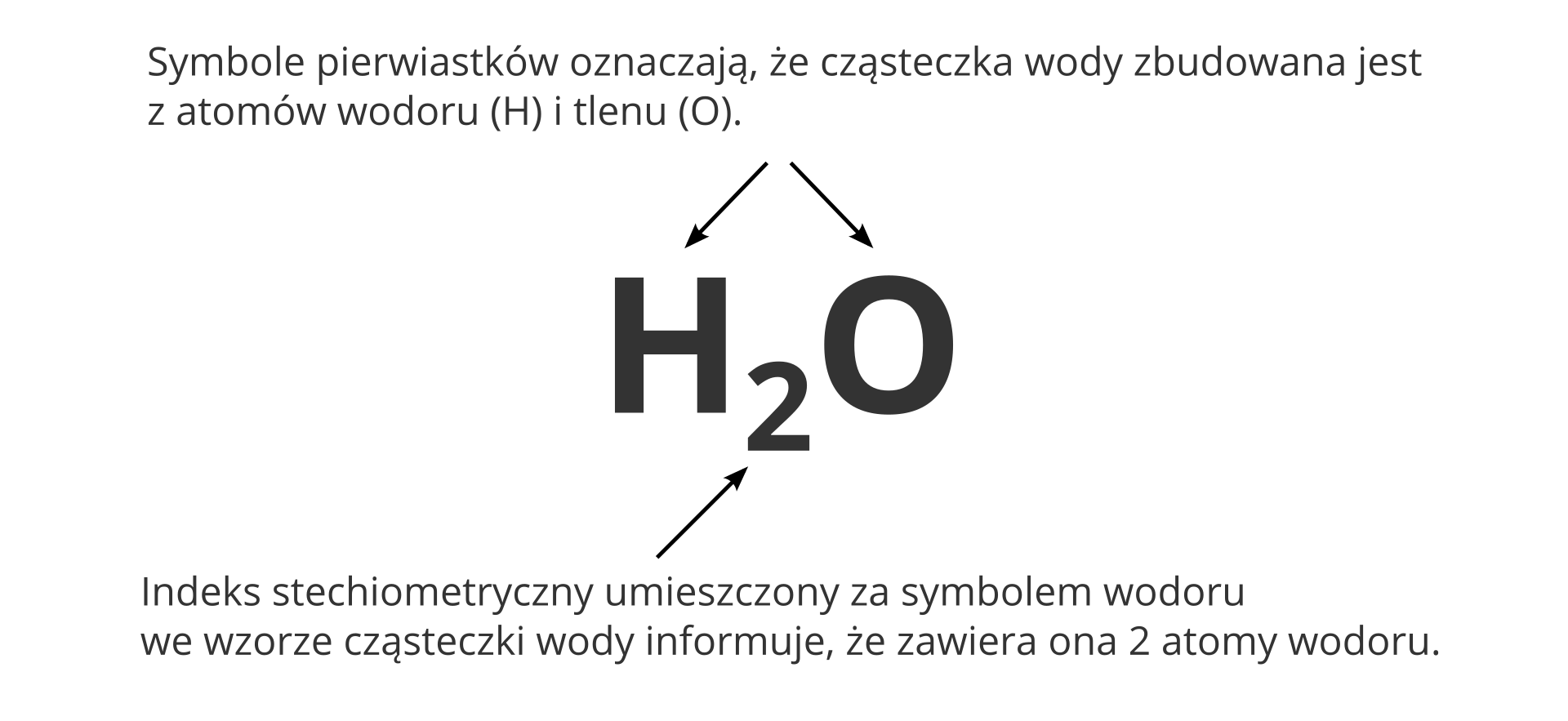
Wzór chemiczny związku kowalencyjnego opisuje budowę jego cząsteczek. Użyte we wzorach symbole pierwiastków informują o rodzaju atomów tworzących cząsteczkę, a cyfry umieszczone z prawej strony u dołu symbolu informują o ich liczbie. Cyfry, za pomocą których wyrażamy liczbę atomów w cząsteczce, nazywają się indeksami stechiometrycznymiindeksami stechiometrycznymi. Są one także nazywane indeksami dolnymi. Umieszcza się je we wzorze zawsze za symbolem pierwiastka, do którego atomów się odnoszą. Jeśli indeks stechiometryczny jest równy jedności, cyfry 1 nie wstawiamy. We wzorze chemicznym wody indeks stechiometryczny dla wodoru wynosi 2, a dla tlenu – 1. Na tej podstawie możemy powiedzieć, że cząsteczka wody składa się z dwóch atomów wodoru i jednego atomu tlenu.

Film dostępny pod adresem https://zpe.gov.pl/a/D1aAjQsf
Animacja wyjaśnia sposób tworzenia sumarycznego wzoru cząsteczki wody. Rozpoczyna się od rysunku modelu cząsteczki, czyli dużej czerwonej kuli przedstawiającej atom tlenu i dwóch mniejszych białych kul przedstawiających atomy wodoru. Na kulach pojawiają się symbole odpowiadających im pierwiastków, a punkty połączeń oznaczane są kreskami. W ten sposób powstaje wzór strukturalny kreskowy. Następnie znika obraz modelu cząsteczki, a następnie kreski łączące symbole pierwiastków. Leżące w jednej linii litery H powoli zbliżają się do siebie i łączą, zamieniając w literę H z dolnym indeksem 2. Znak ten przesuwa się następnie do góry i lokuje przed literą O, tworząc wzór sumaryczny cząsteczki wody.
Wzór to wzór amoniaku – substancji której cząsteczki są zbudowane z jednego atomu azotu i trzech atomów wodoru.

Film dostępny pod adresem https://zpe.gov.pl/a/D1aAjQsf
Animacja wyjaśnia sposób tworzenia sumarycznego wzoru cząsteczki amoniaku. Rozpoczyna się od rysunku modelu cząsteczki, czyli niebieskiej kuli przedstawiającej atom azotu i trzech mniejszych białych kul przedstawiających atomy wodoru. Na kulach pojawiają się symbole odpowiadających im pierwiastków, a kule stopniowo znikają. Pomiędzy symbolem azotu i symbolami wodoru pojawiają się łączące je kreski. W ten sposób powstaje wzór strukturalny kreskowy. Znikają kreski, a litery H powoli zbliżają się do siebie i łączą, zamieniając w literę H z dolnym indeksem najpierw 2, a potem 3. Znak ten przesuwa się następnie do góry i lokuje za literą O, tworząc wzór sumaryczny cząsteczki amoniaku.
Czy możemy określić skład cząsteczek związku kowalencyjnego bez znajomości jego nazwy?
Bez znajomości dokładnej budowy i nazwy substancji kowalencyjnej, a tylko na podstawie wzoru sumarycznego można określić skład jej cząsteczki (rodzaj tworzących ją atomów i ich liczbę). Na przykład ze wzoru możemy wywnioskować, że cząsteczka związku opisanego tym wzorem składa się z dwóch atomów wodoru, jednego atomu siarki i czterech atomów tlenu. Podobnie wzór mówi nam, że cząsteczka substancji o tym wzorze zbudowana jest z trzech atomów wodoru, jednego atomu fosforu i czterech atomów tlenu.
2. W jaki sposób opisujemy zbiory cząsteczek?
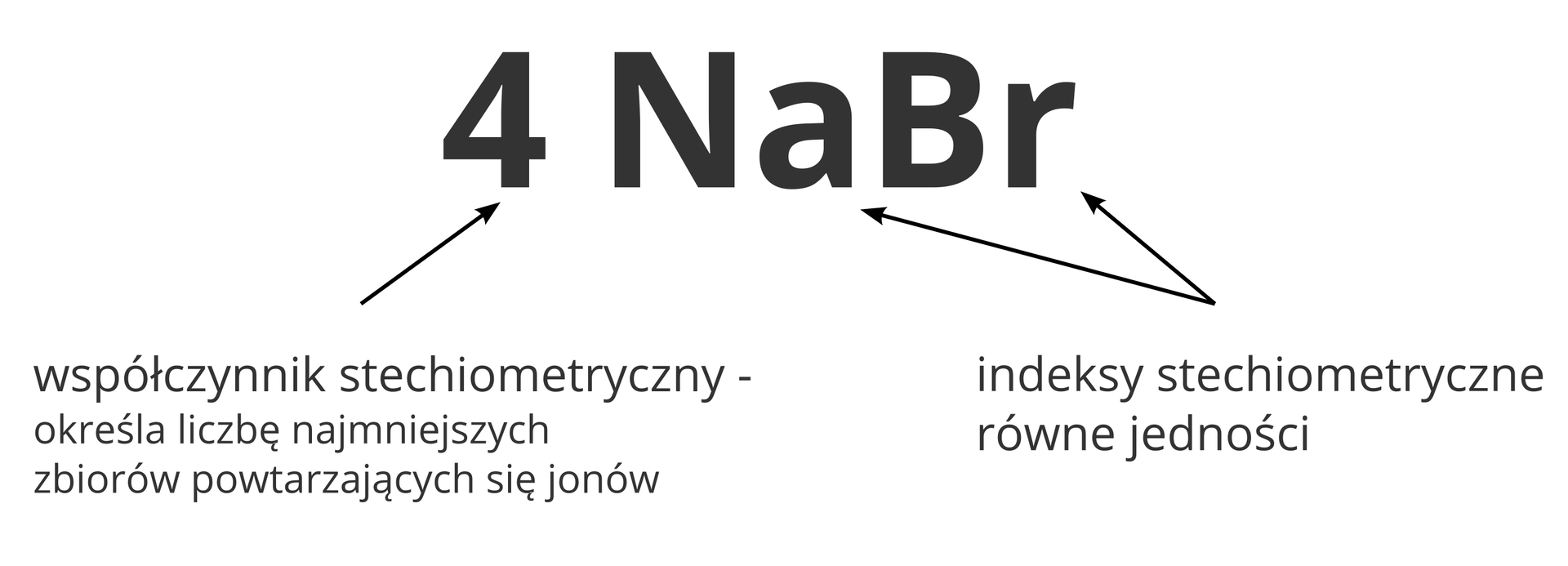
W sytuacji, gdy chcemy przedstawić zbiór składający się z więcej niż jednej cząsteczki, np. z trzech cząsteczek wody, to liczbę tych cząsteczek umieszczamy przed wzorem związku. Trzy cząsteczki wody (, , ) opiszemy jako . Liczbę umieszczoną przed wzorem związku nazywa się współczynnikiem stechiometrycznymwspółczynnikiem stechiometrycznym.

Spróbujmy określić liczbę poszczególnych atomów pierwiastków w zbiorze trzech cząsteczek wody: . Jedna cząsteczka zawiera dwa atomy wodoru i jeden atom tlenu, zaś w trzech znajduje się razem , czyli sześć atomów wodoru i , tj. trzy atomy tlenu.

Pięć cząsteczek amoniaku, , to łącznie () pięć atomów azotu i () piętnaście atomów wodoru.

Zapis symboliczny zbioru | Opis słowny zbioru | Liczba poszczególnych atomów pierwiastków | Liczba | ||||
cztery cząsteczki amoniaku | 12 | 4 | 16 | ||||
dwie cząsteczki chlorowodoru | 2 | 2 | 4 | ||||
sto cząsteczek dwutlenku węgla | 100 | 200 | 300 | ||||
milion cząsteczek tlenu | |||||||
kwadrylion cząsteczek azotu | |||||||

Film dostępny pod adresem https://zpe.gov.pl/a/D1aAjQsf
Prezentacja rozpoczyna się od planszy ze wzorem sumarycznym wody, H2O. Następuje wyróżnienie żółtym kolorem współczynnika 2 za atomem wodoru oraz pustej przestrzeni za atomem tlenu. Pojawia się podpis Indeksy stechiometryczne. Następuje zmiana planszy na zawierającą zdjęcie pełnej cukierniczki oraz wzorem sumarycznym sacharozy C12H22O11. Indeksy stechiometryczne węgla, wodoru i tlenu obecne we wzorze zostają wyróżnione pomarańczowym kolorem. Następnie pod wzorem cząsteczki pojawia się liczba 1, a na ekranie pojawiają się trzy kolejne, również numerowane wzory cząsteczek sacharozy. Wszystkie numery poza ostatnim, czwórką, znikają, a sama czwórka zostaje wyróżniona i przesunięta na środek ekranu, gdzie pod nią pojawia się podpis Współczynnik stechiometryczny, a za nią wzór sumaryczny cząsteczki sacharozy. Liczba 4 zostaje wyróżniona kolorem turkusowym, podobnie jak indeksy przy symbolach atomów. Poniżej pojawia się podsumowanie wprowadzonych pojęć: Indeks stechiometryczny opisuje, ile atomów poszczególnych pierwiastków tworzy cząstkę. Współczynnik stechiometryczny mówi o liczbie cząstek.
3. Niektóre pierwiastki mogą tworzyć cząsteczki. Jak je opisujemy?
Niektóre niemetale (np. azot, tlen, fluor, chlor, brom, jod, siarka i fosfor) występują w przyrodzie w stanie wolnym w postaci cząsteczek. Na przykład atomy tlenu tworzą przede wszystkim cząsteczki dwuatomowe , zbudowane z dwóch atomów (tlen atmosferyczny, składnik powietrza) oraz cząsteczki trójatomowe , zbudowane z trzech atomów (ozon, obecny w powietrzu w trakcie wyładowań atmosferycznych).
Indeks stechiometryczny przy symbolu pierwiastka równy liczbie 3 wskazuje, że cząsteczki ozonu są zbudowane z trzech atomów tlenu.
Współczynnik stechiometryczny zapisany przed symbolem (np. – 6 atomów chloru ) lub wzorem (np. – 6 cząsteczek chloru) informuje o liczbie atomów lub cząsteczek. Zapis wskazuje na 6 wolnych niezwiązanych atomów chloru, natomiast – na obecność 6 dwuatomowych cząsteczek chloru, czyli łącznie 12 atomów.


Zapis symboliczny | Opis słowny | Liczba poszczególnych atomów pierwiastków | ||||||
jeden atom wodoru | 1 | |||||||
jedna cząsteczka wodoru | 2 | |||||||
cztery atomy chloru | 4 | |||||||
cztery cząsteczki chloru | 8 | |||||||
sześć atomów azotu | 6 | |||||||
trzy cząsteczki azotu | 6 | |||||||
dziesięć atomów tlenu | 10 | |||||||
pięć cząsteczek tlenu | 10 | |||||||
dwie cząsteczki ozonu | 6 | |||||||
jeden atom jodu | 1 | |||||||
jedna cząsteczka jodu | 2 | |||||||
trzy atomy fosforu | 3 | |||||||
trzy cząsteczki fosforu | 12 | |||||||
sześć atomów siarki | 6 | |||||||
sześć cząsteczek siarki | 48 | |||||||
4. Jak interpretujemy zapisy dotyczące związków jonowych?
Związki jonowe powstają z połączenia metali z niemetalami. Związki te są zbudowane z jonów, które ułożone są naprzemiennie, tworzą uporządkowane struktury zwane kryształami. W krysztale nie występują izolowane grupy atomów, które można byłoby nazwać cząsteczkami. Wzór sumaryczny związku jonowego przedstawia zatem najmniejszy zbiór powtarzających się jonów w krysztale. Indeksy stechiometryczne określają liczbę jonów danego pierwiastka w tym zbiorze.
W związkach jonowych składających się z dwóch pierwiastków metal jest zawsze kationem, a niemetal – anionem. Przykładem takiego związku jest chlorek sodu. Jego wzór, , informuje, że kryształ chlorku sodu jest zbudowany z kationów sodu () i anionów chlorkowych (), a ich stosunek ilościowy wynosi 1 : 1.
Inna substancja jonowa, chlorek glinu, o wzorze , jest zbudowana z kationów glinu () i anionów chlorkowych (). W tym związku najmniejszy zbiór powtarzających się jonów tworzą jeden jon glinu (kation) i trzy jony chlorkowe (aniony).
W krysztale kolejnej substancji jonowej, siarczku potasu, o wzorze , na jeden anion siarczkowy () przypadają dwa kationy potasu ().
Liczby umieszczone przed wzorem związku jonowego (współczynniki stechiometryczne) określają liczbę najmniejszych zbiorów tworzących kryształ. Na przykład zapis oznacza dziesięć zbiorów składających się z jednego kationu sodu () i jednego anionu chlorkowego ().

Zapis symboliczny | Liczba poszczególnych jonów | ||||
kation glinu | anion chlorkowy | kation potasu | kation magnezu | anion siarczkowy | |
5 | 15 | ||||
14 | 7 | ||||
5. Jak interpretujemy zapisy chemiczne z użyciem prostych wzorów chemicznych?
Spróbujmy odczytać zapis dotyczący tlenku azotu(IV): . Aby dobrze zinterpretować to wyrażenie, musimy rozstrzygnąć, czy przedstawiony związek jest kowalencyjny, czy jonowy. Związek o wzorze składa się z dwóch niemetali. Jak pamiętamy, wiązania kowalencyjne są tworzone przez atomy niemetali, dlatego możemy sądzić, że wzór opisuje związek kowalencyjny, zbudowany z cząsteczek. W opisie zbioru można posługiwać się pojęciem cząsteczka. Liczba 4 umieszczona przed wzorem informuje, że w zbiorze znajdują się cztery cząsteczki. Każda z nich składa się z jednego atomu azotu i dwóch atomów tlenu (o czym informuje liczba 2 znajdująca się za ). Razem w zbiorze są () cztery atomy azotu i () osiem atomów tlenu.

Wzór opisuje inną substancję, bromek sodu, zbudowaną z metalu (sodu) i niemetalu (bromu). W związkach zbudowanych z metalu i niemetalu występują wiązania jonowe. Z tego względu możemy przyjąć, że związek o wzorze ma budowę jonową. Kationem jest jon utworzony z atomu metalu (sodu), a anionem – jon utworzony z atomu niemetalu (bromu). W najmniejszym zbiorze powtarzających się jonów w krysztale znajduje się jeden kation sodu () i jeden anion bromkowy ().
W zbiorze zapisanym jako znajdują się cztery kationy sodu () i cztery aniony bromkowe ().
6. Jak interpretujemy zapisy chemiczne z użyciem złożonych wzorów chemicznych?
W niektórych wzorach grupy atomów zapisuje się w nawiasie, po którym występuje liczba, np. . W zaprezentowanym zbiorze liczba 2 odnosi się do wszystkich atomów znajdujących się w nawiasie. Aby dokładnie pokazać, jak należałoby ilościowo rozumieć zastosowany zapis, rozpiszmy ten wzór:
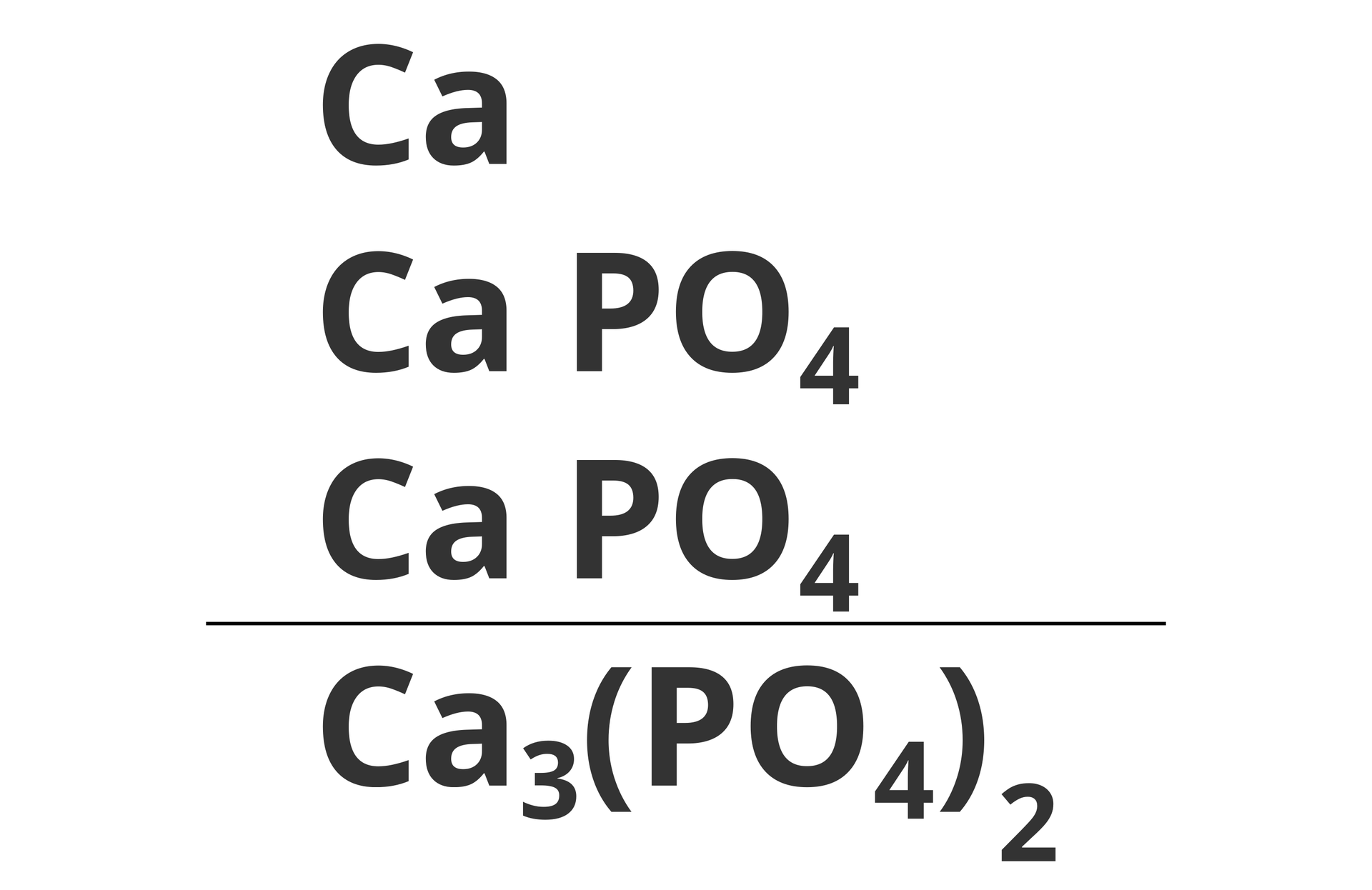
Podany wzór możemy zinterpretować następująco: w zbiorze znajdują się trzy atomy wapnia, dwa atomy fosforu () i osiem atomów tlenu ). W zbiorze opisanym wzorem mamy () sześć atomów wapnia (), cztery atomy fosforu i () szesnaście atomów tlenu.
Zapis chemiczny | Liczba atomów poszczególnych pierwiastków w zespole | Liczba wszystkich atomów | |||||||
2 | 3 | 5 | |||||||
6 | 9 | 15 | |||||||
1 | 2 | 2 | 5 | ||||||
4 | 4 | 12 | 20 | ||||||
6 | 8 | 2 | 16 | ||||||
4 | 2 | 4 | 10 | ||||||
Podsumowanie
Za pomocą wzorów chemicznych można przedstawiać określoną liczbę cząsteczek, atomów i jonów.
Liczbę atomów w cząsteczce bądź jonów w jednostce formalnej przedstawia się przy użyciu indeksu stechiometrycznego. We wzorze substancji liczbę tę zapisuje się z prawej strony u dołu symbolu pierwiastka.
Liczbę atomów, cząsteczek bądź jednostek formalnych związku jonowego określa się, wykorzystując współczynnik stechiometryczny – liczbę zapisywaną przed wzorem sumarycznym związku.
Pewna substancja jonowa ma wzór sumaryczny . Symbol oznacza metal, natomiast – niemetal. Które z podanych niżej jonów mogłyby tworzyć ten związek jonowy? Napisz wzór tego związku w zeszycie.
Jony do wyboru: , , , , .
Pamiętaj, że wzór sumaryczny przedstawia najmniejszy zbiór powtarzających się jonów w krysztale związku jonowego, który jest elektrycznie obojętny.
Słowniczek
liczba umieszczana u dołu z prawej strony symbolu pierwiastka we wzorze chemicznym substancji; jest ona równa liczbie atomów tego pierwiastka w cząsteczce lub w najmniejszym zbiorze powtarzających się jonów w krysztale (tzw. jednostce formalnej)
liczba zapisywana przed symbolem lub wzorem chemicznym, która określa liczbę atomów, cząsteczek lub najmniejszych zbiorów powtarzających się jonów w krysztale
Zadania
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Liczba zapisana w indeksie dolnym za symbolem pierwiastka we wzorze sumarycznym związku kowalencyjnego mówi o liczbie atomów w cząsteczce. | □ | □ |
| Cyfra zapisana przed wzorem chemicznym związku kowalencyjnego opisuje liczbę cząsteczek tego związku. | □ | □ |
| Indeks stechiometryczny nigdy nie równa się jeden. | □ | □ |
| Wzór sumaryczny związku jonowego przedstawia budowę jego cząsteczek. | □ | □ |
| Wzory sumaryczne związków jonowych nie zawierają indeksów stechiometrycznych. | □ | □ |
Uzupełnij luki w tekście. Wybierz właściwe określenia spośród podanych.
przed, najmniejszy, dołu, indeksu, współczynnika, największy, prawej, powtarzających się kationów, powtarzających się kationów i anionów, góry, współczynnikiem, powtarzających się anionów, indeksem, lewej, za
Liczba, która opisuje liczbę atomów danego pierwiastka w cząsteczce, nazywa się .................................................................................... stechiometrycznym. We wzorze znajduje się on u .................................................................................... po .................................................................................... stronie symbolu pierwiastka, którego dotyczy. Liczbę cząsteczek danego związku przedstawia się za pomocą .................................................................................... stechiometrycznego, który wstawia się .................................................................................... wzorem sumarycznym związku. Wzór sumaryczny związku jonowego przedstawia .................................................................................... zbiór .....................................................................................
Który zapis przedstawia dwie cząsteczki wody?
Połącz zapisy chemiczne z ich właściwą interpretacją.
osiem atomów wodoru, cząsteczka wodoru, dwa atomy wodoru, atom wodoru, dwie cząsteczki wodoru, cztery cząsteczki wodoru
Uporządkuj elementy według wzrastającej liczby wszystkich atomów w zbiorze.
Uporządkuj zbiory według wzrastającej liczby atomów tlenu w zbiorze.
Przenieś zapisy chemiczne do odpowiednich grup w zależności od liczby atomów wodoru w zbiorze, który opisują.
<span aria-label="2H indeks dolny, 2, SO indeks dolny, 4" role="math"><math><mrow><msub><mtext>2H</mtext><mtext>2</mtext></msub><msub><mtext>SO</mtext><mtext>4</mtext></msub></mrow></math></span>, <span aria-label="2H indeks dolny, 2, O" role="math"><math><mrow><msub><mtext>2H</mtext><mtext>2</mtext></msub><mtext>O</mtext></mrow></math></span>, <span aria-label="4H" role="math"><math><mrow><mtext>4H</mtext></mrow></math></span>, <span aria-label="HNO indeks dolny, 3" role="math"><math><mrow><msub><mtext>HNO</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="2NH indeks dolny, 3" role="math"><math><mrow><msub><mtext>2NH</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="H" role="math"><math><mrow><mtext>H</mtext></mrow></math></span>, <span aria-label="H indeks dolny, 2, O" role="math"><math><mrow><msub><mtext>H</mtext><mtext>2</mtext></msub><mtext>O</mtext></mrow></math></span>, <span aria-label="Ca nawias OH zamknięcie nawiasu indeks dolny, 2" role="math"><math><mrow><msub><mrow><mtext>Ca</mtext><mtext>(</mtext><mtext>OH</mtext><mtext>)</mtext></mrow><mtext>2</mtext></msub></mrow></math></span>, <span aria-label="3Mg nawias OH zamknięcie nawiasu indeks dolny, 2" role="math"><math><mrow><msub><mrow><mtext>3Mg</mtext><mtext>(</mtext><mtext>OH</mtext><mtext>)</mtext></mrow><mtext>2</mtext></msub></mrow></math></span>, <span aria-label="6H" role="math"><math><mrow><mtext>6H</mtext></mrow></math></span>, <span aria-label="NaOH" role="math"><math><mrow><mtext>NaOH</mtext></mrow></math></span>, <span aria-label="H indeks dolny, 2, SO indeks dolny, 4" role="math"><math><mrow><msub><mtext>H</mtext><mtext>2</mtext></msub><msub><mtext>SO</mtext><mtext>4</mtext></msub></mrow></math></span>, <span aria-label="H indeks dolny, 2" role="math"><math><mrow><msub><mtext>H</mtext><mtext>2</mtext></msub></mrow></math></span>, <span aria-label="2H indeks dolny, 2" role="math"><math><mrow><msub><mtext>2H</mtext><mtext>2</mtext></msub></mrow></math></span>
| jeden atom wodoru | |
|---|---|
| dwa atomy wodoru | |
| cztery atomy wodoru | |
| sześć atomów wodoru |