Wiązanie jonowe
Producenci wód mineralnych, jogurtów czy suplementów diety zachęcają klientów do kupna swoich produktów, posiłkując się takimi hasłami, jak: „Zawiera podwójną dawkę magnezu” albo „Produkt o obniżonej zawartości sodu” lub „Zawiera wapń”. W jakiej postaci wymienione metale występują zwykle w artykułach spożywczych?

co to są związki chemiczne;
jak zapisać konfigurację elektronową niektórych pierwiastków;
że atomy mogą łączyć się w cząsteczki.
wyjaśniać, co to są jon, kation, anion;
przedstawiać, w jaki sposób z atomów powstają jony;
opisywać, jak tworzy się wiązanie jonowe;
porównywać właściwości związków jonowych i kowalencyjnych.
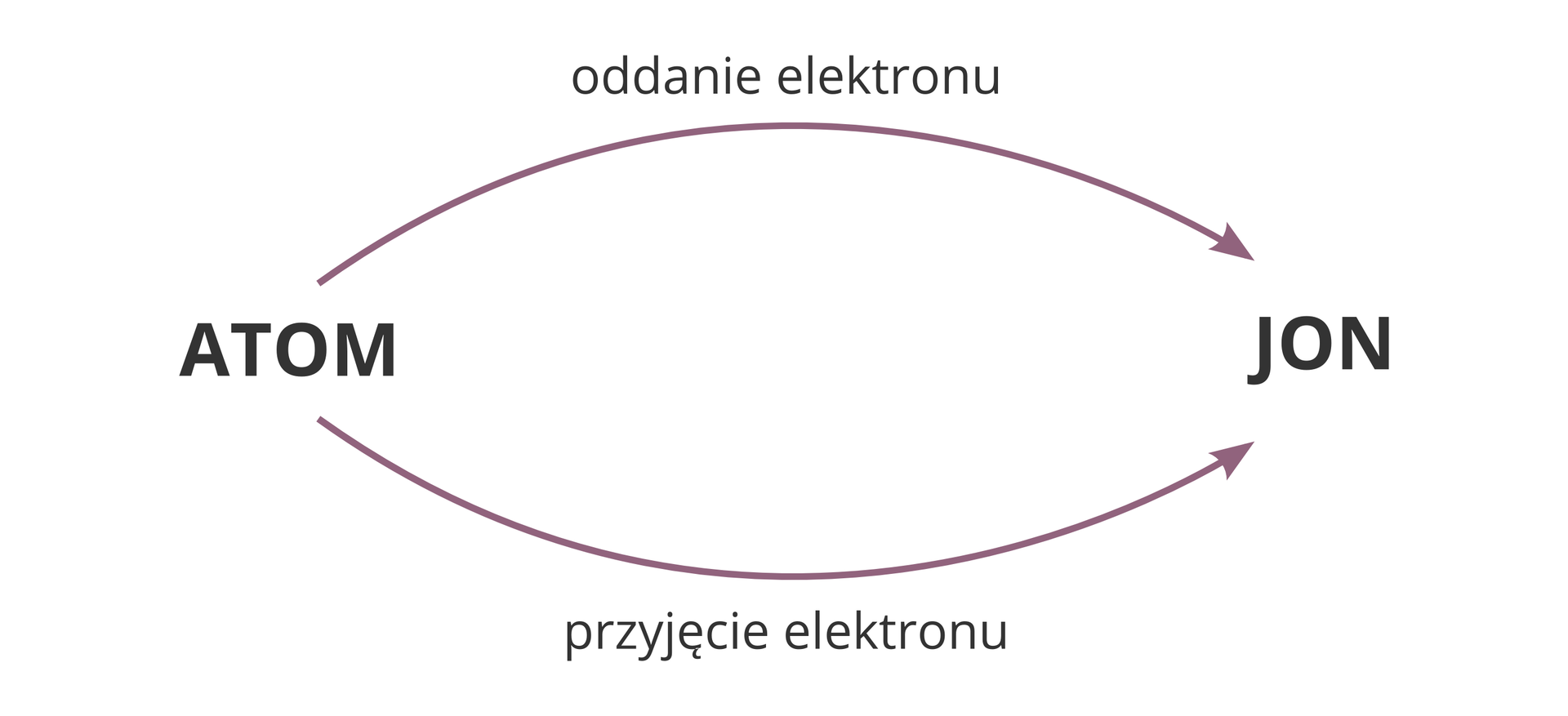
1. Powstawanie jonów
Większość pierwiastków chemicznych nie występuje w przyrodzie w stanie wolnym, lecz tworzy z innymi pierwiastkami związki chemiczne. Tylko nieliczne substancje proste występują w postaci pojedynczych atomów. Należą do nich gazy szlachetne, czyli pierwiastki chemiczne należące do 18. grupy układu okresowego (helowce). Ich stosunkowo trwała konfiguracja elektronowa jest wzorem dla innych pierwiastków. Podczas tworzenia typowych wiązań chemicznych atomy pierwiastków dążą do uzyskania konfiguracji elektronowej, jaką ma najbliższy im w układzie okresowym helowiec. Odbywa się to w różny sposób. Atomy pierwiastków mogą uwspólniać elektrony. Mogą także je oddawać innym atomom pierwiastków bądź je od nich przyjmować. W wyniku tych procesów z atomów powstają jonyjony.
2. Jak powstaje jon sodu?
W wyniku przekazania elektronu z atomu sodu powstaje jon. Jak pamiętasz, w każdym atomie dodatni ładunek jądra jest równy ujemnemu ładunkowi chmury elektronowej (liczba protonów jest równa liczbie elektronów), a atom jest elektrycznie obojętny. Zauważ, że w jonie sodu liczby protonów i elektronów nie są identyczne: w jądrze atomowym występuje 11 protonów, a w przestrzeni wokół jądra porusza się 10 elektronów. Zatem 1 proton nie jest „zrównoważony” przez elektron. Dlatego cały jon ma ładunek protonu (o wartości równej elementarnemu ładunkowi dodatniemu). O jonie sodu mówi się, że jest dodatni. Jon ten opisuje się za pomocą znaku „+” przy symbolu pierwiastka chemicznego: .
Na poniższym schemacie przedstawiono zmiany konfiguracji elektronowej atomu sodu podczas powstawania jonu.

Mechanizm powstawania dodatniego jonu sodu można zapisać przy użyciu wzoru elektronowego lub tylko symbolu pierwiastka chemicznego:
Proces powstawania jonów sodu możemy także przedstawić, posługując się konfiguracjami elektronowymi atomu i jego jonu:
Atom sodu ma 11 elektronów. Jeden z nich zajmuje ostatnią powłokę. Po jego oddaniu atom sodu ma 10 elektronów i konfigurację elektronową najbliższego mu w układzie okresowym gazu szlachetnego – neonu. Dzięki temu zyskuje oktet elektronowy – trwałą konfigurację.
3. Jak powstaje jon chloru?
W wyniku przyjęcia elektronu przez atom chloru powstaje jon. Z uwagi na obecność dodatkowego elektronu jon ten jest obdarzony ładunkiem ujemnym (o wartości równej elementarnemu ładunkowi ujemnemu). Opisuje się go za pomocą znaku „–” przy symbolu pierwiastka chemicznego:
Proces powstawania tego jonu można opisać równaniami:
Na poniższym schemacie przedstawiono zmiany konfiguracji elektronowej atomu chloru podczas powstawania jonu.

Jak pamiętasz, atom chloru w cząsteczkach czy , aby osiągnąć oktet elektronowy, uwspólnia jeden elektron z innym atomem. Jednak w obecności atomu sodu zachowuje się inaczej – przyjmuje od niego elektron na swoją zewnętrzną powłokę. Liczba jego elektronów zwiększa się wówczas o 1 i atom zyskuje konfigurację elektronową właściwą dla argonu, który w układzie okresowym jest położony zaraz za chlorem.
4. Rodzaje jonów
Jony o ładunku dodatnim nazywa się kationamikationami, natomiast te o ładunku ujemnym – anionamianionami. Jon sodu, który powstał w wyniku oddania przez atom sodu elektronu, jest kationem. Z kolei atom chloru, który przyjął elektron, staje się anionem.
Atomy metali (szczególnie tych należących do 1. i 2. grupy układu okresowego) tworzą kationy. Atomy niektórych niemetali mogą w wyniku przyjęcia elektronów tworzyć aniony.

5. Jakie wartości ładunków mogą mieć jony?
Atomy mogą oddawać i przyjmować więcej niż 1 elektron.
Jon magnezu
W atomie magnezu () znajduje się 12 protonów i tyle samo elektronów. Podczas oddziaływań z innymi atomami atom może „pozbyć się” 2 elektronów tworzących jego zewnętrzną powłokę elektronową. W powstałym jonie liczba elektronów zmniejsza się i występuje w nim nadmiar ładunków dodatnich (12 p) w stosunku do ujemnych (10 ). Dlatego jon magnezu jest kationem, a jego ładunek jest równy dwóm elementarnym ładunkom dodatnim. O takich kationach mówi się, że są dwudodatnie i zapisuje w następujący sposób: .
Proces powstawania jonów magnezu można przedstawić za pomocą równania:
Zmiany w konfiguracjach elektronowych atomu i kationu magnezu są następujące:
Zauważ, że kation magnezu osiągnął uznawaną za trwałą konfigurację elektronową neonu ().
Jon siarczkowy
Atom siarki tworzy dwuujemny jon.
Film dostępny na portalu epodreczniki.pl
Nagranie prezentuje proces i zasadę powstawania jonu siarczkowego z atomu siarki. Rozpoczyna się ujęciem białej planszy z czarnym paskiem po lewej stronie na którym prezentowane jest pole zawierające dane na temat siarki pochodzące z układu okresowego pierwiastków. Na białej części ekranu prezentowane są następujące dane na temat tego pierwiastka: liczba elektronów i protonów równa 16 oraz rozpiska powłok elektronowych wraz z liczbą elektronów na każdej z nich. Przy symbolu powłoki walencyjnej M pojawia się prowadząca do niej strzałka z napisem +2 elektrony. Pojawia się schematyczny zapis procesu: atom siarki po przyłączeniu 2 elektronów tworzy na ostatniej powłoce oktet elektronowy i staje się jonem siarczkowym. Następnie na czarnym pasku pojawia się zestawienie liczby protonów i elektronów w atomie siarki, a także w jonie siarczkowym. Zgodnie z uzyskanym wnioskiem jon siarczkowy charakteryzuje się nadmiarem 2 elektronów, co prowadzi do wydedukowania jego symbolu: S2-.
Jon glinu
Atom glinu tworzy jony glinu o wzorze . Liczba „3+” oznacza, że powstały jon jest kationem, który utworzył się po oddaniu przez atom glinu 3 elektronów. Powstawanie jonu glinu można opisać następującym równaniem:
Po uwzględnieniu konfiguracji elektronowej ma ono postać:
Konfiguracja elektronowa w kationie glinu jest taka sama jak w atomie neonu ().
6. Porównanie atomów i jonów
Po przyjęciu lub oddaniu 1 lub więcej elektronów atomy zmieniają swoje rozmiary. Kationy mają mniejszy promień niż atomy, z których powstają, natomiast aniony – większy.
Porównaj cechy budowy wybranych atomów i ich jonów.
Symbol pierwiastka/wzór jonu | |||||||||||
Liczba | atomowa | 11 | 11 | 12 | 12 | 13 | 13 | 16 | 16 | 17 | 17 |
protonów | 11 | 11 | 12 | 12 | 13 | 13 | 16 | 16 | 17 | 17 | |
elektronów | 11 | 10 | 12 | 10 | 13 | 10 | 16 | 18 | 17 | 18 | |
Ładunek elektryczny | jednododatni | dwudodatni | trójdodatni | dwuujemny | jednoujemny | ||||||
Nazwa | atom sodu | kation sodu | atom magnezu | kation magnezu | atom glinu | kation glinu | atom siarki | anion siarczkowy | atom chloru | anion chlorkowy | |
Konfiguracja elektronowa | [2, 8, 1] | [2, 8] | [2, 8, 2] | [2, 8] | [2, 8, 3] | [2, 8] | [2, 8, 6] | [2, 8, 8] | [2, 8, 7] | [2, 8, 8] | |
Symbol helowca o tej samej konfiguracji elektronowej | – | – | – | – | – | ||||||
Film dostępny na portalu epodreczniki.pl
Nagranie zaczyna się od planszy prezentującej model atomu sodu w postaci dużej białej kuli z napisem Na. Z kuli wychodzi niebieska strzałka podpisana elektron, w wyniku czego promień kuli wyraźnie się zmniejsza, a oznaczenie cząstki zmienia się na Na+. Pojawiają się napisy: promień kationu równy jest 98 pikometrów, promień atomu równy jest 186 pikometrów. Zestawienia promieni atomu sodu i jego kationu zostają umieszczone po lewej stronie ekranu na czarnym pasku, a w obszarze głównym prezentowana jest analogiczny proces dla atomu magnezu: oddanie 2 elektronów, zmniejszenie średnicy kulki symbolizującej magnez, zmiana symbolu Mg na Mg2+. Pojawiają się dane liczbowe: promień kationu równy 78 pikometrów, promień atomu równy 160 pikometrów. Film kończy zestawienie modeli atomów i kationów obydwu omawianych pierwiastków oraz wyświetlenie wniosku końcowego, odczytanego również przez lektora.
Film dostępny na portalu epodreczniki.pl
Nagranie zaczyna się od planszy prezentującej model atomu chloru w postaci dużej białej kuli z napisem Cl. W kulę wnika niebieska strzałka podpisana przyjęcie jednego elektronu, w wyniku czego promień kuli wyraźnie się powiększa, a oznaczenie cząstki zmienia się na Cl+. Pojawiają się napisy: promień anionu równy jest 181 pikometrów, promień atomu równy jest 99 pikometrów. Zestawienia promieni atomu chloru i jego anionu zostają umieszczone po lewej stronie ekranu na czarnym pasku, a w obszarze głównym prezentowana jest analogiczny proces dla atomu siarki: przyjęcie 2 elektronów, zwiększenie się średnicy kulki symbolizującej siarkę, zmiana symbolu S na S2-. Pojawiają się dane liczbowe: promień kationu równy 184 pikometry, promień atomu równy 104 pikometry. Film kończy zestawienie modeli atomów i anionów obydwu omawianych pierwiastków oraz wyświetlenie wniosku końcowego, odczytanego również przez lektora.
7. Wiązanie jonowe (struktura jonowa)
Dążenie do osiągania konfiguracji elektronowej najbliższego w układzie okresowym gazu szlachetnego to podstawowa przyczyna powstawania wiązań chemicznych. Atomy niektórych pierwiastków, aby osiągnąć odpowiednią liczbę elektronów na ostatniej powłoce, tworzą wspólne pary elektronowe, inne – oddają lub przyjmują elektrony. Przykładem związku chemicznego, który może powstać w wyniku oddawania i przyjmowania elektronów, jest chlorek sodu , czyli sól kuchenna.
Mechanizm powstawania jonów z atomów sodu i chloru można opisać następująco:

Każdy z atomów pierwiastków w chlorku sodu osiąga konfigurację elektronową najbliższego w układzie okresowym gazu szlachetnego: kation sodu – neonu, anion chlorkowy – argonu.
Chlorek sodu ma inne właściwości niż sód i chlor, pierwiastki chemiczne, z których został utworzony. Chlorek sodu jest zbudowany z kationów sodu i anionów chlorkowych, które jako jony o przeciwnych znakach wzajemnie się przyciągają siłami elektrostatycznymi. Tego rodzaju połączenia w związkach chemicznych nazywa się wiązaniami jonowymi.
Wiązanie jonoweWiązanie jonowe to rodzaj wiązania chemicznego, które powstaje w wyniku przyciągania się jonów o przeciwnych znakach. O związkach chemicznych, w których występuje wiązanie jonowe, mówi się, że są to związki jonowe. Jony o tym samym ładunku odpychają się, a więc nie mogą znajdować się obok siebie. Z tego powodu w związku jonowym kationy i aniony są ułożone naprzemiennie. Struktura, którą tworzą, jest nazywana kryształem jonowym. W krysztale związku jonowego każdy kation otoczony jest przez aniony, a każdy anion – przez kationy.
8. Jak zbudowane są związki jonowe?
Związki jonowe są zbudowane z jonów o przeciwnych znakach. Jony te przyciągają się w wyniku sił elektrostatycznych. Związek jonowy – chlorek sodu – w temperaturze pokojowej jest substancją stałą składającą się z naprzemiennie ułożonych jonów sodu i chlorkowych. Liczby kationów i anionów w kryształach związków jonowych są takie, że w efekcie kryształ jest elektrycznie obojętny (nie jest obdarzony ładunkiem elektrycznym). W przypadku chlorku sodu na jeden kation sodu przypada jeden anion chlorkowy . Wzór sumaryczny tego związku to . Zapis: podkreśla, że związek ten jest złożony z jonów.
Związki jonowe nie są zbudowane z cząsteczek. W ich kryształach można wyróżnić najmniejszy zbiór powtarzających się kationów i anionów, który odpowiada wzorowi sumarycznemu związku.

Innym przykładem związku jonowego jest chlorek magnezu, zbudowany z kationów magnezu oraz anionów chlorkowych .

Jak każdy związek jonowy chlorek magnezu jest zbudowany z naprzemiennie ułożonych jonów: kationów i anionów.

Wzór sumaryczny chlorku magnezu to: .
Budowę jonową ma także chlorek glinu. Jest to substancja składająca się z kationów glinu i anionów chlorkowych . W krysztale, który tworzy, na 1 trójdodatni jon glinu przypadają 3 jednoujemne jony chlorkowe . Dlatego wzór sumaryczny tego związku chemicznego to: .
Wiązania jonowe powstają między metalami a niektórymi niemetalami.
Związek jonowy | Chlorek magnezu | Chlorek glinu | Siarczek sodu |
Kation | |||
Anion | |||
Stosunek liczby kationów do liczby anionów | 1 : 2 | 1 : 3 | 2 : 1 |
Wzór sumaryczny związku chemicznego |
9. Substancje jonowe a substancje kowalencyjne
Związki chemiczne zbudowane z jonów różnią się od związków, które występują w postaci cząsteczek. Związki jonowe (zawierające wiązania jonowe) są tworzone w wyniku oddziaływań metali z niemetalami. Natomiast związki kowalencyjne (zawierające wiązania kowalencyjne) powstają z niemetali.
Nazwa związku chemicznego | Związki | |||||
jonowe | kowalencyjne | |||||
chlorek sodu | chlorek magnezu | dwutlenek węgla | woda | metan (składnik gazu ziemnego) | ||
Temperatura | topnienia [°C] | 802,0 | 714,0 | –56,6 (pod zwiększonym ciśnieniem) | 0,0 | –182,4 |
wrzenia [°C] | 1413,0 | 1367,0 | –78,5 (następuje sublimacja) | 100,0 | –161,5 | |
Stan skupienia w temperaturze pokojowej | substancja stała | substancja stała | gaz | ciecz | gaz | |
Związki jonowe w temperaturze pokojowej są substancjami stałymi o wysokich temperaturach topnienia i wrzenia. W tych samych warunkach niektóre związki kowalencyjne są gazami, inne – substancjami stałymi, a jeszcze inne – cieczami. Mają zwykle znacznie niższe temperatury wrzenia i topnienia niż związki jonowe. Większość związków jonowych, w przeciwieństwie do kowalencyjnych, bardzo dobrze rozpuszcza się w wodzie.
Diament jest wyjątkowym przykładem substancji kowalencyjnej. Jest zbudowany z atomów węgla połączonych wiązaniami kowalencyjnymi. Wiązania te tworzą sieć obejmującą cały kryształ. Diament nie rozpuszcza się w wodzie, ale poza tym nie ma właściwości charakterystycznych dla substancji kowalencyjnych. Jego temperatury wrzenia i topnienia są bardzo wysokie, podobnie jak związków jonowych.


Podsumowanie
Jony powstają z atomów, które oddały lub przyjęły co najmniej 1 elektron.
Jony obdarzone ładunkiem dodatnim to kationy; powstają z atomów po oddaniu co najmniej 1 elektronu.
Jony obdarzone ładunkiem ujemnym to aniony; powstają z atomów, które przyjęły co najmniej 1 elektron.
Kationy powstają głównie z atomów metali, aniony zaś – m.in. z atomów niektórych niemetali.
Związki jonowe są zbudowane z naprzemiennie ułożonych kationów i anionów, które tworzą uporządkowaną strukturę nazywaną kryształem jonowym.
W krysztale związku jonowego jony o przeciwnych znakach wzajemnie się przyciągają w efekcie działania sił elektrostatycznych.
Związki kowalencyjne zwykle składają się z cząsteczek.
Związki jonowe najczęściej mają wyższe temperatury wrzenia i topnienia w stosunku do związków kowalencyjnych; są także zazwyczaj lepiej rozpuszczalne w wodzie w porównaniu z substancjami zbudowanymi z cząsteczek.
Atom chloru może tworzyć 2 rodzaje wiązań chemicznych w zależności od rodzaju pierwiastka chemicznego, z którym się łączy. Wskaż po jednym przykładzie związku jonowego i kowalencyjnego, w którym występuje chlor (podaj wzory sumaryczne tych związków chemicznych).
Lekarze nie zalecają spożywania słonych potraw z uwagi na możliwość wystąpienia u ludzi wysokiego ciśnienia tętniczego. Sprawdź w dostępnych źródłach, który z jonów wchodzących w skład soli kuchennej odpowiada za ten niekorzystny wpływ soli na układ krwionośny człowieka. Dowiedz się także, czy człowiek może całkowicie zrezygnować ze spożywania tej substancji bez szkody dla organizmu. Zdobytą wiedzę przedstaw w zeszycie w formie notatki.
Słowniczek
jon o ładunku ujemnym
cząstka obdarzona ładunkiem elektrycznym, która powstała z atomu w wyniku przyjęcia lub oddania 1 lub więcej elektronów
jon o ładunku dodatnim
rodzaj wiązania chemicznego, które powstaje w wyniku elektrostatycznego przyciągania się jonów o przeciwnych znakach
Zadania
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Kation powstaje z atomu, który przyjął proton. | □ | □ |
| W anionie liczba elektronów jest większa od liczby protonów w jądrze atomowym. | □ | □ |
| Metale mają zdolność tworzenia kationów. | □ | □ |
| Jony utworzone przez różne pierwiastki chemiczne mogą mieć jednakową liczbę elektronów. | □ | □ |
| Jon obdarzony ładunkiem dodatnim to kation. | □ | □ |
| Związki jonowe są zbudowane z cząsteczek. | □ | □ |
| Jony utworzone przez atomy różnych pierwiastków chemicznych zawsze różnią się ładunkiem. | □ | □ |
Uzupełnij luki w tekście. Wybierz właściwe określenie spośród podanych.
przyciągają się, neutronów w jądrze atomowym, jonów tego samego znaku, elektronów, jonów przeciwnego znaku, elektronów, neutronów w jądrze atomowym, odpychają się, wyższe, niższe, protonów w jądrze atomowym, atomów, protonów w jądrze atomowym, elektronów, protonów
Jony powstają z ............................................................. Aniony mają więcej ............................................................ niż ............................................................. Związek jonowy zbudowany jest z ............................................................, które ............................................................ siłami elektrostatycznymi. Związki jonowe mają w porównaniu ze związkami kowalencyjnymi ............................................................ temperatury wrzenia i topnienia.
Wskaż pierwiastki chemiczne, których atomy mogą tworzyć kationy, i te, których atomy mogą tworzyć aniony. Uporządkuj nazwy pierwiastków chemicznych według tworzonych przez nie rodzajów jonów.
magnez, siarka, glin, sód, chlor
| kationy | |
|---|---|
| aniony |
Wskaż zapis przedstawiający konfigurację elektronową kationu magnezu: ?
- [2, 8]
- [2, 8, 2]
- [8, 2]
- [10, 2]
Wskaż, który zapis przedstawia konfigurację elektronową anionu chlorkowego: ?
- [2, 8, 8]
- [2, 8, 1]
- [2, 8, 7]
- [2, 8]
Uporządkuj nazwy jonów według wzrastającego ładunku, którym są obdarzone (od tego, który ma najniższy ładunek, do tego, który ma najwyższy ładunek).
- jon magnezu
- jon glinu
- jon chlorkowy
- jon siarczkowy
- jon sodu
Uporządkuj atomy i jony według liczby obecnych w nich elektronów.
<span aria-label="Na indeks górny, plus" role="math"><math><mrow><msup><mi>Na</mi><mrow><mo>+</mo></mrow></msup></mrow></math></span>, <span aria-label="Mg indeks górny, dwa, plus" role="math"><math><mrow><msup><mi>Mg</mi><mrow><mn>2</mn><mo>+</mo></mrow></msup></mrow></math></span>, <span aria-label="Ne" role="math"><math><mrow><mi>Ne</mi></mrow></math></span>, <span aria-label="Na" role="math"><math><mrow><mi>Na</mi></mrow></math></span>, <span aria-label="Al indeks górny, trzy, plus" role="math"><math><mrow><msup><mi>Al</mi><mrow><mn>3</mn><mo>+</mo></mrow></msup></mrow></math></span>, <span aria-label="Mg" role="math"><math><mrow><mi>Mg</mi></mrow></math></span>
| 10 | |
|---|---|
| 11 | |
| 12 |
Określ różnice i podobieństwa pomiędzy jednododatnim kationem sodu i atomem neonu. Przyporządkuj cechy do odpowiednich kategorii.
liczba zapełnionych powłok elektronowych, liczba protonów w jądrze, konfiguracja elektronowa, ładunek jądra, liczba elektronów, ładunek drobiny
| różnice (odmienne cechy) | |
|---|---|
| podobieństwa (cechy identyczne) |
Uporządkuj atomy i jony według liczby obecnych w nich elektronów.
<span aria-label="Ar" role="math"><math><mrow><mtext>Ar</mtext></mrow></math></span>, <span aria-label="S indeks górny, 2 minus" role="math"><math><mrow><msup><mtext>S</mtext><mrow><mtext>2</mtext><mtext>−</mtext></mrow></msup></mrow></math></span>, <span aria-label="Cl indeks górny, minus" role="math"><math><mrow><msup><mtext>Cl</mtext><mrow><mtext>−</mtext></mrow></msup></mrow></math></span>, <span aria-label="Cl" role="math"><math><mrow><mtext>Cl</mtext></mrow></math></span>, <span aria-label="S" role="math"><math><mrow><mtext>S</mtext></mrow></math></span>
| 16 | |
|---|---|
| 17 | |
| 18 |









