Wiązania chemiczne – kowalencyjne i kowalencyjne spolaryzowane
Atomy w stanie wolnym, niezwiązanym, bardzo rzadko występują w przyrodzie. Wyjątek pod tym względem stanowią atomy pierwiastków, zwanych zwyczajowo gazami szlachetnymi. Atomy większości pierwiastków są najczęściej związane z innymi atomami. W tym module dowiemy się, dlaczego atomy niektórych pierwiastków łączą się ze sobą oraz poznamy jeden ze sposobów tworzenia takiego połączenia.

że pierwiastki chemiczne mogą się ze sobą łączyć;
co to są związki chemiczne;
jak określić liczbę elektronów walencyjnych w atomach niektórych pierwiastków chemicznych.
opisywać wiązanie kowalencyjne (atomowe);
wyjaśniać, co to jest cząsteczka;
omawiać budowę przykładowych cząsteczek.
1. Co warto wiedzieć o gazach szlachetnych?
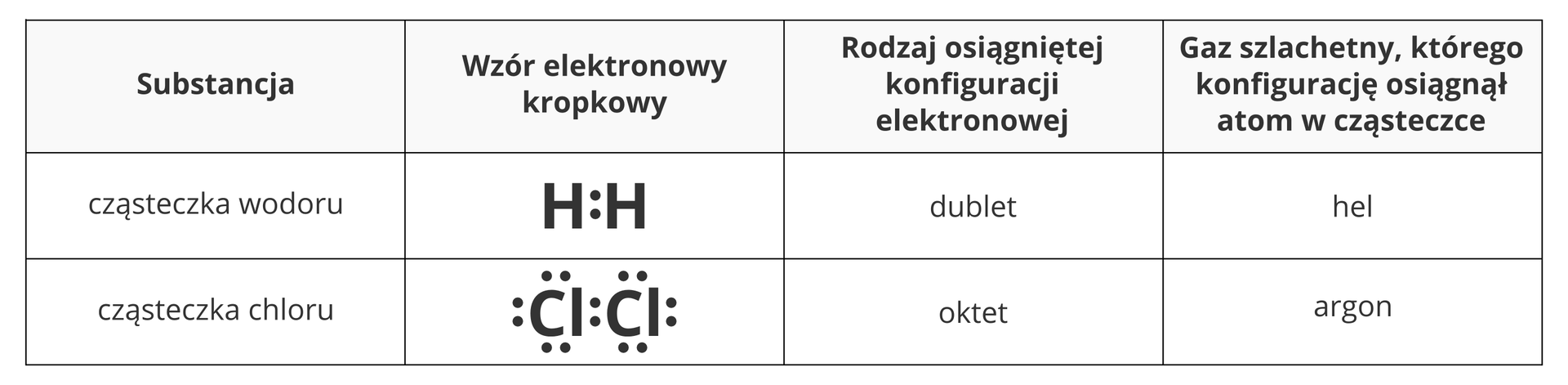
Porównując właściwości pierwiastków, można zauważyć, że niemetale znajdujące się w 18. grupie układu okresowego (helowce, zwane gazami szlachetnymi) wykazują najmniejszą aktywność. Helowce w zwykłych warunkach nie tworzą cząsteczek, a tylko niektóre z nich mogą tworzyć związki chemiczne, które są stosunkowo nietrwale. Okazuje się, że konfiguracja elektronowa atomów helowców jest trwała. Większość atomów pierwiastków, łącząc się ze sobą, dąży do uzyskania konfiguracji elektronowej najbliższego im w układzie okresowym helowca, na przykład atomy wodoru dążą do konfiguracji elektronowej helu, a atomy chloru – do konfiguracji elektronowej atomu argonu.
Jak pamiętasz, wśród helowców tylko atom helu ma 2 elektrony walencyjne (nazywane dubletem elektronowym), zaś atomy pozostałych gazów szlachetnych mają po 8 elektronów na ostatniej powłoce (tak zwany oktet elektronowy).
Nazwa helowca | Liczba elektronów na ostatniej powłoce | Nazwa konfiguracji elektronowej ostatniej powłoki |
hel | 2 | dublet elektronowy |
neon | 8 | oktet elektronowy |
argon | ||
krypton | ||
ksenon | ||
radon |
2. Czy atomy mogą dzielić się swoimi elektronami?
Atomy mogą łączyć się zarówno z atomami tego samego pierwiastka chemicznego, jak i atomami innych pierwiastków. Oddziaływanie pomiędzy atomami, które sprawiające, że atomy te łączą się ze sobą w sposób trwały, nazywa się wiązaniem chemicznym. W tworzeniu wiązania biorą udział elektrony walencyjne. Jak pamiętasz, liczba elektronów walencyjnych pierwiastka jest ściśle związana z jego położeniem w układzie okresowym i jego właściwościami fizykochemicznymi. To od niej zależy sposób oddziaływania i wiązania się ze sobą atomów.
Przy opisie wiązań chemicznych chemicy bardzo często posługują się symbolicznym zapisem. Wykorzystuje się w nim symbol pierwiastka chemicznego, i zaznacza się wokół niego kropkami liczbę elektronów walencyjnych. Są to tak zwane wzory elektronowe kropkowe. Jeśli w tym wzorze występują pary elektronów, to czasami zaznacza się je jako kreski. Taki sposób zapisu określa się mianem wzoru elektronowego kreskowego. W tabeli przedstawiono omawiane wzory elektronowe przykładowych atomów pierwiastków.

Wodór to pierwiastek chemiczny, którego atomy nie są wolne, lecz zawsze połączone w pary za pomocą wiązania chemicznego. Wiązanie to polega na tym, że atomy wodoru oddają do wspólnego użytku po 1 elektronie. Mówi się, że uwspólniają elektrony, które nazywa się wspólną parą elektronową lub wiążącą parą elektronową. Symbolicznie wiązanie tworzone przez 2 atomy wodoru można przedstawić jako . Dzięki uwspólnieniu elektronów każdy z atomów wodoru uzyskuje konfigurację elektronową (liczbę elektronów), jaką ma najbliższy w układzie okresowym gaz szlachetny – hel (2 elektrony).
Opisane wiązanie łączące 2 atomy wodoru za pomocą wspólnej pary elektronowej jest przykładem wiązania nazywanego wiązaniem kowalencyjnymwiązaniem kowalencyjnym lub wiązaniem atomowymwiązaniem atomowym. Wiązanie to polega na uwspólnianiu elektronów i tworzeniu tak zwanych wiążących par elektronów, które należą w jednakowym stopniu do obu atomów. Tego typu wiązania kowalencyjne tworzą się między atomami tego samego niemetalu.
Zobacz wzory elektronowe wiązań kowalencyjnych między atomami wodoru.

Film dostępny na portalu epodreczniki.pl
Animacja przedstawiająca wiązania kowalencyjne między atomami wodoru. Rozpoczyna ją ujęcie, w którym pary jasnoszarych kulek sklejonych ze sobą na podobieństwo baniek mydlanych przemieszczają się swobodnie po ekranie, odbijając się od siebie nawzajem. Następuje zbliżenie jednej takiej pary i gdy wypełnia już ona większość ekranu i ustawia się poziomo, na każdej z kulek pojawia się litera H, a na ich połączeniu dwie sąsiadujące w pionie kropki. Kulki znikają, pozostają tylko litery i kropki. Kropki zostają wyróżnione czerwonymi obrysami, a pod zapisem pojawia się tekst Wspólna para elektronowa. Następnie następuje rozdzielenie symboli wodoru, które rozsuwają się na boki - każdy z nich zabiera po jednej kropce - i ponowne połączenie. Na koniec filmu pod zapisem pojawia się miniatura układu okresowego, z którego odpowiedniej komórki wyłania się symbol helu, He z dwiema kropkami z prawej strony.
Film dostępny na portalu epodreczniki.pl
Film rozpoczyna ujęcie naczynia laboratoryjnego zawierającego opary żółtego gazu. Następuje najazd na wnętrze naczynia i ekran wypełnia animacja par zielonych kulek sklejonych ze sobą na podobieństwo baniek mydlanych przemieszczają się swobodnie po ekranie, odbijając się od siebie nawzajem. Następuje zbliżenie jednej takiej pary i gdy wypełnia już ona większość ekranu i ustawia się poziomo, na każdej z kulek pojawia się litera Cl, a na ich połączeniu dwie sąsiadujące w pionie kropki. Pary kropek występują też ze wszystkich pozostałych stron liter, tak że każdy znak Cl ma po lewej, prawej, górnej i dolnej stronie dwie pary kropek. Kulki znikają, pozostają tylko litery i kropki. Kropki na połączeniu atomów zostają wyróżnione czerwonymi obrysami, a pod zapisem pojawia się tekst Wspólna para elektronowa. Następnie następuje rozdzielenie symboli chloru, które rozsuwają się na boki - każdy z nich zabiera po jednej kropce i ma łącznie wokół siebie siedem kropek ponumerowanych zgodnie z ruchem wskazówek zegara - i ponowne połączenie. Po ponownym połączeniu zostaje wyróżnionych osiem kropek wokół najpierw lewego, a następnie prawego symbolu Chloru i pojawia się podpis: 8 elektronów (oktet). Na koniec filmu po lewej stronie kadru pojawia się fragmentu układu okresowego, w którym zieloną strzałką zaznaczone jest pole z argonem, którego nazwa, symbol i liczba atomowa zostają podświetlone na czerwono.
Zobacz efekt wiązania między atomami wodoru oraz między atomami chloru.
3. Co jest efektem łączenia się atomów?
Struktury, które powstają w wyniku połączenia się atomów za pomocą wiązań kowalencyjnych (wiązań atomowych), nazywa się cząsteczkami. Dwa atomy wodoru związane jedną parą elektronową noszą nazwę cząsteczki wodoru, a połączone ze sobą 2 atomy chloru stanowią cząsteczkę chloru.
W przyrodzie występuje bardzo dużo różnorodnych cząsteczek, które mogą zawierać od dwóch do ponad miliona atomów. Omawiane w tej lekcji cząsteczki wodoru i chloru są przykładami niewielkich układów atomów – cząsteczek dwuatomowych.
Każdą cząsteczkę można opisać wzorem. Jednym ze sposobów jest wymienienie symboli pierwiastków, których atomy wchodzą w jej skład, i zaznaczenie za symbolem pierwiastka (w prawym dolnym indeksie) liczby atomów wchodzących w skład cząsteczki. Przedstawiony zgodnie z tymi zasadami wzór cząsteczki jest nazywany wzorem sumarycznymwzorem sumarycznym cząsteczki.

Oprócz wiążących par elektronowych, w cząsteczkach mogą znajdować się także tzw. niewiążce pary elektronowe. Nie biorą one bezpośredniego udziału w tworzeniu wiązania chemicznego.

Film dostępny na portalu epodreczniki.pl
Film rozpoczyna plansza podpisana Cząsteczka chloru i przedstawiająca dwie połączone ze sobą zielone kulki. Na kulkach tych pojawiają się symbole Cl i kropki oznaczające elektrony walencyjne zestawione w pary. Zielone kule znikają, a pojawia się podpis Wzór elektronowy kropkowy. Kropki zostają zamienione kreskami, a podpis zmienia się na Wzór elektronowy kreskowy. Plansza znika i po chwili pojawia się napis Wzór sumaryczny, a pod nim dopisek Określa rodzaj i liczbę atomów wchodzących w skład cząsteczki. Ponownie pojawia się wzór kreskowy z podpisem cząsteczka chloru. Symbole Cl zostają wyróżnione czerwonym kolorem, a następnie ponumerowane. Na podstawie tego pod wzorem kreskowym pojawia się wzór sumaryczny Cl2.
Wodór czy chlor są pierwiastkami, które w stanie wolnym, jako gazy, występują w postaci cząsteczek dwuatomowych. Dlatego w symbolicznym opisie tych gazów zawsze posługujemy się wzorami: , .
4. Jak zbudowana jest cząsteczka azotu?
Atomy niemetali mogą uwspólniać więcej niż 1 parę elektronową.
Przykładem jest cząsteczka azotu zbudowana z 2 atomów azotu. Jak pamiętasz, atom azotu ma 5 elektronów walencyjnych, a do uzyskania 8 elektronów potrzebuje 3. Dlatego każdy z atomów w cząsteczce oddaje do wspólnego użytku 3 elektrony.

Między atomami azotu występują 3 wiążące pary elektronowe. Takie wiązanie określa się mianem wiązania potrójnegowiązania potrójnego. Wzór sumaryczny cząsteczki azotu to .

Wiązanie potrójne zawiera maksymalną liczbę wiązań, jaką mogą tworzyć atomy między sobą. W przyrodzie nie ma związków chemicznych, w których cząsteczkach występowałyby wiązania więcej niż trzykrotne.

5. Czym jest wiązanie kowalencyjne spolaryzowane?
Atomy różnych niemetali mogą (podobnie jak atomy należące do tego samego pierwiastka niemetalicznego) łączyć się ze sobą za pomocą wspólnych par elektronowych. Przykładem są atomy niemetali: wodoru i chloru, które łączą się ze sobą, tworząc cząsteczki chlorowodoru.

Każdy z atomów wchodzących w skład cząsteczki chlorowodoru oddaje po 1 elektronie walencyjnym w celu utworzenia wiążącej pary elektronowej (wiązania kowalencyjnego). Dzięki temu powstaje trwała konfiguracja elektronowa gazu szlachetnego: atom wodoru – helu, atom chloru – argonu.
W cząsteczce chlorowodoru atomy tworzą na ostatnich powłokach następujące konfiguracje: atom wodoru – dublet, atom chloru – oktet elektronowy.
Para elektronowa znajdująca się pomiędzy atomami wodoru i chloru w cząsteczce chlorowodoru nie należy w jednakowym stopniu do obu atomów, ale jest przesunięta w kierunku tego, który silniej przyciąga elektrony, w tym wypadku – w kierunku atomu chloru. Opisane wiązanie jest szczególnym rodzajem wiązania kowalencyjnego, nazywanym wiązaniem kowalencyjnym spolaryzowanym (wiązaniem atomowym spolaryzowanym)wiązaniem kowalencyjnym spolaryzowanym (wiązaniem atomowym spolaryzowanym).
Wiązanie kowalencyjne spolaryzowane jest tworzone pomiędzy atomami należącymi do różnych niemetali. Uwspólniają one elektrony, a utworzona wiążąca para lub pary elektronowe są przesunięte w kierunku tego atomu, który ma większą zdolność przyciągania elektronów. Najczęściej jest to atom o większej liczbie elektronów na ostatniej powłoce.
Film dostępny na portalu epodreczniki.pl
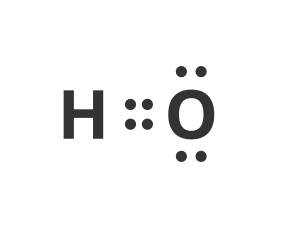
Film rozpoczyna ujęcie układu okresowego pierwiastków. Następuje najazd kamery na komórkę opisującą atom tlenu. Układ okresowy zastępuje widok symbolu tlenu otoczonego przez sześć kropek. Dwie z nich są swobodne, a cztery tworzą dwie pary niewiążące. Na moment pojawiają się dwie brakujące do oktetu kropki. Atom tlenu z ośmioma elektronami zamienia się w cząsteczkę wody również ukazaną w postaci wzoru kropkowego. Dwie pary elektronowe łączące atomy wodoru z tlenem zostają podświetlone na czerwono. Pojawia się podpis Cząsteczka wody, a obok wzoru kropkowego pojawia się rysunek modelu cząsteczki wody. Ponownie następuje zbliżenie na wzór kropkowy i dwie wiążące pary elektronowe otoczone zostają strzałkami skierowanymi w stronę symbolu atomu tlenu. Pojawia się podpis Wiązania kowalencyjne spolaryzowane. Znikają kropki symbolizujące elektrony, a litery symbolizujące atomy układają się we wzór sumaryczny H2O.
Wiązania kowalencyjne spolaryzowane łączą także atomy azotu z atomami wodoru w cząsteczki związku chemicznego zwanego amoniakiem. Na podstawie numeru grupy, do której należy atom azotu (15.), winioskujemy, że ma on na ostatniej powłoce 5 elektronów. Do uzyskania trwałej konfiguracji brakuje mu 3 elektronów. Uzyskuje je od 3 atomów wodoru, z którymi tworzy wiążące pary elektronowe.

Z uwagi na to, że atom azotu ma większą zdolność do przyciągania elektronów niż atom wodoru, 3 wiążące pary elektronowe są położone bliżej atomu azotu. Dlatego wiązanie to jest wiązaniem atomowym (kowalencyjnym) spolaryzowanym.
Wzór sumaryczny cząsteczki amoniaku to .

Każdy z atomów wchodzących w skład cząsteczki amoniaku uzupełnia ostatnią powłokę elektronową: atomy wodoru tworzą dublet elektronowy, atom azotu – oktet.

6. Jak zbudowana jest cząsteczka dwutlenku węgla?
Atomy różnych niemetali mogą uwspólniać więcej niż 1 parę elektronową. Przykładem związku chemicznego, w którego cząsteczkach tak się dzieje, jest dwutlenek węgla. Jego cząsteczki są zbudowane z 2 atomów tlenu połączonych z 1 atomem węgla.
Atom węgla znajduje się w 14. grupie układu okresowego i jego ostatnią powłokę elektronową tworzą 4 elektrony. W atomach tlenu natomiast jest 6 elektronów walencyjnych. Każdy z atomów w cząsteczce dwutlenku węgla uzupełnia swoją ostatnią powłokę do 8 elektronów: atomy tlenu oddają do wspólnego użytku z atomem węgla po 2 elektrony, atom węgla zaś z każdym z nich uwspólnia także 2 elektrony. Można policzyć, że na tworzenie wiązań atomy tlenu zużywają po 2 elektrony, natomiast atom węgla – w sumie 4.

Cząsteczka dwutlenku węgla ma następujący wzór sumaryczny: .
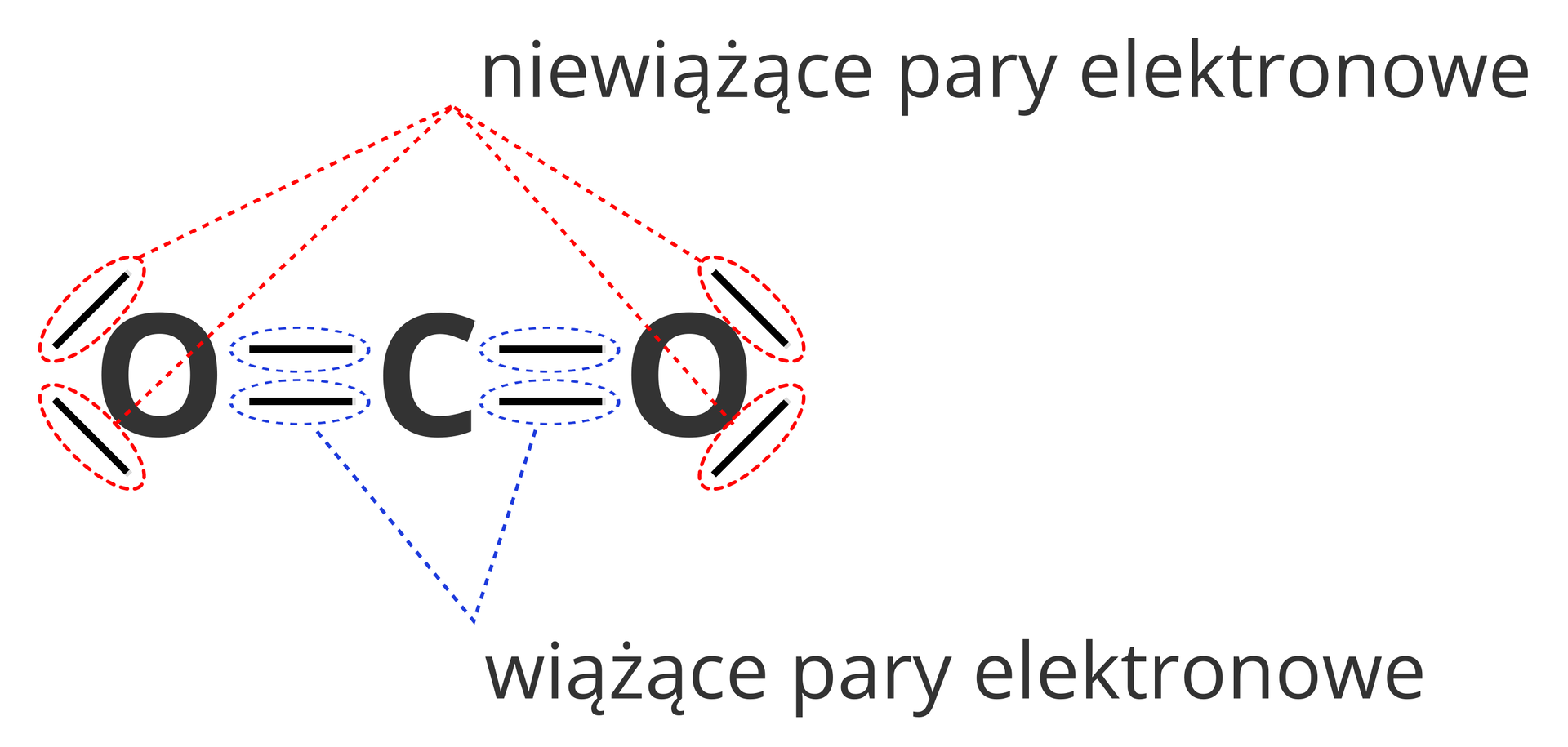
Atomy tlenu i węgla różnią się zdolnością do przyciągania elektronów, atom tlenu wykazuje silniejsze właściwości w tym względzie. Z tego powodu w cząsteczce dwutlenku węgla wiążące pary elektronowe są położone bliżej atomów tlenu.


Podsumowanie
Wiązanie chemiczne wiąże ze sobą atomy.
Wiązanie kowalencyjne (atomowe) polega na uwspólnieniu pary elektronowej pomiędzy atomami.
Każdy pierwiastek chemiczny, o ile to możliwe, dąży do uzyskania konfiguracji elektronowej najbliższego w układzie okresowym gazu szlachetnego.
Wiązania kowalencyjne tworzą atomy niemetali.
Atomy należące do różnych niemetali tworzą wiązania kowalencyjne spolaryzowane.
Struktury zbudowane z atomów połączonych wiązaniem kowalencyjnym (atomowym) są nazywane cząsteczkami.
Atomy w cząsteczkach: , , tworzą wiązania kowalencyjne (atomowe), a ich wiążące pary elektronowe należą w jednakowym stopniu do obu atomów w cząsteczce.
W cząsteczkach , , , występują wiązania kowalencyjne spolaryzowane, utworzone przez wspólne pary elektronowe, znajdujące się bliżej atomów o większej liczbie elektronów walencyjnych.
Fluor jest pierwiastkiem chemicznym, który w temperaturze pokojowej występuje w postaci cząsteczek dwuatomowych. Narysuj wzór elektronowy kropkowy i kreskowy oraz wzór sumaryczny jego cząsteczki. Wskaż wiążące i niewiążące pary elektronowe we wzorze kreskowym.
Słowniczek
rodzaj wiązania chemicznego, które polega na tworzeniu wspólnych par elektronowych pomiędzy atomami.
wiązanie chemiczne polegające na tworzeniu wspólnych par elektronowych pomiędzy atomami o różnej tendencji do przyciągania elektronów. Wiążąca para elektronowa jest przesunięta w kierunku atomu silniej przyciągającego elektrony.
wzór przedstawiający liczbę i rodzaj atomów wchodzących w skład najmniejszej struktury zbudowanej z atomów połączonych ze sobą za pomocą wiązań chemicznych, np. wzór cząsteczki
wiązanie utworzone przez jedną wspólną parę elektronową
wiązanie utworzone przez dwie wspólne pary elektronowe
wiązanie utworzone przez trzy wspólne pary elektronowe
Zadania
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Wiążąca para elektronowa między dwoma atomami tego samego pierwiastkaw należy w jednakowym stopniu do obu atomów. | □ | □ |
| Atomy azotu w cząsteczce azotu uwspólniają jedną parę elektronów. | □ | □ |
| W cząsteczce chlorowodoru występuje wiązanie atomowe spolaryzowane. | □ | □ |
| Wiązanie podwójne tworzą cztery elektrony. | □ | □ |
| W tworzeniu wiązania atomowego biorą udział wszystkie elektrony walencyjne każdego z połączonych ze sobą atomów. | □ | □ |
Uzupełnij luki w tekście. Wybierz właściwe określenia spośród podanych.
neutrony, dalej od, protony, atomowym, neutronów, elektrony, elektrony, atomy, protony, protony, elektronowym, protonów, elektrony, bliżej, elektronów, neutrony
Wiązanie chemiczne łączy ze sobą ......................... Wiązanie kowalencyjne nazywane jest także wiązaniem ........................ i tworzy się, gdy atomy oddają do wspólnego użytku ......................... Wspólna para ........................ w wiązaniu kowalencyjnym spolaryzowanym znajduje się ........................ atomu, który silniej przyciąga .........................
Przyporządkuj cząsteczki do właściwych kategorii w zależności od rodzaju występujących w nich wiązań chemicznych.
<span aria-label="CO indeks dolny, 2" role="math"><math><mrow><msub><mtext>CO</mtext><mtext>2</mtext></msub></mrow></math></span>, <span aria-label="H indeks dolny, 2" role="math"><math><mrow><msub><mtext>H</mtext><mtext>2</mtext></msub></mrow></math></span>, <span aria-label="HCl" role="math"><math><mrow><mi>HCl</mi></mrow></math></span>, <span aria-label="N indeks dolny, 2" role="math"><math><mrow><msub><mtext>N</mtext><mtext>2</mtext></msub></mrow></math></span>, <span aria-label="H indeks dolny, 2, O" role="math"><math><mrow><msub><mtext>H</mtext><mtext>2</mtext></msub><mtext>O</mtext></mrow></math></span>, <span aria-label="NH indeks dolny, 3" role="math"><math><mrow><msub><mtext>NH</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="Cl indeks dolny, 2" role="math"><math><mrow><msub><mtext>Cl</mtext><mtext>2</mtext></msub></mrow></math></span>
| wiązanie atomowe (kowalencyjne) | |
|---|---|
| wiązanie atomowe (kowalencyjne) spolaryzowane |
Uporządkuj nazwy drobin według rosnącej liczby wszystkich wiązań w cząsteczce.
- cząsteczka wodoru
- cząsteczka azotu
- cząsteczka dwutlenku węgla
Wskaż poprawnie zapisany wzór kreskowy cząsteczki amoniaku.
- 1
- 2
- 3
- 4
- 5
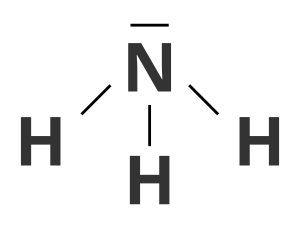
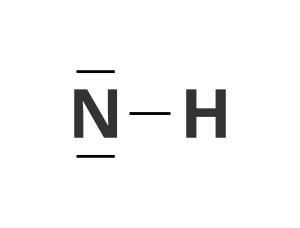

Wskaż poprawnie zapisany elektronowy wzór kropkowy cząsteczki wody.
- 1
- 2
- 3
- 4
- 5


Przyporządkuj podane wzory i symbole do odpowiednich kategorii.
<span aria-label="HCl" role="math"><math><mrow><mtext>HCl</mtext></mrow></math></span>, <span aria-label="H" role="math"><math><mrow><mtext>H</mtext></mrow></math></span>, <span aria-label="O indeks dolny, 2" role="math"><math><mrow><msub><mtext>O</mtext><mtext>2</mtext></msub></mrow></math></span>, <span aria-label="Cl indeks dolny, 2" role="math"><math><mrow><msub><mtext>Cl</mtext><mtext>2</mtext></msub></mrow></math></span>, <span aria-label="H indeks dolny, 2" role="math"><math><mrow><msub><mtext>H</mtext><mtext>2</mtext></msub></mrow></math></span>, <span aria-label="O" role="math"><math><mrow><mtext>O</mtext></mrow></math></span>, <span aria-label="CO indeks dolny, 2" role="math"><math><mrow><msub><mtext>CO</mtext><mtext>2</mtext></msub></mrow></math></span>, <span aria-label="H indeks dolny, 2, O" role="math"><math><mrow><msub><mtext>H</mtext><mtext>2</mtext></msub><mtext>O</mtext></mrow></math></span>, <span aria-label="N indeks dolny, 2" role="math"><math><mrow><msub><mtext>N</mtext><mtext>2</mtext></msub></mrow></math></span>, <span aria-label="C" role="math"><math><mrow><mtext>C</mtext></mrow></math></span>, <span aria-label="N" role="math"><math><mrow><mtext>N</mtext></mrow></math></span>, <span aria-label="Cl" role="math"><math><mrow><mtext>Cl</mtext></mrow></math></span>
| cząsteczki | |
|---|---|
| atomy |
Ustal nazwy gazów szlachetnych, których konfiguracje elektronowe uzyskały atomy pierwiastków chemicznych w cząsteczce chlorowodoru.
- wodór: hel, chlor: argon
- wodór: neon, chlor: krypton
- wodór: hel, chlor: hel
- wodór: hel, chlor: neon
Podaj nazwę gazu szlachetnego, którego konfigurację elektronową uzyskały atomy pierwiastków tworzących cząsteczkę dwutlenku węgla. Wskaż właściwą odpowiedź.
- węgiel: neon, tlen: neon
- węgiel: hel, tlen: argon
- węgiel: hel, tlen: hel
- węgiel: argon, tlen: argon
Podaj nazwę gazu szlachetnego, którego konfigurację elektronową uzyskały atomy pierwiastków w cząsteczce amoniaku.
- azot: neon, wodór: hel
- azot: hel, wodór: hel
- azot: argon, wodór: neon
- azot: neon, wodór: neon
Wskaż grupę pierwiastków, których atomy mogą tworzyć wiązania kowalencyjne.
- wodór, tlen, azot
- sód, chlor, wodór
- chlor, tlen, wapń
- węgiel, glin, azot
W cząsteczce bromowodoru () występuje wiązanie kowalencyjne spolaryzowane. Okazuje się, że jedyna istniejąca wiążąca para elektronowa w cząsteczce znajduje się bliżej atomu bromu. Wybierz właściwy wniosek, który można wysnuć na podstawie podanych informacji.
- Atom bromu ma większą zdolność do przyciągania elektronów niż atom wodoru.
- Atom wodoru ma większą zdolność do przyciągania elektronów niż brom.
- Atom wodoru nie uwspólnił elektronu z atomem bromu.
- Atom bromu oddał dwa elektrony do wspólnego użytkowania z atomem wodoru.