Wirtualne laboratorium WL‑I
Wyznaczanie ciepła właściwego metali z wykorzystaniem bilansu cieplnego
Przeprowadź dwuczęściowy eksperyment w wirtualnym laboratorium. Wykonaj ćwiczenia i polecenia związane z wyposażeniem pracowni, przeprowadzeniem pomiarów i opracowaniem ich wyników. Aby obliczyć niepewność pomiarową wyniku końcowego, przypomnij sobie e‑materiał „Niepewność wielkości mierzonej pośrednio”.
Opis Wirtualnego Laboratorium
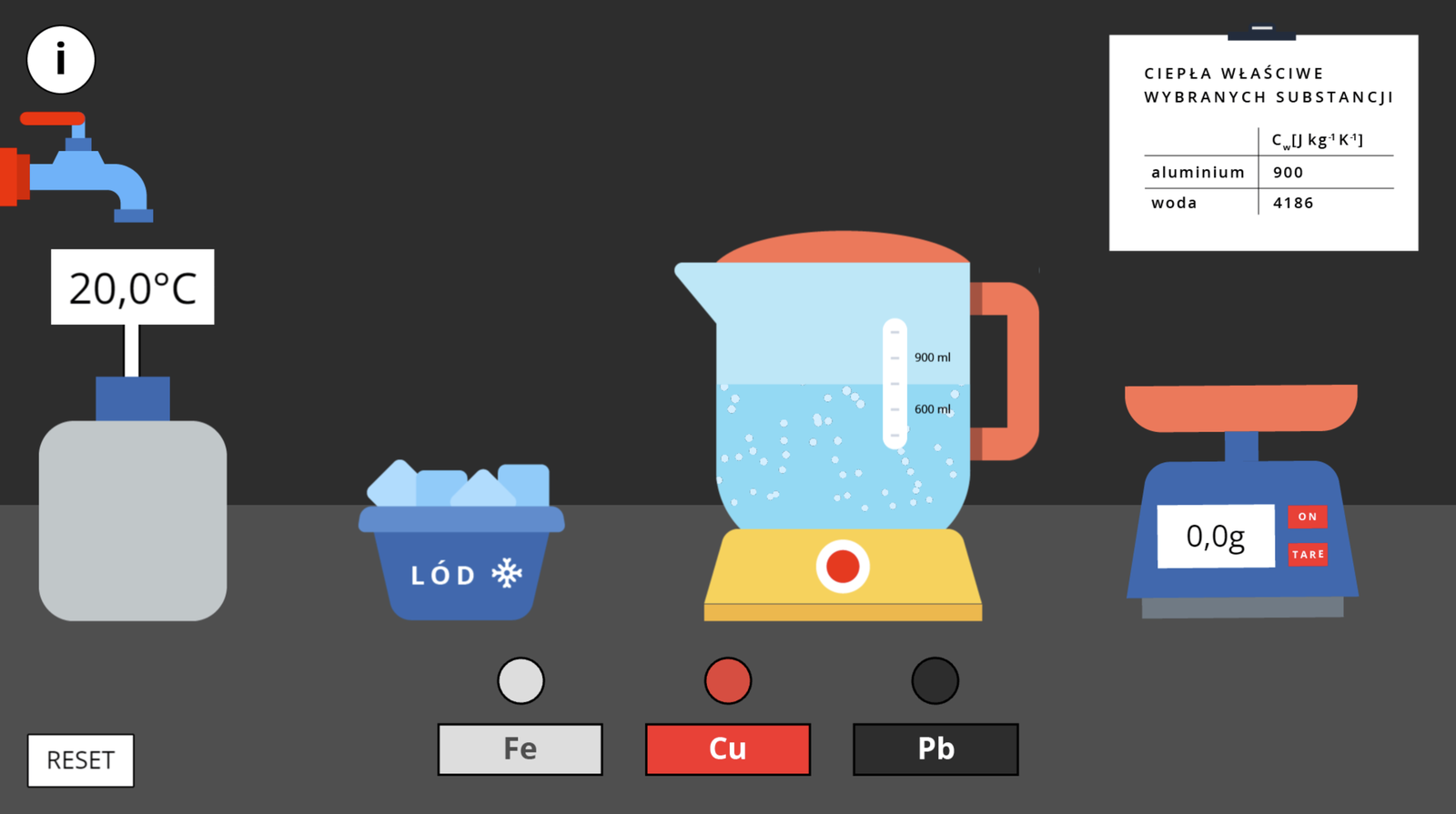
Na ekranie wirtualnego laboratorium na szarym blacie widać cztery rozmieszczone w rzędzie elementy jego wyposażenia. Od lewej są to: kalorymetr, miseczka z lodem, czajnik z wrzącą wodą i waga. Przed nimi znajdują się, także w rzędzie, trzy metalowe kulki wykonane, wyliczając od lewej, z żelaza (Fe), miedzi (CU) i ołowiu (PB). Początkowa temperatura kulek jest taka, jaka panuje w laboratorium, czyli 20,0 Indeks górny ooC. Każdą kulkę można przenosić myszką po to, by ją zważyć, ogrzać w gorącej wodzie, ochłodzić lodem lub wrzucić do kalorymetru. Dopóki kulka znajduje się poza kalorymetrem, w naszym wirtualnym laboratorium można zmierzyć jej temperaturę z rozdzielczością do jednego miejsca po przecinku – wystarczy najechać na nią myszką.
Kalorymetr ma kształt dużego sześciennego naczynia z zaokrąglonymi wierzchołkami, jest koloru szarego, a wykonano go z aluminium. U góry kalorymetru znajduje się niebieskie zamkniecie, w którym umieszczono termometr, wskazujący temperaturę we wnętrzu naczynia z rozdzielczością do jednego miejsca po przecinku. Kalorymetr można napełnić wodą z kranu umieszonego bezpośrednio nad jego zamknięciem. Woda w kranie ma temperaturę 20,0 Indeks górny ooC, o czym można się przekonać wypełniając nią kalorymetr i obserwując wskazania termometru.
Miseczka jest koloru niebieskiego i zawiera widoczne kostki lodu, którymi można ochłodzić kulkę, wkładając ją do miseczki.
Czajnik, to przezroczyste naczynie, stale włączone i zawierające gotującą się wodę. Jego podstawa jest koloru żółtego i posiada pośrodku czerwony włącznik. Czajnik wyposażony jest w pomarańczową pokrywkę i rączkę tego samego koloru.
Waga, to niebieskie urządzenie z szarą podstawą na dole i jedną pomarańczową szalką u góry. Na szalce można umieścić każdą z kulek lub kalorymetr, by wyznaczyć ich masę. Obudowa wagi wyposażona jest w duży cyfrowy wyświetlacz pokazujący masę ważonego przedmiotu w gramach, z rozdzielczością do jednego miejsca po przecinku. Po jego prawej stronie znajdują się dwa prostokątne czerwone przyciski: jeden, z napisem „ON”, a pod nim drugi, z napisem „TARE”.
Na ścianie wirtualnego laboratorium, po prawej stronie ekranu widać planszę z wartościami ciepeł właściwych niektórych substancji, o treści, jak poniżej:
CIndeks dolny ww [J∙kgIndeks górny -1-1∙KIndeks górny -1-1] | |
|---|---|
aluminium | 900 |
woda | 4186 |
Uwaga!
W naszym wirtualnym laboratorium panują warunki niedostępne nigdzie indziej. Układ kalorymetru, kulki i wody jest układem zamkniętym.
W rzeczywistości układ ten oddaje ciepło do otoczenia przez przewodnictwo cieplne, promieniowanie oraz konwekcję. W wyniku tych procesów temperatura wymienionych obiektów będzie dążyć do temperatury otoczenia.
Termometr znajdujący się w kalorymetrze jest tak lekki i ma tak małe ciepło właściwe, że możemy nie brać go pod uwagę w bilansie cieplnym.
Wykonując bilans cieplny będziemy używać następujących oznaczeń:
TIndeks dolny 11 – temperatura początkowa rozgrzanej kulki
TIndeks dolny 22 – temperatura początkowa wody i kalorymetru
TIndeks dolny kk – temperatura końcowa kulki, wody i kalorymetru po dojściu do równowagi
mIndeks dolny AlAl – masa kalorymetru (jest wykonany z aluminium)
mIndeks dolny ww – masa wody
mIndeks dolny kk – masa kulki
cIndeks dolny AlAl – ciepło właściwe aluminium
cIndeks dolny ww – ciepło właściwe wody
cIndeks dolny kk – szukane ciepło właściwe kulki
Równanie bilansu cieplnego opisujące naszą sytuację jest następujące:
Stąd można obliczyć ciepło właściwe kulki:
Pomiar ciepła właściwego metalu
Zasadniczym celem eksperymentu jest wyznaczenie ciepła właściwego wybranego metalu.
Celem dalej idącym jest zbadanie, która z wielkości mierzonych pośrednio wnosi największy wkład do niepewności pomiarowej wyniku.
Pomiar temperatury wnosi większy wkład do niepewności pomiarowej wyniku niż pomiar masy.
Zapoznaj się z wyposażeniem wirtualnego laboratorium. Zwróć przy tym uwagę na rozdzielczość wagi oraz na rozdzielczość termometrów. Bez wątpienia wpływają one na niepewność pomiaru wyniku.
Czy porównanie tych rozdzielczości pozwala rozstrzygnąć hipotezę badawczą? Czy można było lepiej dobrać wyposażenie laboratorium pod kątem rozdzielczości przyrządów?
Przyrządy zostały więc pod tym kątem dobrane prawidłowo., 2. Zarówno waga jak i termometry mają rozdzielczość do jednej cyfry po przecinku, więc przyczynki do niepewności pochodzące od pomiaru mas i temperatur muszą być jednakowe albo przynajmniej bardzo do siebie zbliżone.
Przyrządy zostały więc pod tym kątem dobrane prawidłowo., 3. Względna dokładność pomiaru masy jest w tym eksperymencie rzędu 0,1%, zaś temperatury jest rzędu 0,03%. Z tego wynika, że pomiary masy mają nieco większy udział w niepewności wyniku niż pomiary temperatury.
Ta niewielka różnica nie uzasadnia stwierdzenia, że należało wybrać wagę o rozdzielczości o rząd wielkości lepszej., 4. Względna dokładność pomiaru masy jest w tym eksperymencie rzędu 0,1%, zaś temperatury jest rzędu 0,03%. Z tego jednak nie wynika, które pomiary – mas czy temperatur – mają większy udział w niepewności wyniku.
Ta różnica nie uzasadnia więc stwierdzenia, że należało wybrać wagę o rozdzielczości o rząd wielkości lepszej.
1. Zapoznaj się z instrukcją wykonania doświadczenia. Przeprowadź kilka próbnych pomiarów. Zaplanuj kolejność postępowania.
Pomiar ciepła właściwego metalowej kulki jest pomiarem pośrednim. Bezpośrednio mierzysz aż sześć wielkości. Dla każdej z nich (oznaczmy ją przykładowo jako ) określisz, na podstawie pojedynczego pomiaru i rozdzielczości użytego przyrządu, jej niepewność standardową a następnie jej udział w niepewności ciepła właściwego kulki .
Korzystasz także z dwóch danych tablicowych, które nie zawierają informacji o niepewności. Przyjmij więc, że niepewności standardowe ciepeł właściwych aluminium oraz wody są rzędu , czyli że dotyczą ostatniej podanej cyfry znaczącej.
2. Rozpoznaj możliwości związane z ważeniem, w tym z tarowaniem wagi. Naucz się dozowania wody do kalorymetru – czy potrafisz kilkakrotnie nalać porcję wody o masie 100 g, z dokładnością do 5 g?
3. Zwróć też uwagę na możliwość ustalania początkowej temperatury kulki. Nie musi ona koniecznie wynosić 100°C (długie przebywanie we wrzątku) albo 0°C (długie przebywanie w wodnej kąpieli lodu) – naucz się uzyskiwać, z dokładnością do 1°C, dowolną temperaturę początkową kulki z tego przedziału.
4. Przeprowadź właściwy pomiar z dowolnie wybranym metalem. Rozgrzej kulkę lub ozięb ją do dowolnie wybranej temperatury . Do kalorymetru wlej dowolną ilość wody .
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DreQnJwhS
5. Zanotuj wyniki w przygotowanej tabeli. Oblicz i wpisz do tabeli wartość ciepła właściwego metalowej kulki.
1. Uzupełnij tabelę o niepewności standardowe sześciu wielkości mierzonych bezpośrednio oraz dla wielkości tablicowych. Traktuj je - dla potrzeb określania niepewności pomiarowej wyniku - jak wielkości mierzone bezpośrednio.
2. Oblicz i wpisz do tabeli udziały każdej z ośmiu wielkości w niepewności końcowego wyniku. Rozważ odpowiednie przygotowanie i zaprogramowanie arkusza kalkulacyjnego; możesz skorzystać ze struktury zawartej w tabeli.
3. Porównaj te udziały. Czy są one tego samego rzędu? Czy udział którejś z wielkości mierzonych bezpośrednio w niepewności końcowego wyniku jest dominujący? Czy podane dane tablicowe można uznać za dokładne i pominąć w obliczeniach ich niepewności?
Czy porównanie obliczonych udziałów niepewności pozwala rozstrzygnąć hipotezę badawczą? Czy w związku z tym porównaniem należało inaczej dobrać wyposażenie laboratorium pod kątem rozdzielczości przyrządów?
Zapisz swój pogląd na przedstawione tu problemy w sekcji „Komentarze, spostrzeżenia, wnioski” pod tabelą pomiarów a następnie porównaj z analizą przedstawioną w Wyjaśnieniu.
4. Zapisz zaokrąglony wynik wraz z niepewnością pomiarową.
5. Porównaj uzyskany wynik z wartością tablicową i skomentuj efekt tego porównania.
Pomiar ciepła właściwego metalu
Zasadniczym celem eksperymentu jest wyznaczenie ciepła właściwego wybranego metalu, na przykład miedzi.
Celem dalej idącym jest zbadanie, która z wielkości mierzonych pośrednio wnosi największy wkład do niepewności pomiarowej wyniku.
Pomiar temperatury wnosi większy wkład do niepewności pomiarowej wyniku niż pomiar masy.
Zapoznaj się z wyposażeniem wirtualnego laboratorium. Zwróć przy tym uwagę na rozdzielczość wagi oraz termometrów. Bez wątpienia wpływają one na niepewność pomiaru wyniku.
Czy porównanie tych rozdzielczości pozwala rozstrzygnąć hipotezę badawczą? Czy można było lepiej dobrać wyposażenie laboratorium pod kątem rozdzielczości przyrządów?
Przyrządy zostały więc pod tym kątem dobrane prawidłowo., 2. Zarówno waga jak i termometry mają rozdzielczość do jednej cyfry po przecinku, więc przyczynki do niepewności pochodzące od pomiaru mas i temperatur muszą być jednakowe albo przynajmniej bardzo do siebie zbliżone.
Przyrządy zostały więc pod tym kątem dobrane prawidłowo., 3. Względna dokładność pomiaru masy jest w tym eksperymencie rzędu 0,1%, zaś temperatury jest rzędu 0,03%. Z tego wynika, że pomiary masy mają nieco większy udział w niepewności wyniku niż pomiary temperatury.
Ta niewielka różnica nie uzasadnia stwierdzenia, że należało wybrać wagę o rozdzielczości o rząd wielkości lepszej., 4. Względna dokładność pomiaru masy jest w tym eksperymencie rzędu 0,1%, zaś temperatury jest rzędu 0,03%. Z tego jednak nie wynika, które pomiary – mas czy temperatur – mają większy udział w niepewności wyniku.
Ta różnica nie uzasadnia więc stwierdzenia, że należało wybrać wagę o rozdzielczości o rząd wielkości lepszej.
W wirtualnym laboratorium przeprowadzono doświadczenie w celu wyznaczenia ciepła właściwego miedzi. Postępowano następująco:
Korzystając z wagi, zmierzono masę pustego kalorymetru oraz masę kulki. Następnie wlano do kalorymetru wodę, podstawiając go pod kran. Aby zważyć wodę, postawiono kalorymetr z wodą na wadze, odczytano jej wskazanie i korzystając niego, obliczono masę samej wody. Wyniki umieszczono w tabeli pomiarów poniżej.
Odczytano temperaturę początkową wody i kalorymetru z termometru.
Umieszczono miedzianą kulkę w czajniku z gotującą się wodą. Poczekano aż jej temperatura przekroczy 60°C. Ponieważ temperatura ta rosła bardzo szybko, schłodzono nieco kulkę przy pomocy lodu, a następnie poczekano, aż jej temperatura spadnie wolno w otaczającym powietrzu do żądanej wartości. Otrzymaną ostatecznie wartość temperatury zanotowano w tabeli.
Wrzucono kulkę do kalorymetru i obserwowano wskazanie termometru. Kiedy przestało się ono zmieniać, zanotowano je. Jest to wartość temperatury końcowej. Umieszczono ją w tabeli.
W ten sposób otrzymano wszystkie potrzebne dane do skorzystania z bilansu cieplnego i obliczenia ciepła właściwego miedzianej kulki, korzystając z odpowiedniego wzoru.
Pomiar ciepła właściwego metalowej kulki jest pomiarem pośrednim. Bezpośrednio mierzysz aż sześć wielkości. Dla każdej z nich (oznaczmy ją przykładowo jako ) określisz, na podstawie pojedynczego pomiaru i rozdzielczości użytego przyrządu, jej niepewność standardową a następnie jej udział w niepewności ciepła właściwego kulki .
Skorzystasz także z dwóch danych tablicowych, które nie zawierają informacji o niepewności. Przyjmij więc, że niepewności standardowe ciepeł właściwych aluminium oraz wody są rzędu , czyli że dotyczą ostatniej podanej cyfry znaczącej.
Uzupełnij tabelę o niepewności standardowe sześciu wielkości mierzonych bezpośrednio oraz dla wielkości tablicowych. Traktuj je - dla potrzeb określania niepewności pomiarowej wyniku - jak wielkości mierzone bezpośrednio.
Oblicz i wpisz do tabeli udziały każdej z ośmiu wielkości w niepewności końcowego wyniku. Rozważ odpowiednie przygotowanie i zaprogramowanie arkusza kalkulacyjnego; możesz skorzystać ze struktury zawartej w tabeli.
Porównaj te udziały. Czy są one tego samego rzędu? Czy udział którejś z wielkości mierzonych bezpośrednio w niepewności końcowego wyniku jest dominujący? Czy podane dane tablicowe można uznać za dokładne i pominąć w obliczeniach ich niepewności?
Czy porównanie obliczonych udziałów niepewności pozwala rozstrzygnąć hipotezę badawczą? Czy w związku z tym porównaniem należało inaczej dobrać wyposażenie laboratorium pod kątem rozdzielczości przyrządów?
Zapisz swój pogląd na przedstawione tu problemy w formularzu.
Zapisz zaokrąglony wynik wraz z niepewnością pomiarową.
Porównaj uzyskany wynik z wartością tablicową i skomentuj efekt tego porównania.
Minimalizacja niepewności pomiaru ciepła właściwego metalu
W pierwszej części eksperymentu zostało wykazane, że dominujący o rząd wielkości wkład do niepewności pomiarowej wyniku pochodzi od pomiaru temperatur.
Celem drugiej części eksperymentu jest zbadanie, czy niepewność pomiaru ciepła właściwego metalu zależy od początkowej temperatury metalu umieszczanego w kalorymetrze z wodą.
Niepewność pomiaru ciepła właściwego jest tym mniejsza im większa jest początkowa różnica temperatur pomiędzy metalem a kalorymetrem z wodą.
Wykorzystasz wyposażenie wirtualnego laboratorium jak w pierwszej części eksperymentu.
Wykonaj serię kilku pomiarów ciepła właściwego metalu badanego w części 1. Zastosuj tę samą procedurę pomiarową.
- Do kalorymetru wlewaj zawsze taką samą ilość wody , z dokładnością do 5 g. Dobrym pomysłem jest wlewanie takiej ilości wody, jak w doświadczeniu 1.
- Wykorzystaj pełną rozpiętość dostępnych wartości początkowej temperatury . Dobrym pomysłem jest ustawienie dwóch‑trzech temperatur poniżej 20°C oraz czterech‑pięciu temperatur powyżej 20°C.
- Wyniki zapisuj w tabeli; wykorzystaj możliwość powielania jej zasadniczej struktury (przycisk „Dodaj”).

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DreQnJwhS
Opracuj wyniki każdego pomiaru, jak w doświadczeniu 1. Oblicz udziały każdej z wielkości w niepewności wyniku końcowego. Oblicz niepewność każdego z uzyskanych wyników.
W sekcji „Komentarze, spostrzeżenia, wnioski” zapisz swoje rozstrzygnięcia następujących zagadnień.
Rozważ sporządzenie wykresu (wykresów) zależności wybranych wielkości od temperatury dla poparcia tych rozstrzygnięć.
1. Czy wynik któregoś z pomiarów odstaje od pozostałych w stopniu nie dającym się wytłumaczyć niepewnością pomiarową?
2. Czy we wszystkich pomiarach potwierdza się dominujący udział pomiaru temperatur w niepewności wyniku, przede wszystkim zaś oraz ?
3. Czy uzyskane wyniki potwierdzają postawioną hipotezę?
4. Czy celowe jest - z punktu widzenia dążenia do minimalizacji niepewności wyniku pomiaru - wyposażenie laboratorium zarówno w czajnik z wrzącą wodą jak i kąpiel wody z lodem?
Minimalizacja niepewności pomiaru ciepła właściwego metalu
W pierwszej części eksperymentu zostało wykazane, że dominujący o rząd wielkości wkład do niepewności pomiarowej wyniku pochodzi od pomiaru temperatur.
Celem drugiej części eksperymentu jest zbadanie, czy niepewność pomiaru ciepła właściwego metalu zależy od początkowej temperatury metalu umieszczanego w kalorymetrze z wodą.
Niepewność pomiaru ciepła właściwego jest tym mniejsza im większa jest początkowa różnica temperatur pomiędzy metalem a kalorymetrem z wodą.
Wykorzystasz wyposażenie wirtualnego laboratorium jak w pierwszej części eksperymentu.
Wykonano serię kilku pomiarów ciepła właściwego tego samego metalu, który badano w pierwszym doświadczeniu. Zastosowano tę samą procedurę pomiarową, ale aby ułatwić sobie wyznaczenie masy wody, postawiono na wadze najpierw pusty kalorymetr, potem wciśnięto przycisk tarowania, a następnie postawiono na wadze kalorymetr z wodą. Wyświetlacz pokazał wprost masę wody. Spełniono wymienione niżej postulaty.
Do kalorymetru warto wlewać zawsze podobną ilość wody .
Należy wykorzystać pełną rozpiętość dostępnych wartości początkowej temperatury , zarówno powyżej, jak i poniżej temperatury 20°C.
Wyniki zapisano w tabelach poniżej.
Opracuj wyniki każdego pomiaru, jak w doświadczeniu 1. Oblicz udziały każdej z wielkości w niepewności wyniku końcowego. Oblicz niepewność każdego z uzyskanych wyników.
W formularzu zapisz swoje rozstrzygnięcia wymienionych niżej zagadnień. W analizie uwzględnij także wyniki uzyskane w pierwszym doświadczeniu.
Czy wynik któregoś z pomiarów odstaje od pozostałych w stopniu nie dającym się wytłumaczyć niepewnością pomiarową?
Czy we wszystkich pomiarach potwierdza się dominujący udział pomiaru temperatur w niepewności wyniku, przede wszystkim zaś oraz ?
Czy uzyskane wyniki potwierdzają postawioną hipotezę?
Czy celowe jest – z punktu widzenia dążenia do minimalizacji niepewności wyniku pomiaru – wyposażenie laboratorium zarówno w czajnik z wrzącą wodą jak i kąpiel wody z lodem?