Wykorzystanie badań DNA w medycynie
Dlaczego warto znać swoich krewnych oraz historię zachorowań przodków? Ponieważ predyspozycje do określonych chorób kryją się w genach i można je ustalić przed przyjściem dziecka na świat.
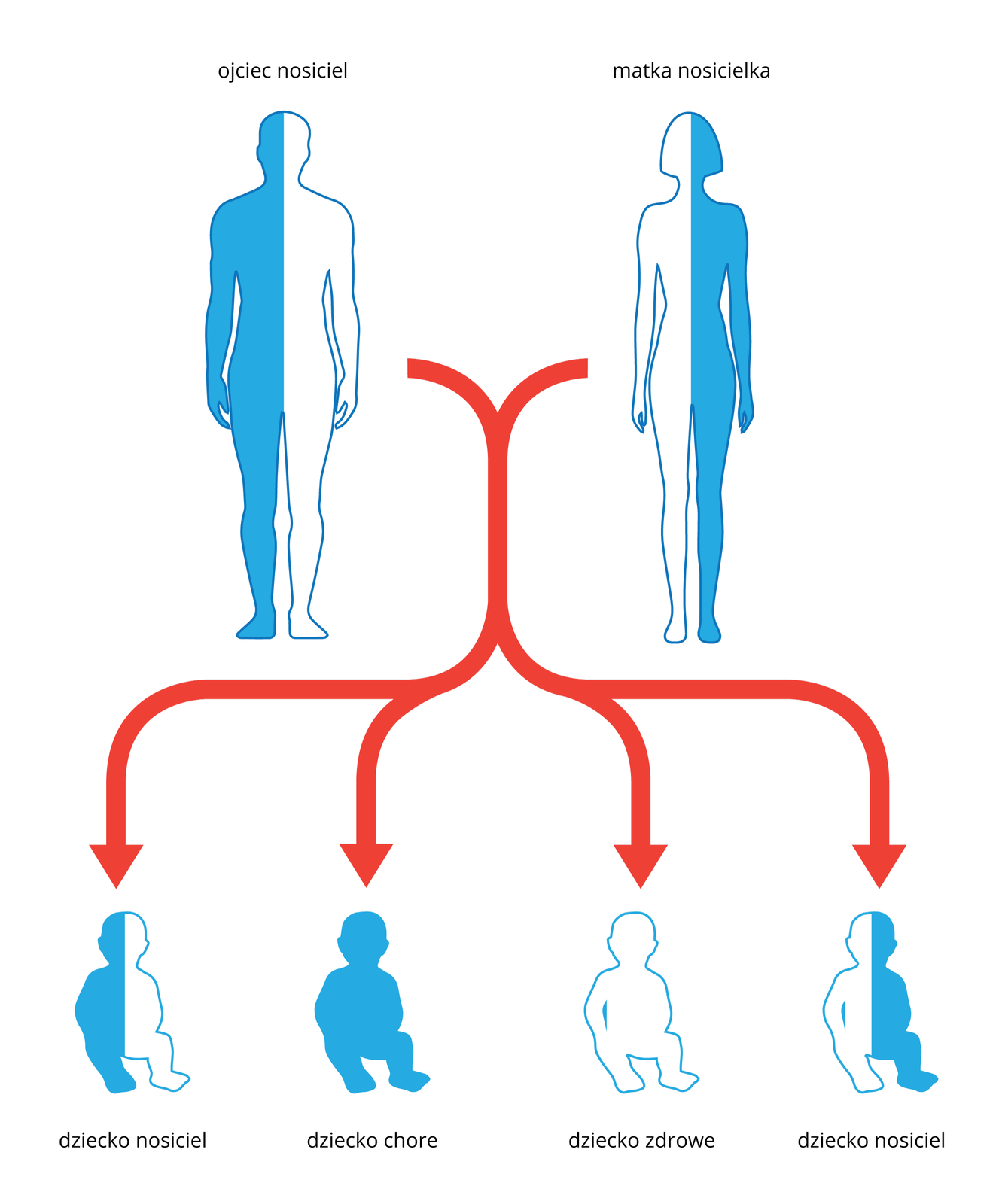
niektóre choroby genetyczne dziedziczone są zgodnie z prawami Mendla;
zmiany sekwencji genetycznych niosą ze sobą zmiany w funkcjonowaniu genów, a w konsekwencji – organizmu;
znamy już 99% sekwencji nukleotydów ludzkiego genomu.
wymieniać przykłady chorób genetycznych;
wyjaśniać związek między mutacją w genie a występowaniem choroby.
1. Genetyczne predyspozycje do rozwoju nowotworu
Choroby genetyczne mogą być dziedziczone zgodnie z zasadmi odkrytymi przez Grzegorza Mendla, dlatego wiedząc, że rodzice lub jedno z nich jest chore lub ma w rodzinie chorą osobę, można oszacować prawdopodobieństwo przekazania wadliwej cechy potomstwu. Dotychczas najlepiej poznano geny przyczyniające się do powstawania niektórych nowotworów.
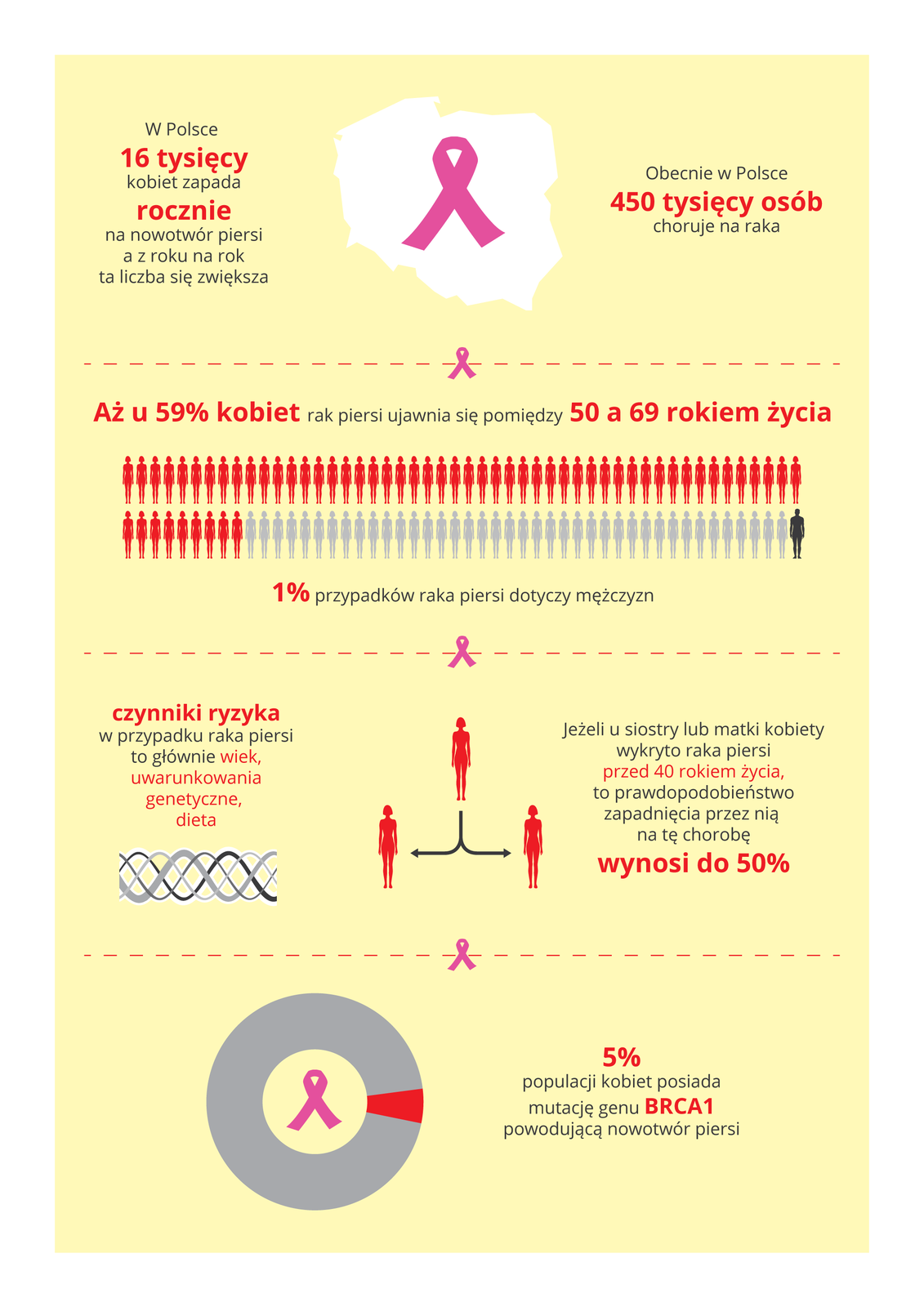
Osoby, u których w rodzinie były przypadki raka, mogą przeprowadzić bezpłatne badania w poradniach genetycznych i dowiedzieć się, jakie jest w ich przypadku prawdopodobieństwo rozwoju nowotworu.Sam fakt posiadania zmutowanych genów nie oznacza, że ich właściciel na pewno zapadnie na daną chorobę. Wiedza o zagrożeniu pozwola jednak zmniejszyć ryzyko zachorowania.
Jednym z genów, który ulega częstym mutacjom, jest BRCA, gen kodujący białko BRCA blokujące powielanie uszkodzonego DNA i tym samym umożliwiające jego naprawę. Brak tego białka prowadzi do gromadzenia się mutacji w materiale genetycznym.

Przeanalizuj ilustrację i wymień czynniki ryzyka chorób nowotworowych.

2. Mukowiscydoza
Mukowiscydoza (CF) to najczęstsza choroba genetyczna wśród rdzennych Europejczyków. Nosicielem zmutowanego genu jest co 25 Polak, a choruje 1 na 2,5 tysiąca noworodków. Choroba pojawia się, gdy dziecko otrzyma od obojga rodziców zmutowany gen CFTR, zlokalizowany na chromosomie 7. Opisano aż 600 różnych mutacji w tym genie, dlatego mukowiscydoza może mieć przebieg ciężki lub łagodny.

Gen CFTR koduje białko odpowiedzialne za przepływ jonów NaIndeks górny ++przez błony komórkowe. Najczęstsza mutacja tego genu polega na delecji 3 nukleotydów. Ekspresja tak zmutowanego genu prowadzi do syntezy wadliwego białka, które jest uznawane przez komórkę za niekompletne i z niej eliminowane. Bez tego białka nadmiar jonów sodu usuwany jest na zewnątrz organizmu wraz z potem, który u osób chorych jest bardzo słony. W płucach jony sodu zatrzymywane są w komórkach. W efekcie dochodzi do ich silnego uwodnienia oraz powstania obfitej i gęstej wydzieliny zatykającej oskrzela, co prowadzi do niewydolności oddechowej. W układzie pokarmowym upośledzeniu ulegają funkcje trzustki i wątroby. Choroba na ogół ma ciężki przebieg. Zanim poznano jej przyczyny, dzieci z mukowiscydozą umierały w 1 roku życia z powodu niewydolności układu oddechowego i niedożywienia (ponieważ chorobie tej towarzyszy niedrożność przewodów żółciowych i kanalików trzustkowych). Obecnie chorzy osiągają dorosłość, choć żyją krócej niż wynosi średnia wieku dla populacji.

Jedna z hipotez zakłada, że Fryderyk Chopin chorował na łagodną postać mukowiscydozy. Potwierdza to m.in. wczesna śmierć jego siostry (która cierpiała na nawracający kaszel i duszności) oraz kłopoty zdrowotne Fryderyka: częste infekcje dróg oddechowych, nietolerancja pokarmów bogatych w tłuszcze, niezdolność do dużego wysiłku fizycznego. Większość badaczy skłania się jednak ku tezie, że słynny kompozytor był chory na gruźlicę.
Para rodziców, nosicieli mukowiscydozy, ma 6 zdrowych dzieci niebędących nosicielami. Wyjaśnij, jak to możliwe, że żadne z dzieci nie odziedziczyło wadliwego genu.
3. Produkcja leków nowej generacji
Inżynieria genetyczna znajduje zastosowanie w produkcji leków. Dzięki niej, oprócz insuliny, można otrzymać ludzki hormon wzrostu, czynnik krzepnięcia krwi, substancje antywirusowe i antybiotyki.
Wiele grzybów i bakterii wytwarza naturalne antybiotyki, które są sposobem ich walki konkurencyjnej z sąsiadami. Z tego powodu naukowcy badają genomy bakterii i poszukują w nich genów kodujących nowe, nieznane jeszcze nauce substancje bakteriobójcze. Mamy też skuteczne narzędzia do konstruowania genów (czasem będących składanką fragmentów DNA pochodzącą od różnych mikroorganizmów) i produkcji na ich bazie białek niszczących bakterie lub ograniczających ich wzrost. Jest to metoda radzenia sobie z obserwowaną coraz powszechniej lekoopornością mikroorganizmów chorobotwórczych.
Leczenie chorób wirusowych wspomaga stosowanie interferonówinterferonów. Są to białka wytwarzane w komórkach jako odpowiedź na kontakt z patogenem. Spowalniają one namnażanie się wirusów, mogą też zwalczać zmiany nowotworowe. Interferony stosowane w medycynie produkowane są przez mikroorganizmy lub owady, do komórek których wprowadzono ludzkie geny. Interferonów używa się na przykład do leczenia stwardnienia rozsianego, reumatoidalnego zapalenia stawów i atopowego zapalenia skóry.

Postępy w leczeniu chorób trudnych do opanowania tradycyjnymi metodami są coraz większe. Dzięki biotechnologii rosną szanse na skuteczne leczenie AIDS. Zidentyfikowano już ludzki gen, którego produkt ma zdolność blokowania namnażania się wirusa HIV, a który jest nieaktywny u chorych osób. Zaobserwowano, że potrafi on ograniczyć rozprzestrzenianie się zakażenia w hodowlach ludzkich komórek. Jednak opracowanie skutecznej terapii dla człowieka potrwa jeszcze wiele lat, ponieważ trzeba m.in. zapobiec występowaniu powikłań.
Prawdopodobnie za 10 lat, dzięki lekom nowej generacji, można będzie wyleczyć prawie wszystkich chorych na wirusowe zapalenie wątroby typu C. Jest to jedna z najbardziej zakaźnych chorób, która potrafi się rozwijać wiele lat w ukryciu, prowadząc niepostrzeżenie do uszkodzenia wątroby. Obecna terapia z wykorzystaniem interferonu trwa ok. 1 roku i ma wiele skutków ubocznych. Testowane leki nowej generacji mają uniemożliwić powielanie się wirusa w zainfekowanym organizmie, doprowadzić do wyleczenia w ciągu kilku tygodni i a terapia nimi ma być niemal całkowicie pozbawiona skutków ubocznych.
4. Terapia komórkowa
U człowieka klonowanie dotyczy głównie komórek macierzystychkomórek macierzystych i określane jest mianem klonowania terapeutycznego. Komórki macierzyste charakteryzują się zdolnością do podziałów i przekształcania się w inne typy komórek.
Po podziale komórki zwykle różnicują się (specjalizują), przystosowując do pełnienia określonej funkcji. Choć posiadają pełny komplet informacji genetycznej zawierającej instrukcję działania całego organizmu, korzystają tylko z jego części przydatnej w narządzie, w skład którego wchodzą. Niektóre komórki organizmu dorosłego człowieka zachowują zdolność do powielania się i różnicowania przez całe życie. Dzięki temu mogą dzielić się w miarę potrzeb organizmu. Chemiczne sygnały wytwarzane przez otaczające je zróżnicowane komórki stają się dla nich impulsami do transformacji, dzięki czemu zasilą one daną tkankę. Dojrzałe komórki macierzyste występujące w określonych narządach (w szpiku kostnym, miazdze zębowej, jelitach) mogą się przekształcić tylko w kilka typów tkanek. Zdolność transformacji we wszystkie typy mają komórki embrionalne. Może z nich powstać ponad 200 różnych tkanek.
Komórki macierzyste można stosować w leczeniu chorób zwyrodnieniowych oraz regeneracji tkanek, a także w opóźnianiu procesu starzenia.

Terapia komórkami macierzystymi może posłużyć m.in. do regeneracji mięśnia sercowego np. do odtworzenia naczyń krwionośnych po operacji wszczepienia by‑passów. Okazuje się, że po umieszczeniu ich w mięśniu sercowym integrują się one z otaczającymi tkankami i odbudowują istniejące w nich ubytki. W podobny sposób można leczyć chorobę polegającą na włóknieniu płuc. W hodowli in vitro udało się z komórek macierzystych uzyskać nabłonek pęcherzyków płucnych, który po wszczepieniu w miejsce zdegenerowane odbudował strukturę narządu. Metodę leczenia za pomocą komórek macierzystych (własnych pacjenta lub obcych) określa się mianem terapii komórkowejterapii komórkowej.
Od lat 70. ubiegłego wieku komórki macierzyste są wykorzystywane do hodowli płatów skórnych dla pacjentów z poparzeniami zajmującymi duże powierzchnie. Nowo wyhodowana skóra nie jest jednak identyczna z naturalną, nie posiada m.in. mieszków włosowych. Obecnie trwają badania nad hodowlą rogówki dla pacjentów cierpiących z powodu uszkodzenia tej części oka. Komórki macierzyste wszczepia się też pacjentom w określone, zmienione chorobowo miejsca, np. stawy lub przyczepy mięśniowe, gdzie się różnicują, odbudowując tkanki. Komórki macierzyste uzyskane od dawców obarczonych chorobami genetycznymi mogą być też stosowane jako modele do badań nad tymi chorobami.

Ze względu na prawny zakaz terapeutycznego wykorzystywania ludzkich zarodków korzysta się z komórek pozazarodkowych, np. zawartych w krwi pępowinowej. W prawodawstwie Unii Europejskiej ingerencja w ludzki genom jest dopuszczalna tylko do celów terapeutycznych i dozwolona jedynie w przypadku komórek somatycznych.
Krew pępowinowa, która jest źródłem komórek macierzystych, może zostać pobrana po porodzie i przechowywana nawet kilkadziesiąt lat, a w razie wystąpienia takich chorób, jak anemie złośliwe, białaczki czy zaburzenia odporności, może być użyta do autotransplantacji.
5. Inżynieria genetyczna narzędziem selekcji?
Ingerencja w materiał genetyczny organizmów, zwłaszcza człowieka, musi być bardzo rozważna. W tym ostatnim przypadku szczególnie istotne są zastrzeżenia etyczne. Manipulacja genetyczna łącznie z technikami zapłodnienia in vitro daje ogromną szansę na ochronę wielu osób przed cierpieniem, ale może też prowadzić do poważnych nadużyć. Pytania natury moralnej i prawnej budzi na przykład taka sytuacja: Kobieta z wadliwie funkcjonującymi mitochondriami pragnie mieć zdrowe dziecko. Stając się matką, każdemu potomkowi wraz z mitochondriami znajdującymi się w cytoplazmie komórki jajowej przekaże swoją wadę genetyczną. Dzięki technikom inżynierii genetycznej jądro komórkowe komórki jajowej przyszłej matki można umieścić w pozbawionej jądra gamecie innej kobiety. Jej gameta zawiera mitochondria, których DNA nie wykazuje wad. Dziecko, które się urodzi po zapłodnieniu tej komórki, będzie miało geny dwóch kobiet (jądrowe chorej matki i mitochondrialne dawczyni komórki jajowej) oraz jednego ojca.
Badając zarodki uzyskane metodą zapłodnienia in vitro na przykład pod kątem ewentualnej mutacji chromosomowej, można wybierać do wszczepienia te, które takiej wady nie zawierają. Innym często praktykowanym w niektórych społeczeństwach sposobem selekcji jest wszczepianie matkom tylko zarodków płci męskiej. Kryteria selekcji mogą być też inne, np. prognozowany wysoki intelekt lub wyjątkowa uroda. Czy ludzkość oprze się pragnieniu posiadania idealnego potomstwa? Czy nie doprowadzi to do produkcji ludzi o ściśle określonych cechach, np. idealnych żołnierzy czy supersportowców, których przyszłość tym samym będzie zdeterminowana od momentu zapłodnienia? Jakie kryterium wyboru zarodków zastosować w przypadku wad genetycznych, które mogą mieć wielki lub nieznaczny wpływ na komfort życia przyszłego dziecka? Na te i wiele innych pytań wciąż brakuje odpowiedzi, dlatego m.in. zasady prawne wielu państw zakazują ingerowania w ludzki genom.
Skomentuj słowa Francisa Collinsa, jednego z autorów projektu poznania ludzkiego genomu (HGP): „Bez odpowiednich regulacji prawnych rewolucja genetyczna może się okazać krokiem do przodu w dziedzinie nauki i medycyny, ale cofnięciem w kwestii praw obywatelskich”.
6. Toksykogenomika
Organizmy narażone są na negatywny wpływ różnych czynników obecnych naturalnie w środowisku (np. promieniowanie UV, azbest) oraz wprowadzanych do niego sztucznie. Stopień szkodliwości potencjalnie niebezpiecznych substancji można określić, obserwując wywołane przez nie zmiany w funkcjonowaniu organizmów. Szkodliwe mogą być na przykład nowe leki, w przypadku których należy określić rodzaj i ryzyko możliwych skutków ubocznych.
Badaniem zmian zachodzących w ekspresji genów i aktywności białek w danych tkankach czy komórkach pod wpływem czynników środowiskowych i toksyn zajmuje się toksykogenomikatoksykogenomika. Obserwacja tych zmian oparta jest o biomarkerybiomarkery, substancje, które pojawiają się w komórkach po podaniu testowanych związków chemicznych. Toksykogenomika pozwala przewidzieć reakcję danego organizmu (o znanych sekwencjach DNA) na określoną substancję (truciznę lub lek) oraz zastosować terapię dedykowaną danej osobie. Dzięki rozwojowi tej dziedziny wiedzy nowego znaczenia nabierze postulat: leczyć osobę, a nie chorobę.
Rozwój toksykogenomiki może w przyszłości przyczynić się do skrócenia czasu trwania badań przedklinicznych (kiedy leków jeszcze nie podaje się ludziom). Bardziej wyrazista reakcja organizmu (czułe biomarkery) pozwolą na obserwowanie reakcji już w materiale genetycznym.
Celem toksykogenomiki jest zwiekszenie czułości testów, które pozwoli na ograniczenie wielkości stosowanych dawek toksyn. Ma to duże znaczenie, ponieważ wiele leków to silne trucizny, które w małych ilościach przynoszą bardzo dobre efekty terapeutyczne, natomiast w większych dawkach mogą mieć śmiertelny wpływ na organizm (np. glikozydy nasercowe zawarte w naparstnicy lub konwalii majowej).

Żyjący w XVI w. szwajcarski lekarz i przyrodnik, zwany ParacelsusemParacelsusem, odkrył zjawisko wpływu substancji na organizm: w niewielkich ilościach – leczniczego, w dużych – toksycznego. Jest autorem słynnego powiedzenia: „Wszystko jest trucizną i nic nie jest trucizną, bo tylko dawka czyni truciznę”.
Podsumowanie
Badania genetyczne pozwalają ustalić prawdopodobieństwo pojawienia się choroby genetycznej.
Komórki macierzyste mogą być wykorzystane w medycynie regeneracyjnej.
Klonowanie komórek macierzystych ma istotne znaczenie w terapii i dla rozwoju medycyny.
Toksykogenomika bada zmiany zachodzące w ekspresji genów pod wpływem czynników środowiskowych i toksyn.
1. Wymień korzyści wynikające z zastosowania badań DNA w medycynie.
2. Wyraź swoją opinię na temat wykorzystania inżynierii biologicznej do potencjalnie możliwej reprodukcji człowieka o zaplanowanych cechach. Uzasadnij ją, używając argumentów naukowych.
Słowniczek
charakterystyczne substancje pojawiające się w mierzalnych ilościach w komórkach po podaniu określonych substancji, np. toksyn
białko wytwarzane przez organizmy w odpowiedzi na infekcję lub pojawienie się komórek nowotworowych; aktywuje układ odpornościowy
niedojrzałe komórki organizmu mające zdolność dzielenia się i różnicowania w różne typy tkanek; występują w zarodkach, krwi pępowinowej, jelicie, szpiku kostnym

Paracelsus
Właściwie nazywał się Phillippus Aureolus Theophrastus Bombastus von Hohenheim. Był przyrodnikiem, lekarzem, badał wiele substancji chemicznych oraz naturalnych (np. pochodzących z ziół) pod kątem wykorzystania w lecznictwie.
terapia polegająca na wykorzystaniu komórek macierzystych do regeneracji uszkodzonych tkanek i organów
dziedzina nauki zajmująca się badaniem zmian w ekspresji genów i białek oraz ich zróżnicowanych reakcji na dane toksyny w zależności od indywidualnych cech genomu
Zadania
Mutacja w genie BRCA Możliwe odpowiedzi: 1. występuje u części osób zagrożonych nowotworem., 2. umożliwia powielanie uszkodzonych odcinków DNA., 3. zawsze prowadzi do nowotworu piersi., 4. występuje z częstotliwością 1: 200 000 000., 5. u mężczyzn nie prowadzi do rozwoju nowotworu.
Wskaż poprawne zakończenie zdania.
Mutacja w genie BRCA
- występuje u części osób zagrożonych nowotworem.
- umożliwia powielanie uszkodzonych odcinków DNA.
- zawsze prowadzi do nowotworu piersi.
- występuje z częstotliwością 1: 200 000 000.
- u mężczyzn nie prowadzi do rozwoju nowotworu.
Uzupełnij luki w tekście.
Mukowiscydoza to choroba ..................... Jej przyczyną jest .............. genu CFTR, który koduje białko odpowiedzialne za transport ............ sodu. Mukowiscydoza daje objawy głównie w układzie .....................
Wskaż poprawne zakończenie zdania.
Komórki macierzyste
- nie mogą różnicować się w komórki kości.
- są zdolne do przekształcenia się w dowolne komórki organizmu.
- nie mogą być stosowane w medycynie, ale mogą w weterynarii.
- pobierane do przeszczepów nie mogą pochodzić od osób z chorobami genetycznymi.
Biomarkery Możliwe odpowiedzi: 1. i interferony to białka wytwarzane przez komórki., 2. są specyficzne dla każdego związku chemicznego., 3. to inna nazwa interferonów., 4. powstają w odpowiedzi na zakażenie wirusem.
Wskaż poprawne zakończenie zdania.
Biomarkery
- i interferony to białka wytwarzane przez komórki.
- są specyficzne dla każdego związku chemicznego.
- to inna nazwa interferonów.
- powstają w odpowiedzi na zakażenie wirusem.