Sporządzanie roztworów
Sporządzanie roztworu o określonym stężeniu procentowym
Aby przygotować roztwór o określonym stężeniu procentowym, należy znać masy jego składników: rozpuszczalnika i substancji rozpuszczonej. W tym celu należy wcześniej dokonać odpowiednich obliczeń. Obliczoną ilość substancji stałej (która w roztworze będzie stanowiła substancję rozpuszczoną) należy odważyć i dokładnie wymieszać z odmierzoną objętością ciekłego rozpuszczalnika. Objętość rozpuszczalnika możemy obliczyć, znając jego masę oraz gęstość.
Zapoznanie z czynnościami niezbędnymi do przygotowania roztworu o określonym stężeniu procentowym – procedura przygotowania wodnego roztworu chlorku sodu o stężeniu .
Zaprojektuj doświadczenie pozwalające na przygotowanie wodnego roztworu chlorku sodu (soli kuchennej) o stężeniu . Wypisz nazwy niezbędnego sprzętu laboratoryjnego oraz odczynników (substancji chemicznych). Następnie napisz, jakie czynności trzeba wykonać, żeby sporządzić opisany roztwór (zapisz instrukcję).
Oblicz masę substancji (wyrażoną w gramach) oraz objętość wody (wyrażoną w centymetrach sześciennych), niezbędne do przygotowania wodnego roztworu chlorku sodu o stężeniu . Załóż, że gęstość wody wynosi . Sprawdź swoją odpowiedź. W razie wątpliwości, przeanalizuj rozwiązanie.
Postępując zgodnie z zaproponowaną przez Ciebie instrukcją (po jej zweryfikowaniu z instrukcją przykładową zamieszczoną w sekcji „odpowiedź”), przeprowadź doświadczenie. Następnie obejrzyj film i sprawdź poprawność wykonywanych czynności laboratoryjnych.
Czy wiesz, jak sporządzić roztwór o określonym stężeniu procentowym? Przeprowadź eksperyment w laboratorium chemicznym. Pamiętaj o wyzerowaniu masy zlewki przed przystąpieniem do sporządzania roztworów.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DmDdjx6bN
Wirtualne laboratorium „Sporządzanie roztworów o określonym stężeniu procentowym”. Temperatura powietrza w laboratorium wynosi dwudziestu stopni Celsjusza.
Na stole laboratoryjnym znajduje się cylinder miarowy, czyli wysokie, wąskie naczynie z miarką do stu mililitrów, służące do odmierzania roztworów. Przezroczysta butelka wypełniona do połowy wodą. Na stole znajduje się także pusta zlewka szklana dwieście mililitrów – naczynie szklane o kształcie cylindrycznym, stosowane do przeprowadzania prostych reakcji chemicznych oraz waga elektroniczna z cyfrowym wyświetlaczem z funkcją tarowania – urządzenie elektryczne służące do wyznaczania mas substancji. Daną substancję umieszcza się na srebrnej tacy umieszczonej na urządzeniu. Masa ważonej substancji wyświetlana jest na wyświetlaczu. Waga pokazuje wagę w jednostce gram. Nad stołem laboratoryjnym wiszą dwie półki na których ustawione są pojemniki z substancjami chemicznymi. Na każdym z pojemników widnieje etykieta z nazwą związku chemicznego oraz środkami ostrożności. Dodatkowo na etykietach podana jest wartość rozpuszczalności danego związku w temperaturze dwadzieścia stopni Celsjusza podanych w gramach na sto gramów wody. Podana jest również masa molowa danego związku chemicznego. Na górnej półce ustawionych jest sześć pojemników w których występuje inna substancja: chlorek kobaltu () (rozpuszczalność: grama na sto gramów wody, masa molowa: grama na mol), azotan () kobaltu () (rozpuszczalność: grama na sto gramów wody, masa molowa: grama na mol), siarczan () miedzi () (rozpuszczalność: gramów na sto gramów wody, masa molowa: 1 grama na mol), chromian () potasu ( gramów na sto gramów wody, masa molowa: grama na mol), dichromian () potasu (rozpuszczalność: grama na sto gramów wody, masa molowa: grama na mol), manganian () potasu (rozpuszczalność gramów na sto gramów wody, masa molowa: grama na mol), chlorek sodu (rozpuszczalność: grama na sto gramów wody, masa molowa: grama na mol) i chlorek niklu () (rozpuszczalność: grama na sto gramów wody, masa molowa: grama na mol). Dodatkowo na półce leży szklana bagietka służąca do mieszania roztworów. Na dolnej półce ustawione są cztery pojemniki, w których są następujące substancje: chlorek kobaltu () – woda (rozpuszczalność: grama na sto gramów wody, masa molowa: 3 grama na mol), chlorek żelaza () – woda (rozpuszczalność: gramy na sto gramów wody, masa molowa: grama na mol), siarczan () żelaza () – woda (rozpuszczalność: gramów na sto gramów wody, masa molowa: gramów na mol) oraz siarczan () magnezu () – woda (rozpuszczalność: gramów na sto gramów wody, masa molowa: grama na mol). Na dolnej półce stoją w szklanym, przezroczystym okrągłodennym pudełku łyżki laboratoryjne służące do naważania.
Przed przystąpieniem do czynności naważania należy wyzerować zlewkę na wadzę. Wówczas ekran wagi pokazuje nam zero gramów i po umieszczeniu w niej wody i związku chemicznego wskaże nam właściwą masę roztworu. Do cylindra miarowego wlewamy odpowiednią ilość wody i przelewamy to do zlewki umieszczonej na wadze. Dodajemy odpowiedniej ilości danego związku chemicznego wykorzystując w tym celu łyżeczkę. Umieszczamy związek w zlewce. Masa na wadze zwiększa się o ilość dosypanego związku. Ściągamy zlewkę z wagi i wykorzystując szklaną bagietkę mieszamy zawartość. Obserwujemy rozpuszczenie związku albo powstanie osadu.
Chcąc uzyskać stężenie procent związku chlorku kobaltu () o rozpuszczalności grama na sto gramów wody i masie molowej grama na mol należy zmieszać mililitrów wody i grama związku. W zlewce obserwujemy całkowite rozpuszczenie się związku. W przypadku dodania zbyt dużej ilości związku przekraczającej możliwości rozpuszczalności obserwuje się wytrącenie osadu. W tym przypadku rozpuszczalność związku wynosi grama na sto gramów wody. Wymieszając gramów z mililitrami wody, otrzymamy roztwór o stężeniu . W zlewce zaobserwujemy wówczas osad.
Chcąc uzyskać stężenie dziesięć procent związku chromianu () potasu o rozpuszczalności grama na sto gramów wody i masie molowej grama na mol należy zmieszać mililitrów wody z gramami związku. W zlewce obserwujemy całkowite rozpuszczenie się związku. W przypadku dodania zbyt dużej ilości związku przekraczającej możliwości rozpuszczalności obserwuje się wytrącenie osadu.
Oblicz, jaką masę ma roztworu, którego gęstość wynosi . Wynik podaj w gramach, z dokładnością do drugiego miejsca po przecinku. Sprawdź odpowiedź. W przypadku wątpliwości, przeanalizuj rozwiązanie zadania.
Oblicz gęstość roztworu, którego ma masę . Wynik podaj z dokładnością do drugiego miejsca po przecinku. Sprawdź odpowiedź. W przypadku wątpliwości, przeanalizuj rozwiązanie zadania.
Oblicz, ile gramów cukru znajduje się w roztworu o stężeniu , jeżeli jego gęstość wynosi .
Jak zmienia się stężenie roztworu po jego rozcieńczeniu?
Zmiana ilości (masy) rozpuszczalnika powoduje zmianę ilości (masy) roztworu. Domyślasz się już zapewne, że będzie to rzutowało na zmianę stężenia roztworu.
Przeanalizuj poniższą grafikę i wyjaśnij w jaki sposób rozcieńczanie roztworu wpływa na wartość jego stężenia procentowego. Sprawdź swoją odpowiedź.

Rozcieńczanie roztworu polega na dodaniu rozpuszczalnika do roztworu. Zastanów się i napisz, w jaki sposób rozcieńczenie wpłynie na wartość stężenia procentowego tego roztworu?
Jak zmienia się stężenie roztworu po jego zatężaniu?
Przeanalizuj poniższą grafikę i wyjaśnij, w jaki sposób odparowanie części rozpuszczalnika z roztworu wpływa na wartość jego stężenia procentowego. Sprawdź swoją odpowiedź.
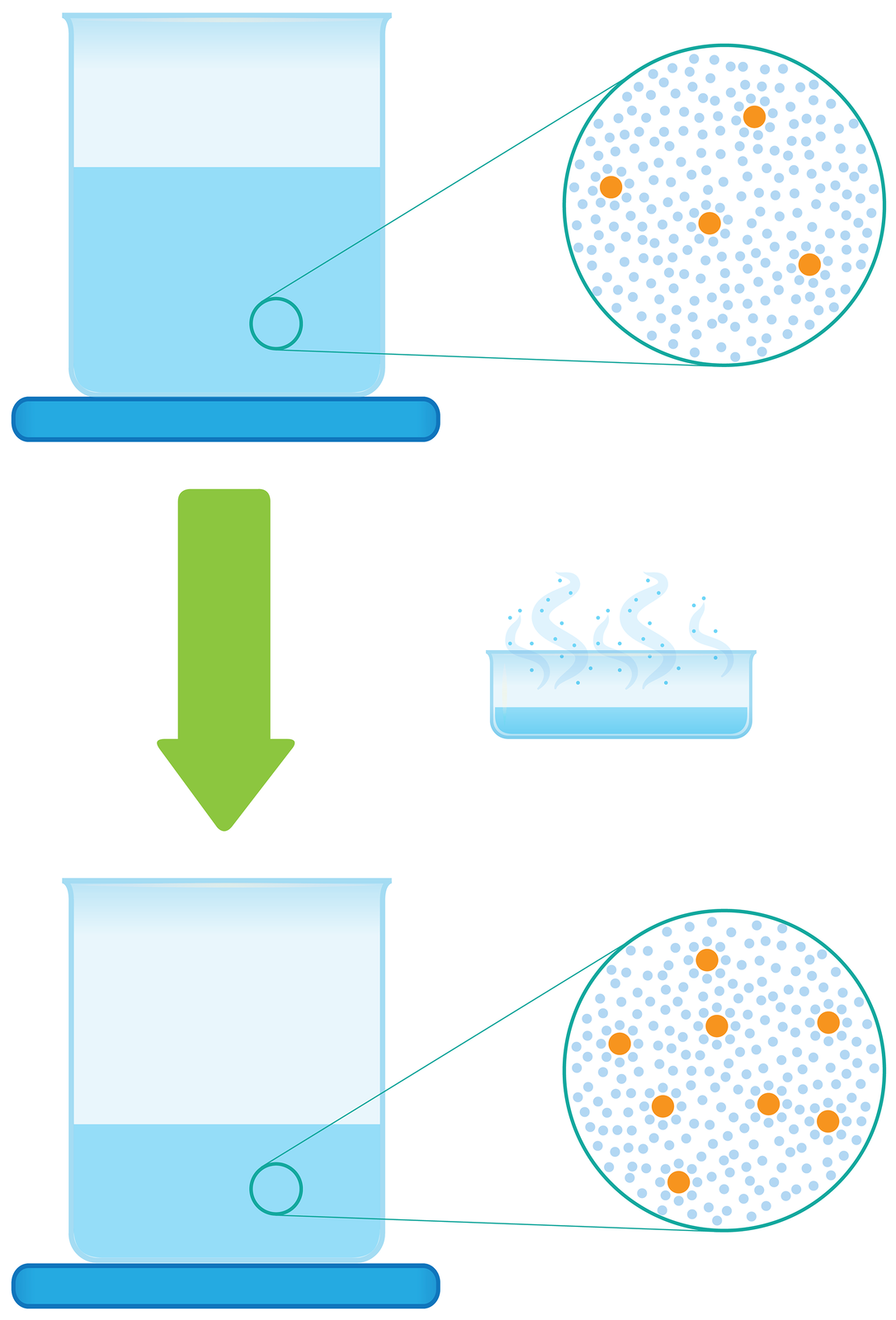
Zatężanie roztworu polega na zmniejszeniu masy rozpuszczalnika, np. poprzez jego odparowanie, przy jednoczesnym braku zmian masy substancji rozpuszczonej. Zastanów się i napisz, w jaki sposób odparowanie rozpuszczalnika wpłynie na stężenie procentowe roztworu?
Podsumujmy najważniejsze informacje:
Stężenie roztworu można zmieniać poprzez jego rozcieńczanie bądź zatężanie.
W efekcie rozcieńczania, stężenie roztworu maleje, a w wyniku zatężania rośnie.
Roztwór można rozcieńczyć przez dodanie do niego rozpuszczalnika.
Zwiększenie stężenia roztworu następuje po odparowaniu rozpuszczalnika lub dodaniu nowej porcji substancji rozpuszczonej.
Stężenie roztworu, który powstanie w wyniku zmieszania roztworów tej samej substancji, ale o innych stężeniach, będzie różnić się od stężeń roztworów użytych do zmieszania (roztworów wyjściowych).
Słownik
obniżenie stężenia roztworu, np. w wyniku dodania do niego rozpuszczalnika
zwiększenie stężenia roztworu w wyniku dodania do niego dodatkowej ilości substancji rozpuszczonej lub odparowania części rozpuszczalnika
