Gdzie występuje azot i jaką rolę odgrywa w przyrodzie?
Zapoznaj się ze zdjęciami zamieszczonymi w poniższej galerii.
Czy wiesz, co wspólnego mają ze sobą te zdjęcia? Odpowiedź na to pytanie znajdziesz w poniższym wątku.
Azot – występowanie i obieg w przyrodzie
Azot jest gazem będącym składnikiem powietrza – stanowi około jego objętości. Co ciekawe, pomimo tego zajmuje dopiero piąte miejsce pod względem rozpowszechnienia we Wszechświecie.
Oblicz objętość azotu zawartego w pomieszczeniu o wymiarach .
Wynik podaj w z dokładnością do pierwszego miejsca po przecinku.
Azot jest jednym z najważniejszych pierwiastków chemicznych. Wchodzi między innymi w skład wielu związków chemicznych budujących organizmy żywe. Do związków tych zaliczamy między innymi białka oraz kwasy nukleinowe ( i ).
Azot pełni także ważną rolę w rozwoju roślin – warunkuje ich prawidłowy rozwój, pobudza wzrost oraz nadaje im intensywnie zieloną barwę. Reguluje również pobieranie innych składników pokarmowych przez rośliny, co wpływa na jakość i wielkość plonów.
Tylko niektóre rośliny, zwane motylkowymi (np. groch, fasola, orzeszki ziemne), za pomocą bakterii występujących w ich korzeniach (tak zwanych bakterii brodawkowych), mają zdolność pobierania azotu z powietrza i wykorzystywania go do tworzenia związków chemicznych budujących komórki roślinne. Pozostałe rośliny muszą pobierać azot z gleby, gdzie pierwiastek ten znajduje się w postaci odpowiednich związków chemicznych.
Poniżej przedstawiono wybrane rośliny motylkowe.



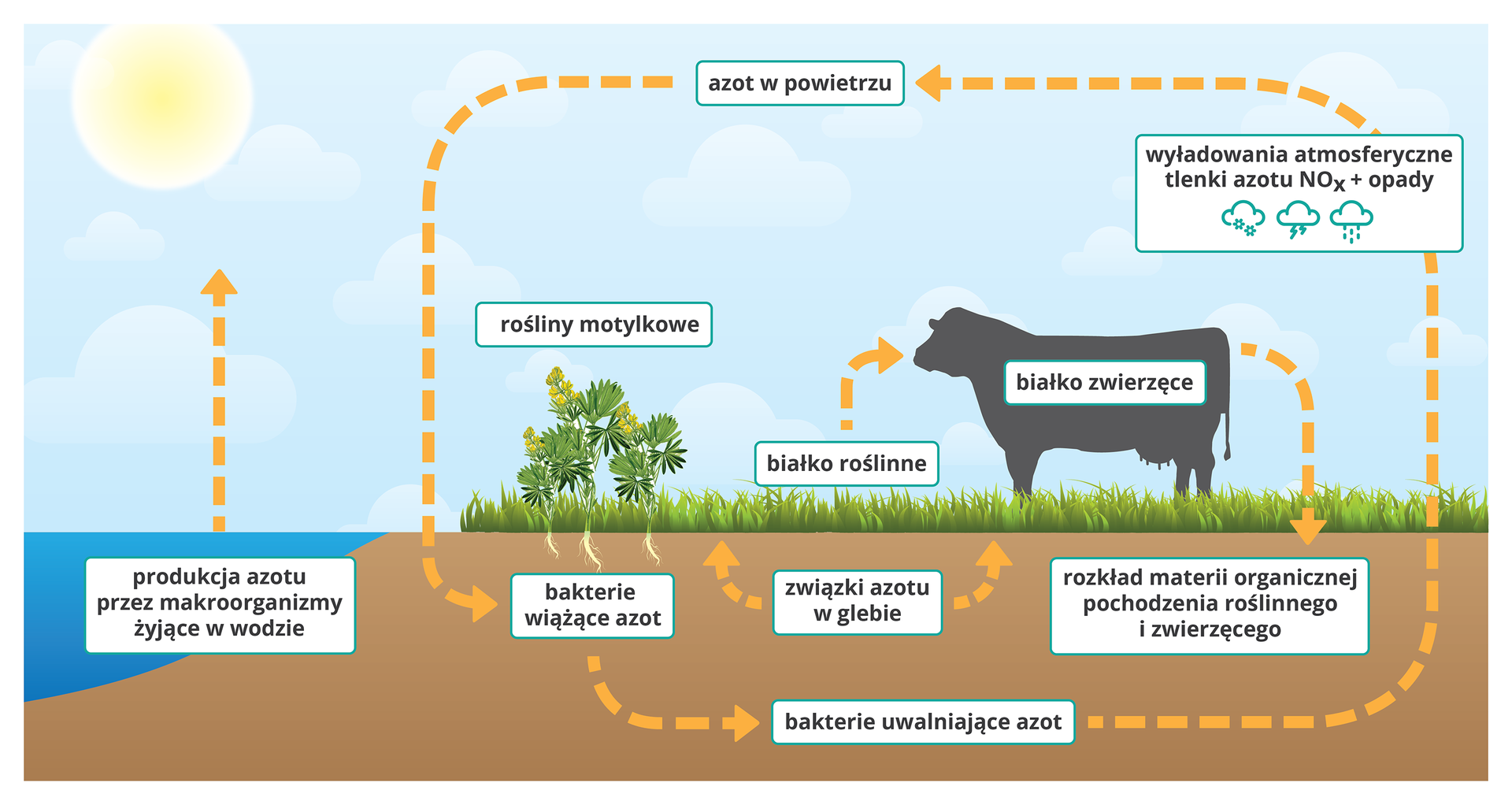
Związki azotu mogą być wprowadzane do gleby w postaci odpowiednich nawozów sztucznych, skąd wraz z wodą są pobierane przez rośliny. Cykliczny proces, polegający na przyswajaniu, przekształcaniu oraz oddawaniu azotu i jego związków chemicznych, nazywamy obiegiem azotu w przyrodzie.
Schemat obiegu azotu w przyrodzie zilustrowano na poniższej grafice. Zapoznaj się z zawartymi na niej informacjami, a następnie wykonaj polecenie .
Obecność niektórych roślin na danym podłożu pozwala ocenić, czy gleba jest bogata, czy uboga w azot. Przykładowo masowe występowanie na badanym terenie między innymi skrzypu, szczawiu lub jaskra, wskazuje na niską zawartość azotu w glebie. Rośliny te mają bowiem niewielkie zapotrzebowanie na azot.
Poniżej przedstawiono wybrane rośliny, których obecność świadczy o tym, że gleba na danym terenie jest uboga w związki azotu.




W miarę użyźniania tego obszaru odpowiednimi nawozami azotowymi (tak zwanymi saletramisaletrami), rośliny te zaczną obumierać. Po pewnym czasie na nawożonym terenie mogą pojawić się między innymi: pokrzywa, rdest bądź jasnota biała.
Poniżej przedstawiono wybrane rośliny, których obecność świadczy o tym, że gleba na danym terenie jest bogata w związki azotu.




Azot jako pierwiastek chemiczny
Azot jest pierwiastkiem chemicznym należącym do niemetali. W układzie okresowym położony jest w grupie i w okresie.
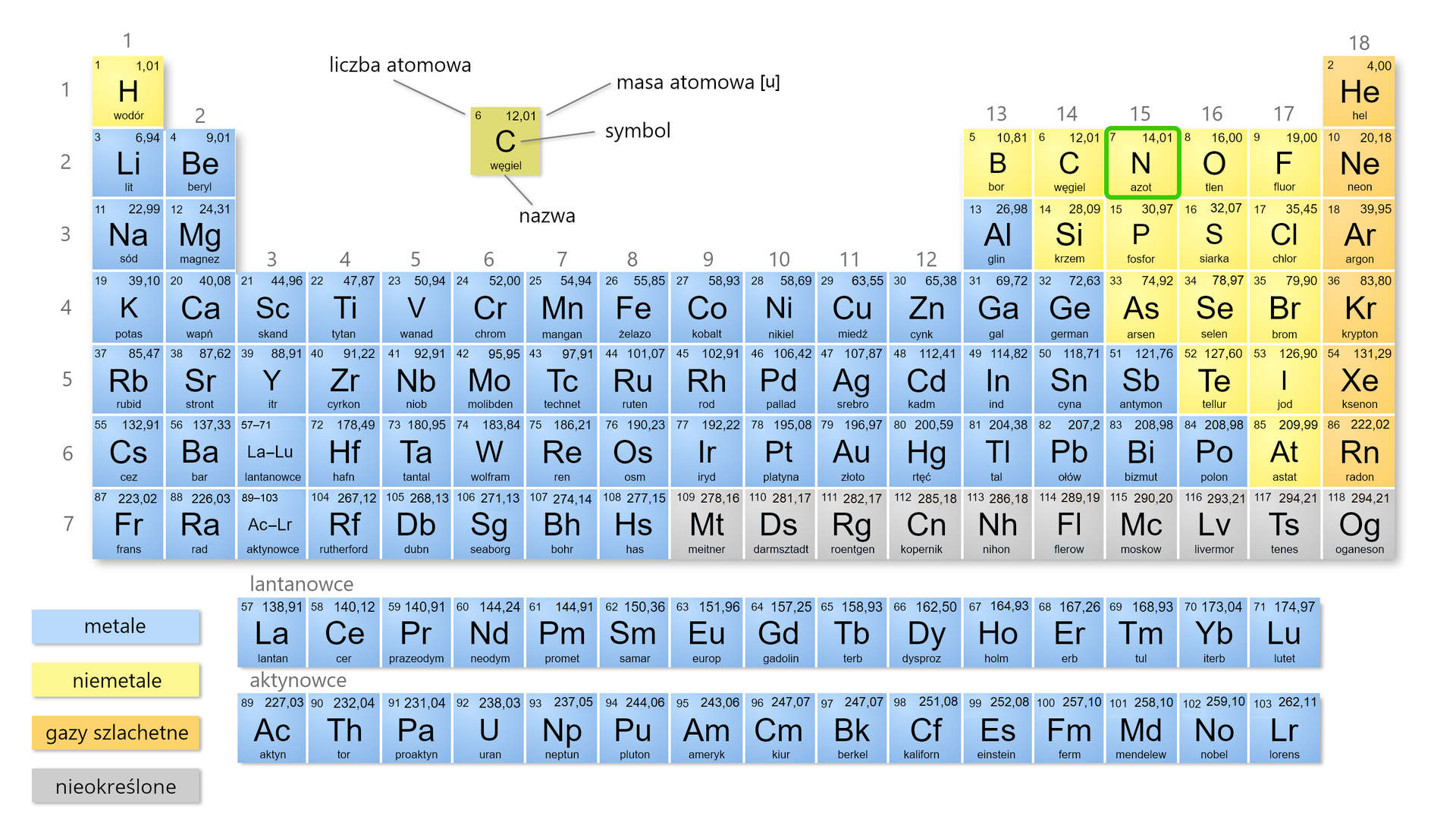
liczba elektronów: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13.
liczba powłok elektronowych: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13.
liczba elektronów walencyjnych: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13.
konfiguracja elektronowa: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13.
masa atomowa: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13.
W powietrzu azot występuje w postaci dwuatomowych cząsteczek.

Podczas oddychania, oprócz tlenu, do płuc transportowany jest także azot. Pierwiastek ten nie uczestniczy w procesach metabolizmu i jest obojętny dla organizmu człowieka. Jednak przy zbyt gwałtownej zmianie ciśnienia (np. podczas szybkiego wynurzania się nurka z wody lub rozszczelnienia kabiny samolotu) tworzy we krwi pęcherzyki powodujące zatory i odcięcie dopływu tlenu do komórek.
Efektem są: bóle i zawroty głowy, podwójne widzenie, zaburzenia ruchu, bóle stawów, utrata przytomności, a nawet śmierć. Opisane dolegliwości, zwane chorobą kesonowąchorobą kesonową (lub chorobą dekompresyjną), jako pierwsi odczuli poławiacze pereł i łowcy gąbek. Na tę samą przypadłość zapadają budowniczowie mostów, którzy długo przebywają w kesonach, czyli suchych komorach wypełnionych sprężonym powietrzem, ustawianych na dnie rzek.
Na poniższych zdjęciach przedstawiono kabinę (komorę) dekompresyjną wykorzystywaną często przez nurków, którzy z różnych przyczyn zbyt szybko wynurzyli się z wody. Dekompresja polega na powolnej zmianie ciśnienia otoczenia z wysokiego na niskie. W efekcie nagromadzony w organizmie nurka azot zostaje z niego stopniowo usuwany.


Otrzymywanie i badanie właściwości azotu
Jedną z metod otrzymywania azotu w laboratorium chemicznym jest ostrożne ogrzewanie związku chemicznego o nazwie dichromian() amonu. Otrzymaj azot opisaną metodą i zbadaj jego właściwości fizykochemiczne. W tym celu wykonaj doświadczenie . Jeśli nie masz możliwości samodzielnego wykonania doświadczenia, zapoznaj się ze schematycznymi rysunkami obrazującymi jego przebieg. Wspomniane rysunki mieszczą się bezpośrednio pod instrukcją.
Przeprowadzono doświadczenie chemiczne, w którym zbadano właściwości azotu.
Problem badawczy:
Jakie właściwości fizykochemiczne ma azot?
Hipoteza:
Azot jest bezbarwnym, bezwonnym i niepalnym gazem, praktycznie nierozpuszczalnym w wodzie.
Co było potrzebne:
dichromian() amonu;
zimna woda;
płyta grzewcza (laboratoryjna);
łyżka laboratoryjna;
kolba stożkowa z tubusem bocznym i korkiem;
rurka odprowadzająca;
probówka;
korek do probówki;
statyw na probówki;
krystalizator;
łuczywo;
zapałki.
Przebieg doświadczenia:
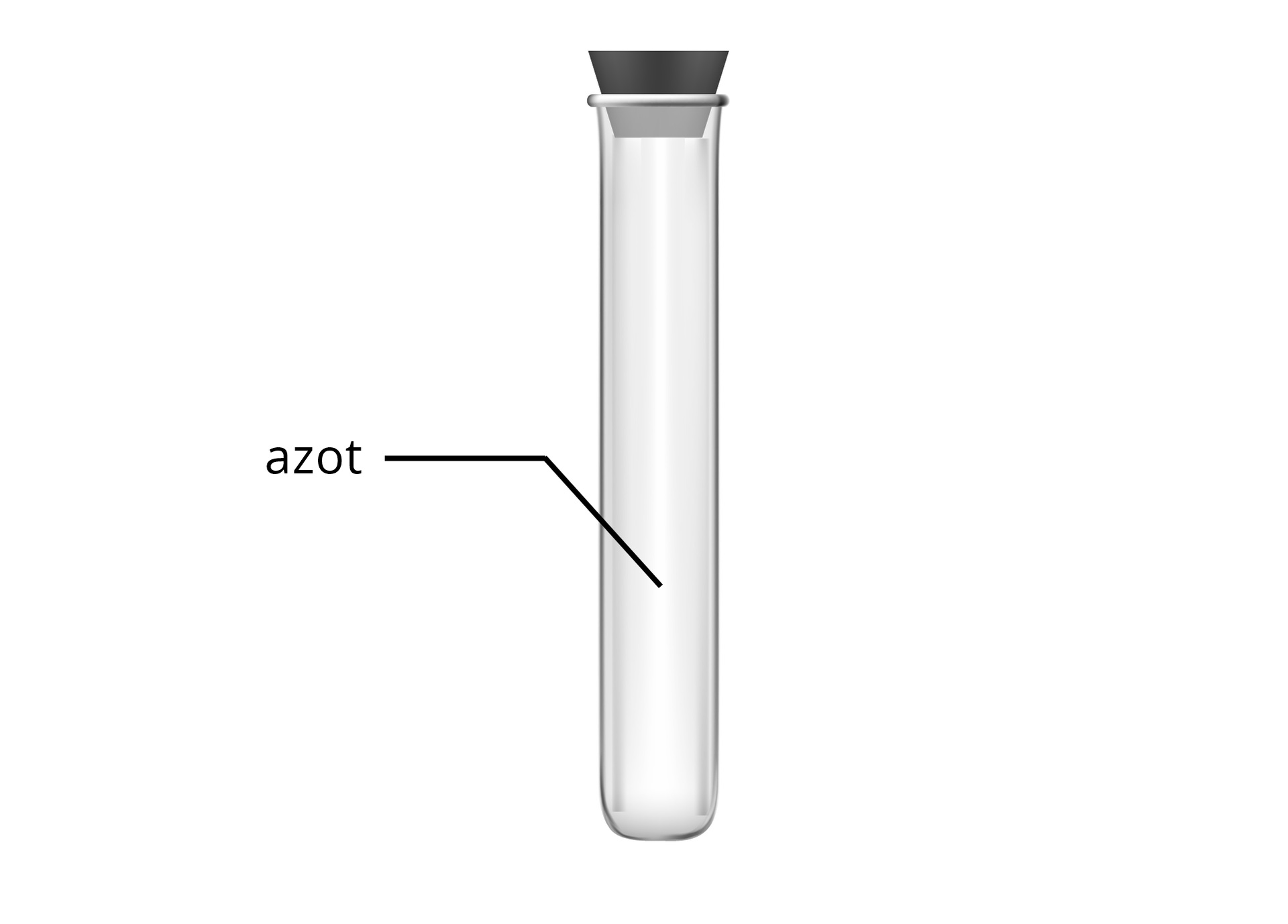
Przy pomocy łyżki laboratoryjnej w kolbie umieszczono porcję dichromianu() amonu. Kolbę zatkano korkiem, a do tubusa bocznego podłączono wężyk odprowadzający. Drugi koniec wężyka umieszczono w probówce, ułożonej do góry dnem i zanurzonej w krystalizatorze wypełnionym wodą. Probówka też wypełniona była wodą. Kolbę umieszczono na płycie grzewczej i rozpoczęto łagodne ogrzewanie. Ogrzewanie kontynuowano do momentu, aż w probówce nie znajdowała się już ciecz. Probówkę ostrożnie wyjęto z wody, nie obracając jej, i zatkano korkiem. Następnie umieszczono ją w statywie, otwarto i włożono płonące łuczywo.
Obserwacje:
Pomarańczowe ciało stałe w czasie ogrzewania stopniowo zmienia zabarwienie na ciemnozielone. Wydziela się bezbarwny, bezwonny gaz, który „wypycha” wodę z probówki umieszczonej w krystalizatorze. Po wprowadzeniu zapalonego łuczywa do probówki wypełnionej gazem zaobserwowano, że płomień zgasł.
Wnioski:
Dichromian() amonu ulega termicznemu rozkładowi z wydzieleniem dwóch gazowych produktów – pary wodnej oraz azotu. Probówkę zanurzoną w krystalizatorze wypełnia azot. Azot jest gazem bezbarwnym i bezwonnym. W związku z tym, że udało się go zebrać do zanurzonej w wodzie (i początkowo wypełnionej wodą) probówki, można wnioskować, że gaz ten jest praktycznie nierozpuszczalny w wodzie. Płomień łuczywa w kontakcie z azotem gaśnie. Oznacza to, że azot jest gazem niepalnym i nie podtrzymującym spalania.



Zapisz obserwacje i wnioski z przeprowadzonego doświadczenia .
Bezbarwny i bezwonny gaz, wydzielający się w przebiegu doświadczenia, to: Możliwe odpowiedzi: 1. azot., 2. wodór., 3. tlen., 4. chlor.
W czasie ogrzewania dichromian() amonu ulega termicznemu rozkładowi na tlenek chromu() (substancję o ciemnozielonym zabarwieniu, praktycznie nierozpuszczalną w wodzie), azot oraz wodę. Równanie opisanej reakcji chemicznej ma postać:
gdzie: oznacza temperaturę.
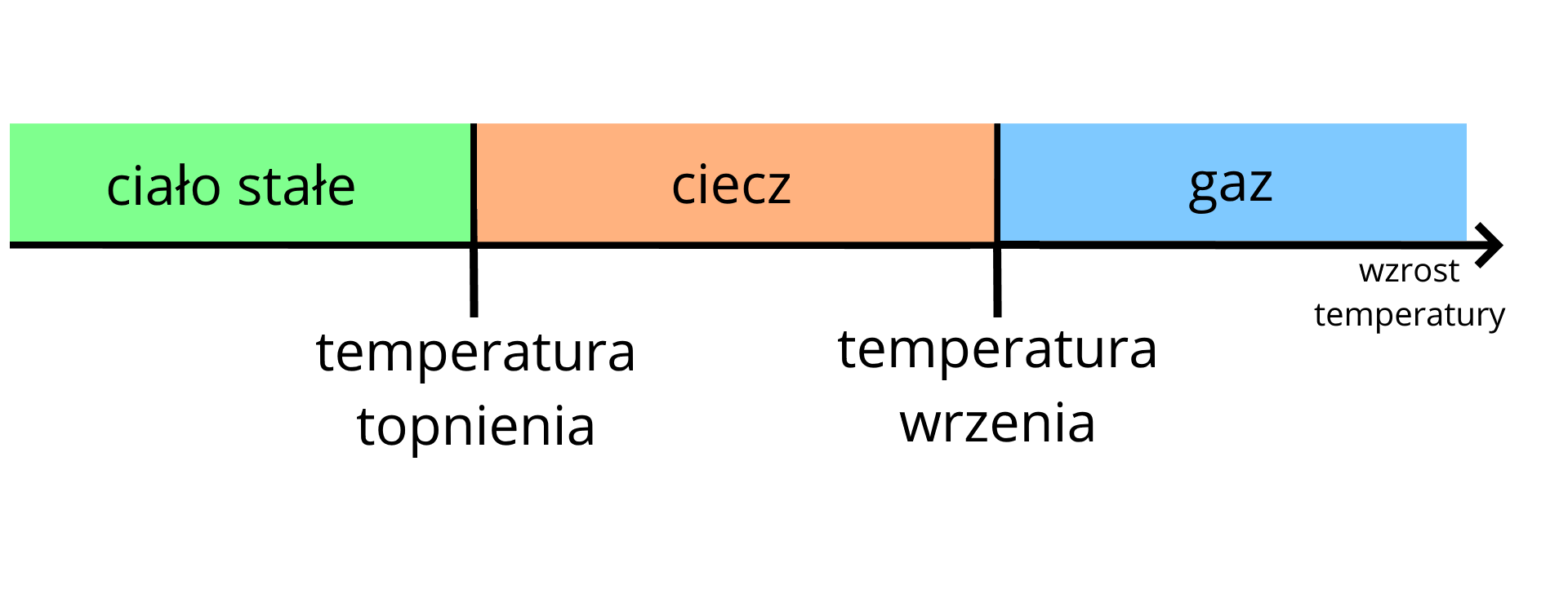
Z przeprowadzonego doświadczenia wynika, że azot jest gazem bezbarwnym i bezwonnym. Rozpuszczalność azotu w wodzie jest bardzo mała. W temperaturze , pod normalnym ciśnieniem, wynosi tylko wody (dla porównania rozpuszczalność chlorku sodu (soli kuchennej) w wodzie, w tych samych warunkach, wynosi wody). Dzięki temu, że azot jest bardzo słabo rozpuszczalny w wodzie i nie reaguje z nią, możemy gaz ten zbierać „nad” wodą.
W kontakcie z azotem płomień łuczywa gaśnie. Oznacza to, że azot jest gazem niepalnym i nie podtrzymuje spalania.
Poniższy wykres przedstawia zależność między rozpuszczalnością azotu w wodzie a temperaturą (pod ciśnieniem około ). Jest to tak zwana krzywa rozpuszczalności azotu. Przeanalizuj dane zawarte na wykresie, a następnie oceń poprawność znajdujących się pod nim stwierdzeń.
- 1. zestaw danych:
- Temperatura (⁰C): 0
- Rozpuszczalność: 0,00294; Podpis osi wartości: Rozpuszczalność azotu (g/100 g wody)
- 2. zestaw danych:
- Temperatura (⁰C): 10
- Rozpuszczalność: 0,00231; Podpis osi wartości: Rozpuszczalność azotu (g/100 g wody)
- 3. zestaw danych:
- Temperatura (⁰C): 20
- Rozpuszczalność: 0,00189; Podpis osi wartości: Rozpuszczalność azotu (g/100 g wody)
- 4. zestaw danych:
- Temperatura (⁰C): 30
- Rozpuszczalność: 0,00162; Podpis osi wartości: Rozpuszczalność azotu (g/100 g wody)
- 5. zestaw danych:
- Temperatura (⁰C): 40
- Rozpuszczalność: 0,00139; Podpis osi wartości: Rozpuszczalność azotu (g/100 g wody)
- 6. zestaw danych:
- Temperatura (⁰C): 50
- Rozpuszczalność: 0,00121; Podpis osi wartości: Rozpuszczalność azotu (g/100 g wody)
- 7. zestaw danych:
- Temperatura (⁰C): 60
- Rozpuszczalność: 0,00105; Podpis osi wartości: Rozpuszczalność azotu (g/100 g wody)
Na wykresie liniowym przedstawiono zależność między rozpuszczalnością azotu w wodzie a temperaturą ((pod ciśnieniem około ). Jest to tak zwana krzywa rozpuszczalności azotu.
– ;
– ;
– ;
– ;
– ;
– ;
– .
Przeanalizuj dane zawarte na wykresie, a następnie oceń poprawność znajdujących się pod nim stwierdzeń.
Azot jest gazem pozbawionym smaku. Gęstość azotu w temperaturze i pod ciśnieniem () wynosi , podczas gdy gęstość powietrza w tych samych warunkach jest równa . Gęstość azotu jest zatem zbliżona do gęstości powietrza. Nieco większa gęstość powietrza wynika z faktu, że jest w nim obecny tlen, który charakteryzuje się gęstością większą od azotu (gęstość tlenu w analizowanych warunkach ciśnienia i temperatury wynosi ).
W poniższej tabeli zamieszczono wartości temperatury wrzenia i topnienia azotu (pod ciśnieniem ).
Temperatura wrzenia azotu | Temperatura topnienia azotu |
|---|---|
Indeks górny Źródło: Mizerski W., Małe tablice. Chemia, Warszawa 2019, s. 16. Indeks górny koniecŹródło: Mizerski W., Małe tablice. Chemia, Warszawa 2019, s. 16.
Za odkrywcę azotu uważa się szkockiego chemika i fizyka Daniela RutherfordaDaniela Rutherforda (czyt. ruterforta). W roku, jako pierwszy „wyizolował” on czysty azot z powietrza. W tym samym czasie, niezależnie od Rutherforda, swoje prace nad azotem prowadzili Carl Sheele (czyt. karl szele), Joseph Priestley (czyt. dżozef pristlej) oraz Antoine Lavoisier (czyt. antuan lawłazier).
Obecnie, na skalę przemysłową azot otrzymuje się z powietrza. Wspomniana metoda polega w uproszczeniu na skropleniu powietrza i tak zwanej destylacjidestylacji frakcjonowanej uzyskanej cieczy. Destylacja jest metodą rozdziału mieszanin ciekłych, wykorzystującą różnice w temperaturach wrzenia ich składników.
Azot po raz pierwszy został skroplony w roku przez polskich uczonych – Karola OlszewskiegoKarola Olszewskiego i Zygmunta WróblewskiegoZygmunta Wróblewskiego – pracowników Uniwersytetu Jagiellońskiego.

Zastosowanie azotu
Gazowy azot () stanowi atmosferę ochronną w opakowaniach artykułów spożywczych (np. w chipsach) i farmaceutycznych. Sprężonego azotu używa się do rozpylania cieczy, np. w dezodorantach. Gaz ten stanowi również składnik specjalnych mieszanin wykorzystywanych przez płetwonurków w czasie nurkowania.
Ciekły azot jest stosowany jako środek chłodzący – między innymi do zamrażania materiału biologicznego, np. próbek krwi, tkanek, zastawek serca, oraz podczas zabiegów rehabilitacyjnych – do miejscowych znieczuleń. Wykorzystuje się go również w chirurgii serca i podczas transfuzji krwi. Dużą popularnością ciekły azot cieszy się również w tak zwanej kuchni molekularnej, gdzie znalazł zastosowanie zarówno podczas przyrządzania posiłków, jak i zamrażania potraw.
Azot w postaci związków chemicznych jest stosowany między innymi w produkcji nawozów sztucznych i materiałów wybuchowych.
Wybrane zastosowania azotu przedstawiono na poniższej mapie.
Z azotu otrzymuje się amoniak oraz tlenki azotu – związki o dużym znaczeniu przemysłowym. Za jedno z najważniejszych odkryć uważa się opracowanie metody otrzymywania amoniaku () z azotu atmosferycznego.
Dokonał tego, w przeddzień wojny światowej, Fritz HaberFritz Haber (niemiecki chemik pochodzenia żydowskiego), za co w otrzymał Nagrodę Nobla. Równanie reakcji, zachodzącej podczas syntezy amoniaku metodą opracowaną przez Habera, ma postać:
gdzie: oznacza temperaturę, a – katalizator.
Gazowy azot stanowi atmosferę ochronną w opakowaniach artykułów spożywczych i farmaceutycznych. Sprężonego azotu używa się do rozpylania cieczy, np. w dezodorantach. W postaci związków chemicznych jest stosowany w produkcji nawozów sztucznych i materiałów wybuchowych.
Członkowie Koła Naukowego „Skrzyneczka” z Wydziału Mechaniczno‑Energetycznego Politechniki Wrocławskiej skonstruowali, na bazie samochodu typu Fiata , pojazd napędzany ciekłym azotem. Nie wydziela on żadnych spalin i może osiągać prędkość . Jednak, między innymi ze względu na koszty, nie rozpowszechniono produkcji wspomnianego pojazdu na skalę przemysłową.

Tlenek azotu(), o wzorze sumarycznym , to związek chemiczny, który został odkryty, podobnie jak tlen, w przez Josepha Priestleya. Jednak dopiero w zauważono, że związek ten powstaje fizjologicznie w komórkach śródbłonka, a niektóre leki (nitrogliceryna i pokrewne leki nasercowe) powodują jego dodatkowe wytwarzanie w organizmie.
Szczególne zainteresowanie tym związkiem chemicznym nastąpiło w chwili, gdy okazało się, że tlenek ten wywołuje rozszerzenie naczyń krwionośnych. W prestiżowy magazyn Science uznał tlenek azotu() za „cząsteczkę roku”, a liczba publikacji naukowych na jego temat znacząco wzrosła.
Za badania nad tlenkiem azotu() Nagrodę Nobla (w ) w dziedzinie fizjologii i medycyny otrzymali Robert Furchgott, Louis Ignarro i Ferid Murad (czyt. Robert Ferczgot, Luis Ignaro, Ferid Mjurad).

Odkrycie funkcji tlenku azotu() w organizmie jest uważane za jedno z najważniejszych we współczesnej medycynie, gdzie znany jest on pod skrótem .
Jest to związek chemiczny odpowiedzialny między innymi za funkcjonowanie układu krążenia (reguluje przepływ i ciśnienie krwi, bierze także udział w krzepnięciu krwi).
Tlenek azotu() oprócz wspomnianej zdolności rozszerzania naczyń krwionośnych, rozszerza również oskrzela, w związku z czym zaleca się jego podawanie pacjentom z ostrą niewydolnością płuc. Odpowiednio duże stężenie tlenku azotu() zwiększa wysycenie krwi tlenem, a także niszczy bakterie i wirusy.
Jednym z wirusów, który może zostać zniszczony przez tlenek azotu(), jest wirus , wywołujący ostrą, zakaźną chorobę układu oddechowego – (ang. coronavirus disease ). Działanie tlenku azotu() w leczeniu polega między innymi na utrudnianiu przyłączania się wirusa do odpowiednich receptorów w komórkach nabłonka układu oddechowego i naczyń krwionośnych i zmniejszaniu stężenia wspomnianego wirusa w drogach oddechowych. Obecny w drogach oddechowych tlenek azotu(), pobudza również ruchy obecnych w nim rzęsek i stymuluje produkcję śluzu, wspomagając jednocześnie oczyszczanie zainfekowanych już obszarów. Firmy farmaceutyczne proponują zastosowanie tlenku azotu() w zapobieganiu i leczeniu , w postaci sprayu do nosa.
Obecnie, bada się również na dużą skalę znaczenie tlenku azotu() między innymi w zwalczaniu chorób nowotworowych.
Niedobór tlenku azotu() odnotowuje się w licznych schorzeniach układów: sercowo‑naczyniowego, żołądkowo‑jelitowego, moczowo‑płciowego oraz oddechowego.
Podsumowanie
Azot jest głównym składnikiem powietrza, stanowiącym jego objętości.
Azot jest niemetalem położonym w grupie i okresie układu okresowego. Pierwiastek ten jest przedstawicielem grupy tak zwanych azotowców.
Azot jest bezbarwnym i bezwonnym gazem. Jest niepalny i nie podtrzymuje spalania. Bardzo słabo rozpuszcza się w wodzie.
Azot znalazł zastosowanie w wielu gałęziach przemysłu i w medycynie.
Słownik
(łac. sal petri – sól skalna) związki chemiczne o znaczeniu gospodarczym, stosowane między innymi w rolnictwie i ogrodnictwie jako nawozy sztuczne; wykorzystuje się je również między innymi do produkcji materiałów wybuchowych, a niektóre z nich, również do konserwowania produktów spożywczych (głównie mięs); najbardziej znanymi saletrami są saletra sodowa (azotan() sodu, nazwa handlowa – saletra chilijska) o wzorze sumarycznym , saletra potasowa (azotan() potasu, nazwa handlowa – saletra indyjska) o wzorze sumarycznym , saletra wapniowa (azotan() wapnia, nazwa handlowa – saletra norweska) o wzorze sumarycznym oraz saletra amonowa (azotan() amonu) o wzorze sumarycznym
inaczej choroba dekompresyjna, nazywana często „chorobą nurków”; jest to zespół różnych, niekorzystnych dla zdrowia objawów związanych z gwałtowną zmianą ciśnienia otoczenia; objawy te dotyczą mięśni, stawów i skóry, a także układu nerwowego i ucha środkowego
(łac. destillatio „ściekanie kroplami”) metoda rozdziału mieszanin ciekłych, w której wykorzystuje się różnice w temperaturach wrzenia ich składników

Daniel Rutherford
Szkocki chemik i fizyk, lekarz. W dokonał odkrycia azotu i jako pierwszy „wyizolował” ten gaz z powietrza. Zajmował się również analizą budowy cząsteczki tlenu.

Karol Olszewski
Polski fizyk i chemik, związany naukowo z Uniwersytetem Jagiellońskim. Wraz z Zygmuntem Wróblewskim zajmował się kriogeniką (badaniami właściwości substancji w bardzo niskich temperaturach). Obydwu uczonym udało się jako pierwszym na świecie skroplić powietrze, tlen, azot oraz tlenek węgla(). Jako pierwszy w Polsce wykonał zdjęcie rentgenowskie w ().

Fritz Haber
Niemiecki chemik pochodzenia żydowskiego. Laureat Nagrody Nobla w dziedzinie chemii () za opracowanie metody syntezy amoniaku z azotu i wodoru

Zygmunt Wróblewski
Polski fizyk. Profesor Uniwersytetu Jagiellońskiego. Wraz z Karolem Olszewskim zajmował się kriogeniką (badaniami właściwości substancji w bardzo niskich temperaturach). Obydwu uczonym udało się jako pierwszym na świecie skroplić powietrze, tlen, azot oraz tlenek węgla().