Na zakończenie - sprawdź, czy umiesz
Wokół atomu tlenu gromadzi się cząstkowy ładunek 1. ujemny, 2. dodatnie, 3. ujemne, 4. dodatni.
Poniżej przedstawiono pewną definicję.
Jest to zjawisko łączenia się drobin (cząsteczek, jonów, atomów) w większe układy, złożone z dwóch lub większej liczby cząstek w wyniku oddziaływań międzycząsteczkowych.
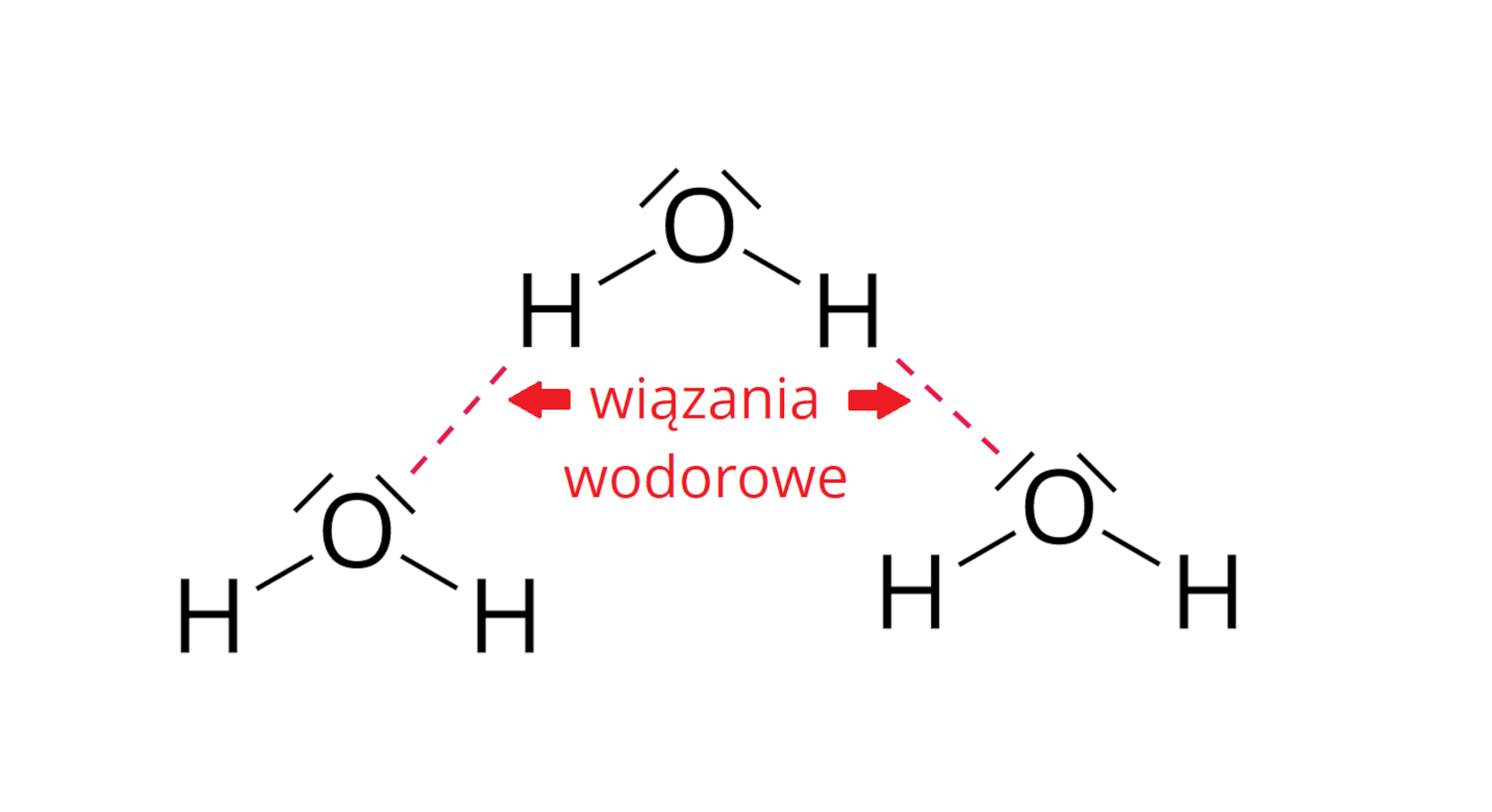
Jednym z rodzajów oddziaływań pomiędzy cząsteczkami wody są wiązania wodorowe, które wpływają na jej wysoką temperaturę wrzenia. Należy bowiem dostarczyć więcej energii, aby zerwane zostały oddziaływania międzycząsteczkowe i doszło do zmiany stanu skupienia. Na poniższym schemacie przedstawiono wzory elektronowe kilku cząsteczek wody. Zaznacz wiązania wodorowe powstające pomiędzy nimi.
Przeanalizuj poniższą mapę pojęć, która podsumowuje wiadomości dotyczące wody i jej roztworów. Sprawdź, czy wszystkie treści są dla Ciebie jasne. Jeżeli uważasz, że na tej mapie powinny znaleźć się jakieś informacje, które nie zostały uwzględnione, dokonaj rozbuduowy mapy.
Na mapie myśli przedstawiono charakterystykę wody i roztworów wodnych. Od głównego węzła odchodzi pięć kolejnych węzłów. Pierwszy z nich, oznaczony kolorem pomarańczowym, opisuje proces rozpuszczania. Dalej dzieli się on na obliczenia związane z rozpuszczalnością i obliczenia związane ze stężeniem procentowym. Rozpuszczalnością nazywamy maksymalną ilość substancji, jaka może rozpuścić się w stu gramach rozpuszczalnika w danej temperaturze i pod stałym ciśnieniem. Wzór na obliczenie rozpuszczalności to:
Stężeniem procentowym nazywamy ilość substancji znajdującej się w stu gramach roztworu. Wzór na stężenie procentowe to:
gdzie to masa substancji rozpuszczonej, a to masa roztworu.
Należy pamiętać, że masa roztworu to suma masy substancji rozpuszczonej oraz masy rozpuszczalnika:
Kolejny węzeł, oznaczony kolorem kremowym, opisuje mieszaniny. Wyróżnia się podział ze względu na ilość substancji rozpuszczonej i podział ze względu na wielkość drobin substancji rozpuszczonej. W przypadku podziału ze względu na ilość substancji rozpuszczonej wyróżnia się roztwory nasycone i roztwory nienasycone. Roztwór nasycony zawiera maksymalną ilość substancji jaka może się rozpuścić w określonej masie rozpuszczalnika w danej temperaturze. Oznacza to, że w tej temperaturze nie jesteśmy w stanie rozpuścić więcej substancji. W przypadku gazów duże znaczenie ma również ciśnienie. Wraz ze wzrostem ciśnienia, rozpuszczalność gazów w cieczach rośnie. Roztwór nienasycony zawiera mniejszą niż maksymalna ilość substancji jaka może się rozpuścić w określonej masie rozpuszczalnika w danej temperaturze. W roztworze nienasyconym można zatem rozpuścić dodatkowe porcje substancji rozpuszczonej aż do uzyskania roztworu nasyconego. W przypadku podziału ze względu na wielkość drobin substancji rozpuszczonej wyróżnia się mieszaniny jednorodne i mieszaniny niejednorodne. Mieszanina jednorodna to roztwór właściwy. W roztworach właściwych wielkość zmieszanych ze sobą cząstek substancji chemicznych jest mniejsza niż jeden nanometr (jeden nanometr to dziesięć do potęgi minus dziewiątej metra). Roztwory właściwe stanowią mieszaniny jednorodne, czyli takie, których składników nie można rozróżnić gołym okiem lub za pomocą prostych przyrządów optycznych. Przykładami roztworów właściwych są: ocet (czyli dziesięcioprocentowy (w procentach masowych) roztwór kwasu octowego w wodzie), mieszanina wody z cukrem, z solą kuchenną czy z sokiem malinowym. Mieszaniny niejednorodne dzielą się na koloidy i zawiesiny. W roztworach koloidalnych wielkość zmieszanych ze sobą cząstek substancji chemicznych mieści się w przedziale od jednego do stu nanometrów (od dziesięciu do potęgi minus dziewiątej metra do dziesięciu do potęgi minus siódmej metra). Do roztworów koloidalnych zaliczamy między innymi roztwór białka jaja kurzego, mieszaninę wody z żelatyną, mleko, kleik skrobiowy czy mgłę. W zawiesinach wielkość zmieszanych ze sobą cząstek substancji chemicznych jest większa niż sto nanometrów (dziesięć do potęgi minus siódmej metra). Składniki zawiesin bardzo często jesteśmy w stanie rozróżnić za pomocą zmysłu wzroku lub prostych przyrządów optycznych. Do zawiesin zaliczamy np: mieszaninę wody z piaskiem czy kredą, ale również mieszaninę wody z benzyną czy oliwą. Kolejny węzeł, oznaczony kolorem czerwonym, opisuje obieg wody w przyrodzie. Woda na Ziemi jest w ciągłym ruchu i zmienia swoje formy, od stanu gazowego, poprzez ciekły do stanu stałego i odwrotnie. Obieg wody trwa od miliardów lat i wszystkie organizmy żywe są od niego zależne. Zamieszczono schemat opisujący obieg wody w przyrodzie: przemiana ciała stałego w gaz to sublimacja, przemiana gazu w ciało stałe to resublimacja. Przemiana ciała stałego w ciecz to topnienie, a przemiana cieczy w ciało stałe to krzepnięcie, Przemiana gazu w ciecz to skraplanie, a przemiana cieczy w gaz to wrzenie, parowanie. Następny węzeł, oznaczony kolorem zielonym, opisuje budowę cząsteczki wody. Cząsteczka wody składa się z jednego atomu tlenu oraz dwóch atomów wodoru. Pomiędzy atomami występują wiązania kowalencyjne spolaryzowane, a wspólne pary elektronowe przesunięte są w stronę atomu tlenu (co zaznacza się grotem zlokalizowanym na wiązaniu). Zamieszczono ilustrację, na której ukazano budowę cząsteczki wody: atom tlenu O połączony jest wiązaniami pojedynczymi z dwoma atomami wodoru. Na wiązaniach znajdują się groty strzałek zwrócone w stronę atomu tlenu, opisane jako: polaryzacja wiązania. Nad atomami wodoru znajdują się symbole delta z plusem w indeksie górnym, opisane jako cząstkowy ładunek dodatni. Nad atomem tlenu znajduja się dwie ukośne kreski opisane jako wolne pary elektronowe oraz zapis dwa symbol delta i plus w indeksie górnym opisane jako cząstkowy ładunek ujemny. Koniec opisu ilustracji. Wokół atomu tlenu gromadzi się cząstkowy ładunek ujemny (zatem ta część cząsteczki stanowi jej biegun ujemny), a wokół atomów wodoru gromadzi się cząstkowy ładunek dodatni (część cząsteczki wody od strony atomów wodoru stanowi zatem jej biegun dodatni). Cząsteczka wody ma budowę polarną. Mówimy, że woda jest dipolem (ma niezerowy moment dipolowy), czyli cząsteczką dwubiegunową. Zamieszczono grafikę ukazującą szary owal, wewnątrz którego z lewej strony znajduje się symbol plus, a z prawej strony – symbol minus. Pod spodem znajduje się podpis: symboliczny zapis dipola. Koniec opisu ilustracji. Z węzłem opisującym budowę cząsteczki wody łączy się kolejny węzeł opisujący asocjację.W przypadku cząsteczek wody – atom wodoru jednej cząsteczki może oddziaływać z atomem tlenu drugiej cząsteczki, ponieważ ładunki różnoimienne (dodatni i ujemny) wzajemnie się przyciągają. Są to oddziaływania typu dipol–dipol. Innym rodzajem oddziaływań pomiędzy cząsteczkami wody są wiązania wodorowe, polegające na przesunięciu gęstości elektronowej z silnie elektroujemnego atomu tlenu na atom wodoru, ubogi w elektrony (na skutek jego związania z atomem tlenu i silnej polaryzacji wiązania w kierunku atomu tlenu). Wiązania wodorowe zaznacza się przerywaną kreską (lub kropkami) od atomu wodoru jednej cząsteczki wody do wolnej pary elektronowej atomu tlenu drugiej cząsteczki wody. Zamieszczono ilustrację ukazującą trójwymiarowy model cząsteczki wody składający się z dużej czerwonej kulki z symbolem O i dwóch mniejszych przyłączonych do niej białych kulek z symbolami H. Przy atomach wodoru znajdują się symbole delta plus, od których odchodzą wiązania do symboli delta minus znajdujących się przy atomach tlenu innych cząsteczek. przy atomie tlenu znajdują się dwa symbole delta minus, od których odchodzą wiązania do symboli delta plus znajdujących się przy atomach wodoru innych cząsteczek. Pod spodem znajduje się podpis: wiązania wodorowe. Ostatni węzeł, również oznaczony kolorem zielonym, opisuje właściwości fizyczne wody. Od niego odchodzą dwa wiązania. Pierwsze prowadzi do pytania: Czy woda wrze zawsze w temperaturze stu stopni Celsjusza? Czy wiesz, że woda na szczytach najwyższych gór świata wrze w temperaturze niższej niż sto stopni Celsjusza? Na przykład na szczycie Mount Everest (osiem tysięcy osiemset czterdzieści osiem metrów nad poziomem morza) woda wrze w temperaturze około sześćdziesięciu ośmiu stopni Celsjusza. Wynika to ze spadku ciśnienia wraz ze wzrostem wysokości. Każde osiem metrów w górę wiąże się ze spadkiem ciśnienia o około jeden hektopaskal. Na szczycie Mount Everest ciśnienie wynosi zaledwie trzysta czternaście hektopaskali. Temperatura wrzenia substancji ściśle zależy od ciśnienia – im niższe ciśnienie, tym niższa temperatura wrzenia. Drugie pytanie to: Dlaczego lód pływa po wodzie? Właściwości fizyczne wody wynikają z jej polarnej budowy. W większości ciał stałych drobiny znajdują się bliżej siebie niż w ciekłym stanie skupienia. Wynika z tego, że substancje w stanie stałym skupienia charakteryzują się większą gęstością niż w stanie ciekłym. Jednak w przypadku wody jest odwrotnie. Cząsteczki oddziałują ze sobą za pomocą wiązań wodorowych i w fazie stałej tworzą struktury, które pozostawiają dużo wolnej przestrzeni, przez co odległości między cząsteczkami są większe w lodzie niż w wodzie ciekłej. Z tego powodu lód ma mniejszą gęstość niż woda ciekła. Woda charakteryzuje się największą gęstością w temperaturze równej cztery stopnie Celsjusza. Dzięki temu organizmy wodne mogą przetrwać w okresie zimowym, kiedy warstwy lodu pokrywają powierzchnie zbiorników wodnych. Skutkiem oddziaływań wodorowych pomiędzy cząsteczkami wody jest również wzrost jej objętości podczas zamarzania. Woda zwiększa wówczas swoją objętość aż o około dziesięć procent.