Jakie właściwości i zastosowanie mają wodorotlenki?
Czy właściwości decydują o zastosowaniu wodorotlenków? Jedne z nich są stosowane m.in. do bielenia pni drzew, a inne wchodzą w skład środków do udrożniania rur. Wodorotlenki są też składnikami leków na nadkwasotę i past do zębów. Jakie środki ostrożności należy zachować podczas pracy z niektórymi z nich?
Właściwości wodorotlenków
Przeprowadź doświadczenie chemiczne, które będzie polegać na zbadaniu właściwości wodorotlenku sodu i wodorotlenku potasu.

Problem badawczy:
Jakie charakterystyczne właściwości mają wodorotlenek sodu i wodorotlenek potasu?
Hipoteza:
Wodorotlenki sodu i potasu rozpuszczają się w wodzie oraz są substancjami żrącymi.
Co było potrzebne:
wodorotlenek potasu;
wodorotlenek sodu;
woda;
bibuła;
tkanina;
drewno;
pęseta;
dwie probówki;
dwie pipety;
dwa pręciki szklane;
trzy połówki szalki Petriego.
Przebieg doświadczenia:
Wodorotlenek sodu i wodorotlenek potasu to substancje stałe o barwie białej. Na pierwszą połówkę szalki Petriego nasypano niewielką ilość wodorotlenku sodu, a na drugą wodorotlenku potasu. Próbki pozostawiono na minut. Po tym czasie odnotowano zachodzące zmiany – substancje zaczęły się „rozpływać”.
W probówkach umieszczono parę granulek – w pierwszej wodorotlenku sodu, a w drugiej wodorotlenku potasu. Do obu dodano niewielką ilość wody. Zawartość probówek wymieszano za pomocą pręcików szklanych. W efekcie substancje stałe rozpuściły się, tworząc klarowne, bezbarwne roztwory. Następnie ostrożnie dotknięto zewnętrznych ścianek probówek i zauważono, że stają się ciepłe. Na koniec, za pomocą pręcików szklanych, naniesiono niewielkie ilości obu roztworów na bibułę, tkaninę i drewno, umieszczone na szalkach Petriego. Wszystkie materiały poddane działaniu roztworów uległy zniszczeniu.
Naczyniem laboratoryjnym, które służy m.in. do przechowywania substancji higroskopijnych, jest eksykator. Jego pokrywa jest wykonana z grubego szkła lub tworzywa sztucznego i ściśle przylega do pojemnika, w którym znajduje się substancja osuszająca (np. wodorotlenek potasu). Niektóre eksykatory są wyposażone w kran, pozwalający na usunięcie powietrza.

Problem badawczy:
Jakie charakterystyczne właściwości mają wodorotlenek wapnia i wodorotlenek żelaza?
Hipoteza:
Wodorotlenek wapnia i wodorotlenek żelaza to substancje stałe, które różnią się rozpuszczalnością w wodzie oraz barwą.
Co było potrzebne:
wodorotlenek wapnia;
10‑procentowy wodny roztwór wodorotlenku sodu;
5‑procentowy wodny roztwór chlorku żelaza;
woda;
dwa pręciki szklane;
dwie probówki;
łyżeczka.
Przebieg doświadczenia:
Wodorotlenek wapnia to substancja stała o białej barwie. W pierwszej probówce umieszczono jej niewielką ilość, a następnie dodano wody i zamieszano za pomocą pręcika szklanego. W efekcie uległa rozpuszczeniu – powstał klarowny roztwór. W drugiej probówce umieszczono wodnego roztworu wodorotlenku sodu, a następnie dodano wodnego roztworu chlorku żelaza. Zawartość probówki zamieszano za pomocą pręcika szklanego. W ten sposób został strącony wodorotlenek żelaza w postaci czerwonobrunatnego osadu. Do probówki dodano wody, a zawartość zamieszano za pomocą pręcika szklanego – jednak osad nie uległ rozpuszczeniu.
Przeprowadź doświadczenie chemiczne, które będzie polegać na zbadaniu właściwości wodorotlenku wapnia i wodorotlenku żelaza.
Wodorotlenki są substancjami stałymi, które mogą przyjmować wiele barw. Wodorotlenki sodu i potasu oraz innych pierwiastków z pierwszej grupy układu okresowego pierwiastków są bardzo dobrze rozpuszczalne w wodzie. Z kolei rozpuszczalność wodorotlenków drugiej grupy wzrasta ze wzrostem liczby atomowej berylowca, a wodorotlenki pozostałych metali są praktycznie nierozpuszczalne w wodzie. Korzystając z tabeli rozpuszczalności wodorotlenków, można sprawdzić, które rozpuszczają się w wodzie, a które wytrącają się w postaci osadów, czyli są praktycznie nierozpuszczalne w wodzie.

Stężone roztwory wodorotlenków sodu, potasu (zwane dawniej ługami) oraz wapnia mają właściwości żrące – niszczą bibułę. Podobnie działają na skórę – mogą wywoływać silne poparzenia. Stopiony wodorotlenek sodu uszkadza (trawi) szkło, dlatego przechowuje się go w opakowaniach z tworzyw sztucznych.
Zastosowanie wodorotlenków
Wodorotlenki sodu i potasu tworzą z tłuszczami związki rozpuszczalne w wodzie, dlatego stosuje się je jako składniki preparatów do udrożniania rur, a także do produkcji środków piorących. Wodorotlenek wapnia tworzy z wodą zawiesinę – mleko wapienne. Używa się jej do bielenia pni drzew owocowych oraz ścian budynków, ponieważ ma właściwości dezynfekcyjne, a kolor biały odbija znaczną część promieni słonecznych i zapobiega zbytniemu nagrzewaniu. Klarowny bezbarwny roztwór wodorotlenku wapnia nazywamy wodą wapienną, która służy do wykrywania tlenku węgla.
Film dostępny pod adresem /preview/resource/R19Jh2tzyDdVD
Film przedstawia zastosowania wybranych wodorotlenków takich jak: wodorotlenek glinu, wodorotlenek magnezu, wodorotlenek wapnia, wodorotlenek sodu, wodorotlenek potasu.
Zaprawa wapienna
Składnikiem budowlanej zaprawy wapiennej jest – oprócz piasku i wody – wapno gaszone, które powstaje w reakcji wapna palonego z wodą. Tak przygotowana mieszanina, o konsystencji gęstego ciasta, ma zdolność twardnienia dzięki reakcji chemicznej wodorotlenku wapnia z tlenkiem węgla z powietrza.
Zaprawa wapienna | |
przygotowanie | twardnienie |
|---|---|

Żrące właściwości preparatu do udrożniania rurDwuletni chłopiec, który połknął żrący preparat do czyszczenia rur kanalizacyjnych, czuje się już lepiej. Dziecko wciąż przebywa w szpitalu, ma poparzony przełyk i usta, ale po wybudzeniu ze śpiączki farmakologicznej oddycha samodzielnie. Lekarze są dobrej myśli, bo badania wykazały, że żrąca substancja poparzyła dziecku usta, język i część przełyku, lecz na szczęście do żołądka dostały się tylko śladowe ilości granulatu. W przełyku i żołądku zmiany są już nieduże i goją się pomyślnie. Jednak lekarze nadal nie wiedzą, kiedy i czy w ogóle chłopiec będzie mógł poruszać językiem, mówić lub rozróżniać smaki.
(TVN24)
Podsumowanie
Wodorotlenki są substancjami stałymi o różnej barwie.
Wodorotlenki sodu i potasu są substancjami silnie higroskopijnymi, mają podobne właściwości, są stosowane jako składniki do produkcji mydeł, środków piorących i preparatów do udrożniania rur.
Stężone roztwory wodorotlenków sodu, potasu oraz wapnia mają właściwości żrące.
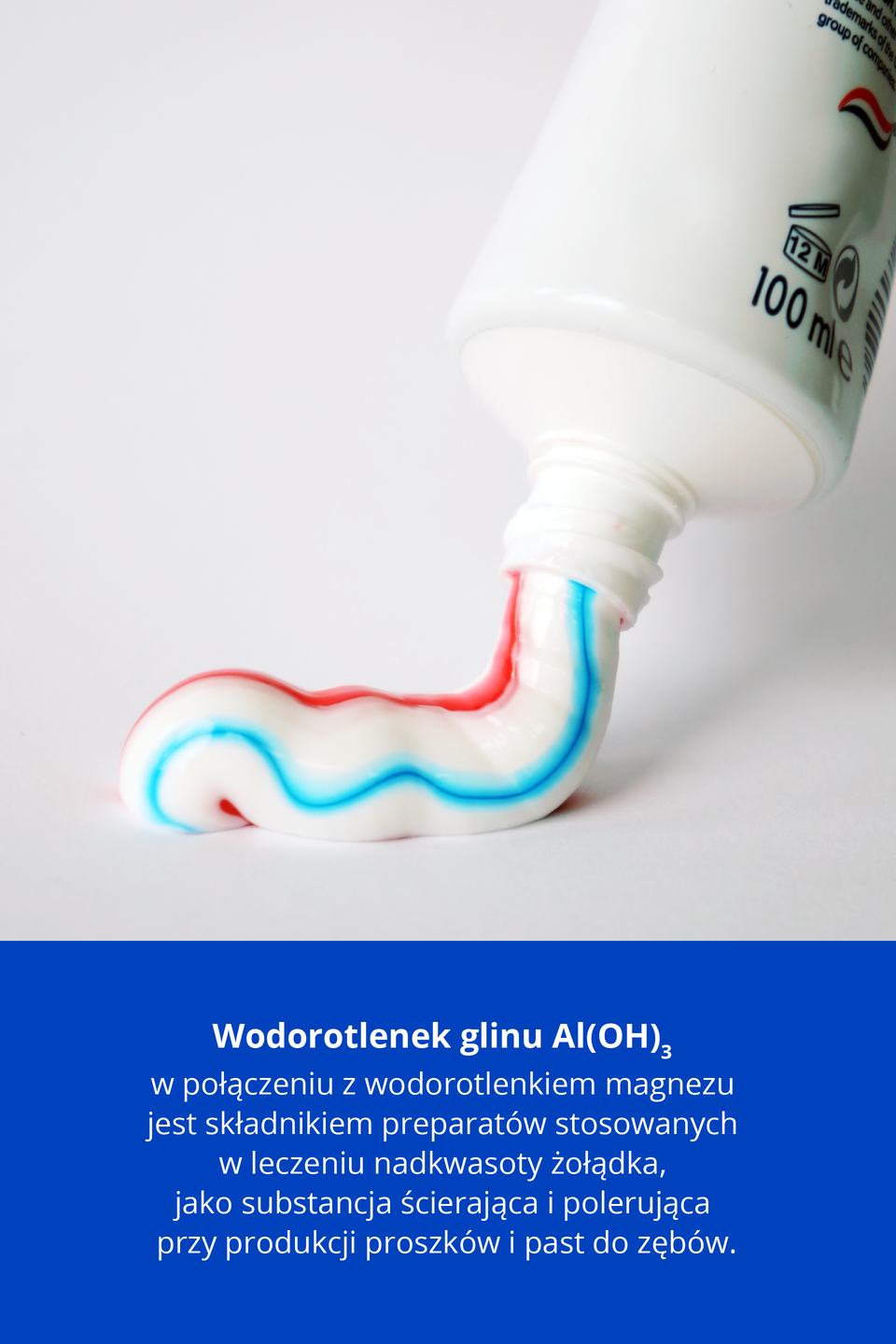
Wodorotlenki magnezu i glinu są m.in. składnikami leków, stosowanych w przypadku nadkwasoty żołądka.
Słownik
zdolność niektórych substancji do pochłaniania wilgoci (pary wodnej) z powietrza
zawiesina wodorotlenku wapnia w wodzie, stosowana do dezynfekcji pomieszczeń o dużych powierzchniach (piwnice, magazyny) do neutralizacji kwasów (np. w ratownictwie chemicznym)
wodorotlenek wapnia , stosowany w budownictwie jako składnik zaprawy wapiennej
tlenek wapnia (), stosowany m.in. w budownictwie jako składnik do przygotowania zaprawy murarskiej (wapiennej)