Ile jest związków węgla z wodorem? - Podsumowanie
Różne możliwości połączeń pomiędzy atomami węgla w cząsteczkach węglowodorów sprawiają, że substancje te stanowią bardzo liczną rodzinę związków organicznych. Spróbuj narysować wzory półstrukturalne możliwych węglowodorów, które zawierają w swoich cząsteczkach cztery atomy węgla. Ile różnych wzorów udało Ci się narysować? Czy jest ich siedem? A może więcej?
Węglowodory – budowa i klasyfikacja
Węglowodory to związki chemiczne zbudowane wyłącznie z atomów węgla i wodoru.
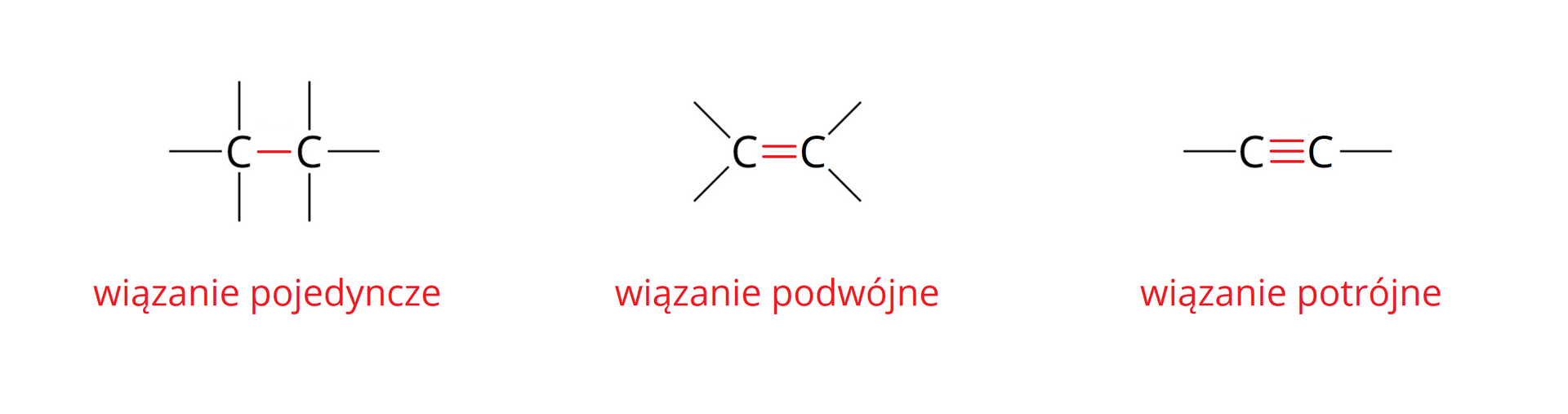
Atomy węgla w cząsteczkach węglowodorów są zawsze czterowartościowe i mogą łączyć się z innymi atomami węgla za pomocą wiązań pojedynczych, podwójnych oraz potrójnych.
Wiązanie pomiędzy atomem węgla i atomem wodoru jest zawsze wiązaniem pojedynczym (atomy wodoru są zawsze jednowartościowe).
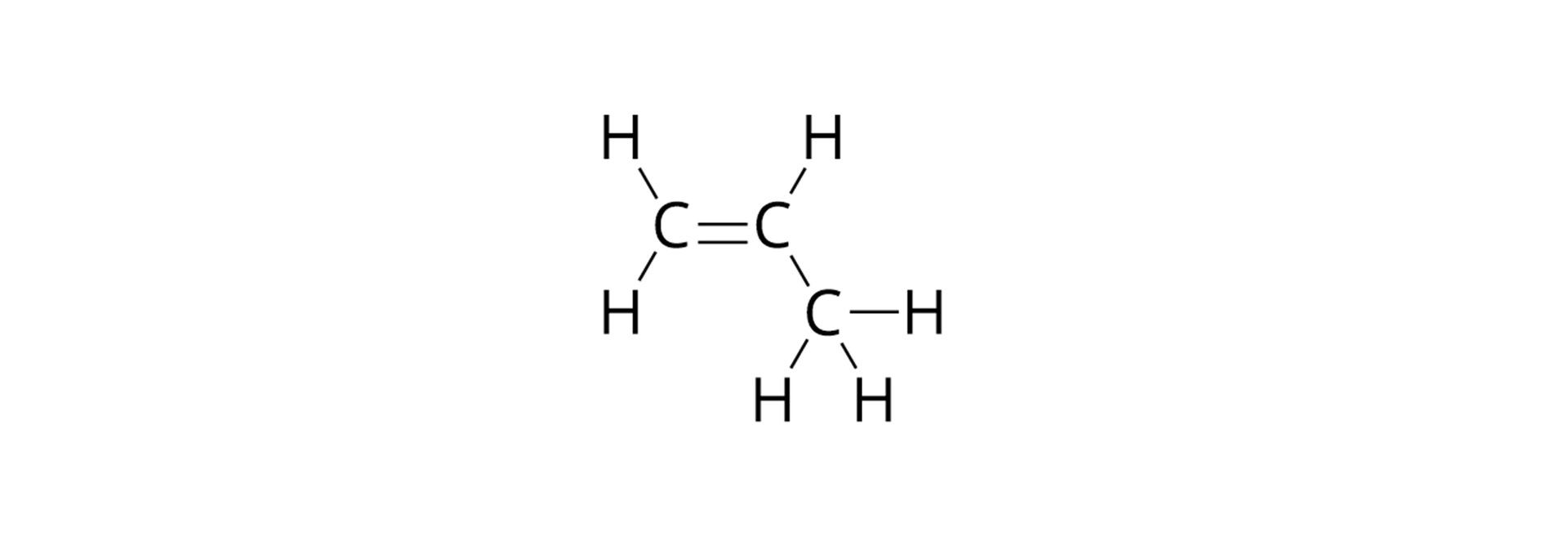
Jeżeli w cząsteczce węglowodoru, pomiędzy atomami węgla, występują wyłącznie wiązania pojedyncze, to węglowodór ten zaliczamy do węglowodorów nasyconych. Jeśli zaś występują wiązania wielokrotne (przynajmniej jedno wiązanie podwójne lub potrójne), to zaliczamy go do węglowodorów nienasyconych. Spośród poznanych już przez Ciebie związków organicznych, do grupy węglowodorów nasyconych należą alkany. Do węglowodorów nienasyconych zaliczamy z kolei alkeny i alkiny. W cząsteczce dowolnego alkenu występuje jedno podwójne wiązanie węgiel–węgiel, a pozostałe wiązania pomiędzy atomami węgla (o ile występują) to wiązania pojedyncze. Podobna sytuacja ma miejsce w alkinach, przy czym w cząsteczce dowolnego alkinu, zamiast wiązania podwójnego (jak w cząsteczkach alkenów) występuje jedno potrójne wiązanie węgiel–węgiel. Alkany, alkeny i alkiny tworzą szeregi homologiczne. Ogólne wzory sumaryczne tych szeregów przedstawiono w poniższej mapie myśli.
Mapa myśli przedstawia podział węglowodorów na nasycone oraz nienasycone. Węglowodory nasycone są to alkany i posiadają one wyłącznie pojedyncze wiązania węgiel–węgiel. Wzór ogólny szeregu homologicznego alkanów to . Węglowodory nasycone posiadają wiązania wielokrotne pomiędzy atomami węgla. Dzielą się one na te, które posiadają jedno podwójne wiązanie węgiel–węgiel, czyli alkeny o wzorze ogólnym szeregu homologicznego oraz na te, które posiadają jedno potrójne wiązanie węgiel–węgiel, czyli alkiny o wzorze ogólnym szeregu homologicznego .
Atomy węgla w cząsteczkach związków chemicznych należących do alkanów, alkenów i alkinów, połączone są w proste (nierozgałęzione) lub rozgałęzione łańcuchy.
Budowę cząsteczek węglowodorów można opisywać za pomocą różnych wzorów chemicznych: sumarycznych, strukturalnych oraz półstrukturalnych. W poniższej tabeli zaprezentowano możliwe wzory chemiczne węglowodorów, które zawierają po dwa atomy węgla w cząsteczkach.
Nazwa szeregu | Nazwa węglowodoru | Wzór sumaryczny | Wzór strukturalny | Wzór półstrukturalny |
|---|---|---|---|---|
Alkany | etan | 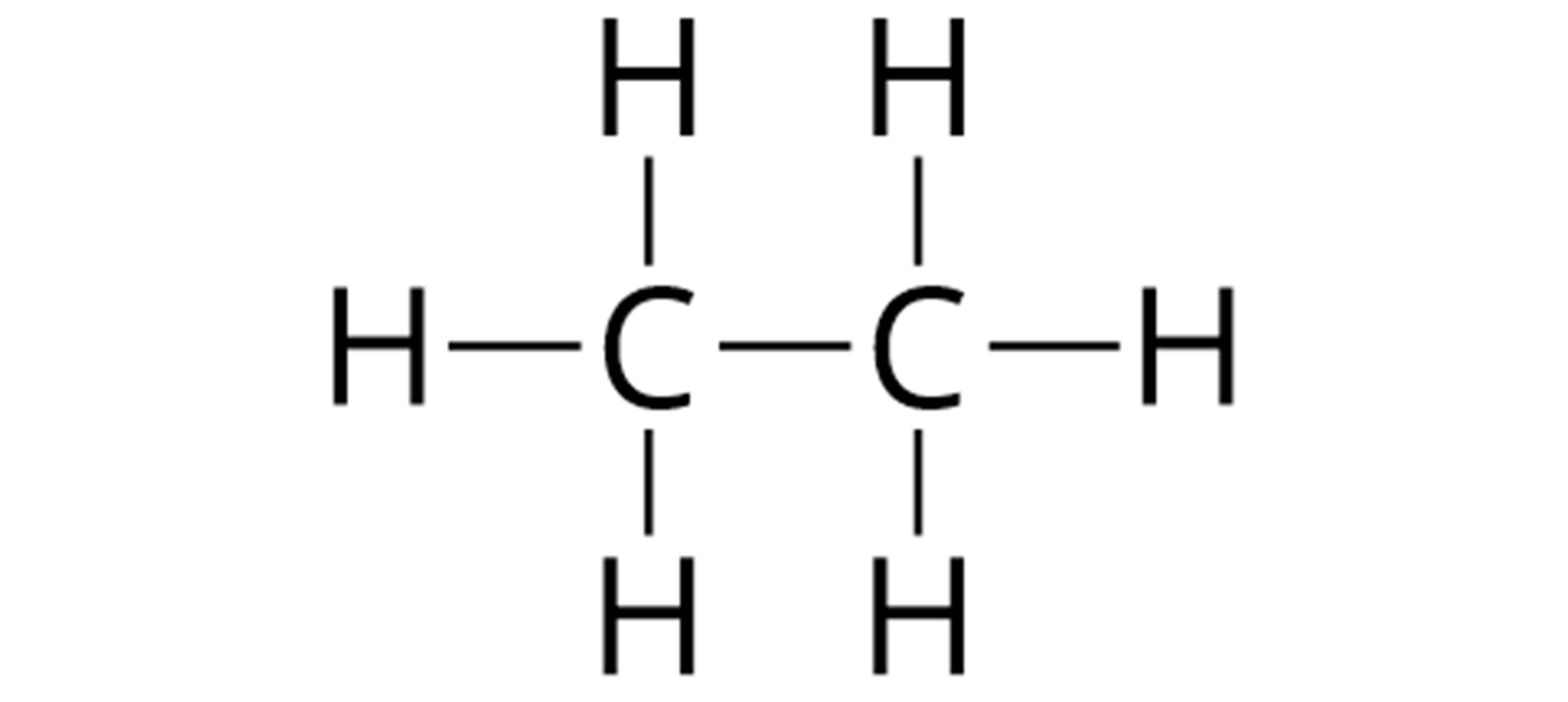 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | ||
Alkeny | eten | 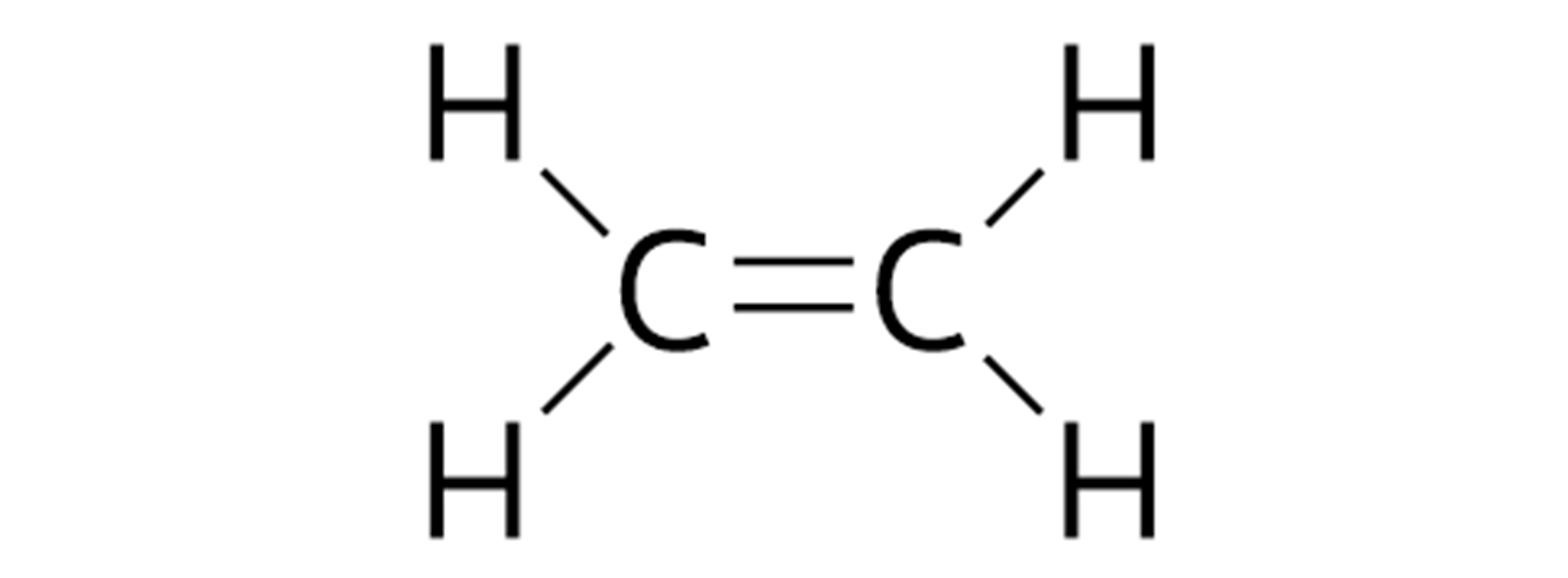 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | ||
Alkiny | etyn | 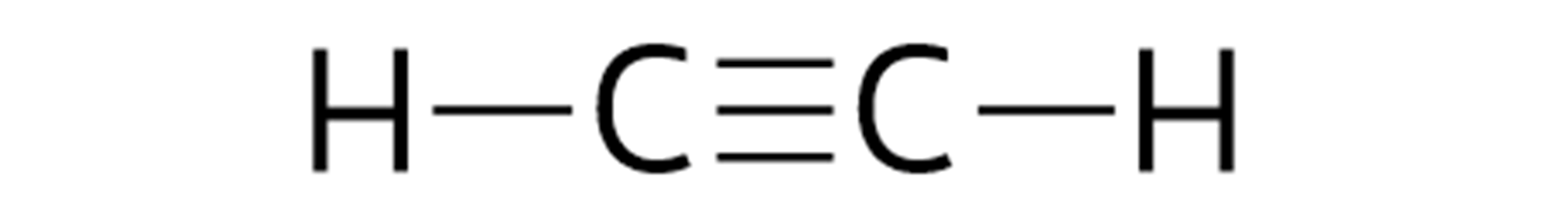 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |
Indeks górny Źródło: John McMurry, Chemia organiczna, Tom I, 2000. Indeks górny koniecŹródło: John McMurry, Chemia organiczna, Tom I, 2000.
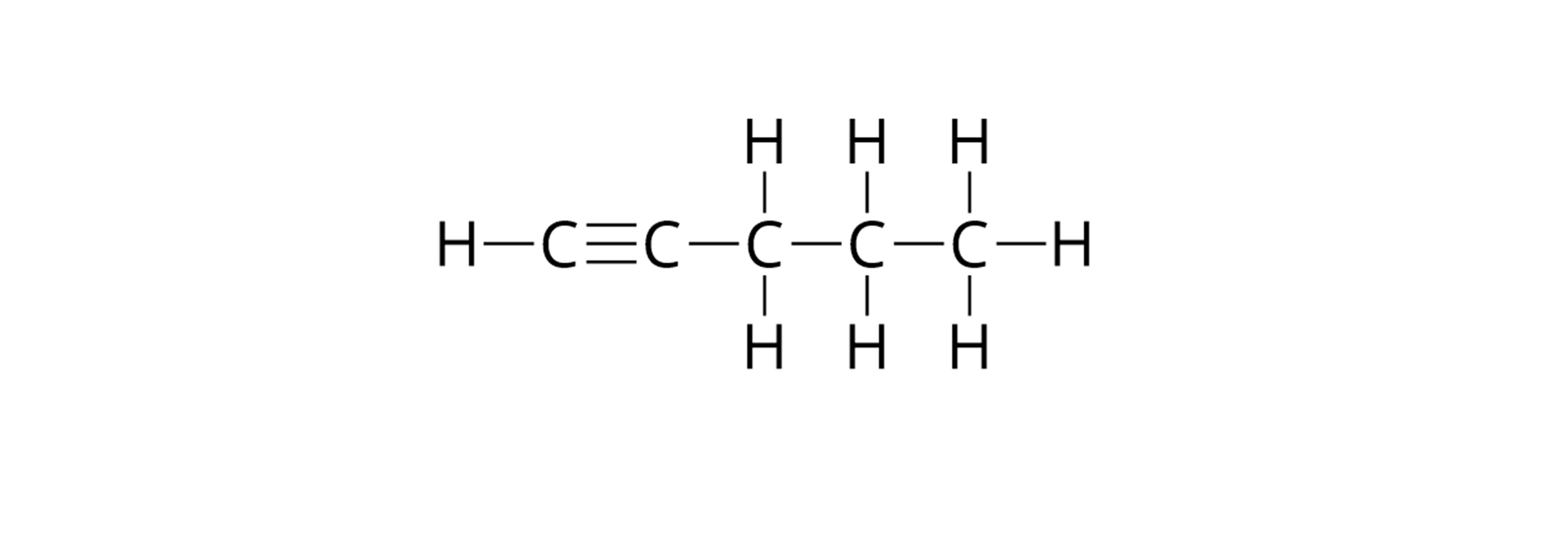
Narysuj wzory strukturalne oraz półstrukturalne cząsteczek opisanych poniżej węglowodorów. Załóż, że w cząsteczkach każdego z analizowanych węglowodorów, atomy węgla połączone są w prosty (nierozgałęziony łańcuch), a w przypadku węglowodorów nienasyconych, wiązanie wielokrotne znajduje się pomiędzy pierwszym i drugim atomem węgla w cząsteczce.
alken, w którego cząsteczce znajdują się trzy atomy węgla;
alkan, w którego cząsteczce znajduje się atomów wodoru;
alkin, w którego cząsteczce znajduje się osiem atomów wodoru, a wiązanie wielokrotne położone jest pomiędzy pierwszym a drugim atomem węgla w łańcuchu.
Napisz nazwy cząsteczek opisanych poniżej węglowodorów.
alken, w którego cząsteczce znajdują się trzy atomy węgla;
alkan, w którego cząsteczce znajduje się atomów wodoru;
alkin, w którego cząsteczce znajduje się osiem atomów wodoru.
Oblicz skład procentowy (w procentach masowych) alkinu, zawartego w atomach węgla w cząsteczce. Wyniki podaj z dokładnością do pierwszego miejsca po przecinku.
Masa cząsteczkowa pewnego węglowodoru wynosi . Wiedząc, że węgiel stanowi masowych cząsteczki analizowanego związku chemicznego, ustal jego wzór sumaryczny. Następnie określ, do jakiego szeregu homologicznego należy rozpatrywany węglowodór.
Masa cząsteczkowa pewnego węglowodoru wynosi . Wiedząc, że węgiel stanowi masowych cząsteczki analizowanego związku chemicznego, ustal jego wzór sumaryczny. Następnie określ, do jakiego szeregu homologicznego należy rozpatrywany węglowodór.
Masa cząsteczkowa pewnego alkinu wynosi . Na podstawie odpowiednich obliczeń, wyznacz wzór sumaryczny tego alkinu.
Węglowodory – nazewnictwo
Uwaga: Na tym etapie nauki rozpatrujemy nazwy węglowodorów, których cząsteczki zbudowane są z prostych (nierozgałęzionych) łańcuchów węglowych. Nazwy węglowodorów o innej budowie łańcucha (szkieletu) węglowego poznasz na dalszych etapach kształcenia.
Nazwy czterech pierwszych związków w szeregu homologicznym alkanów to: , , i , a począwszy od alkanu, który zawiera pięć atomów węgla w cząsteczce (łańcuch nierozgałęziony), nazwy alkanów tworzymy rozpoczynając od greckich liczebników (kolejno: penta–, heksa–, hepta–, okta–, nona–, deka–).
Nazwy alkenów tworzymy zamieniając przyrostek w nazwie alkanu (o takiej samej liczbie atomów węgla w cząsteczce) na przyrostek . Z kolei tworząc nazwy alkinów zamieniamy przyrostek w nazwie alkanu (o takiej samej liczbie atomów węgla w cząsteczce) na przyrostek . W przypadku nierozgałęzionych cząsteczek alkenów i alkinów, utworzonych z co najmniej czterech atomów węgla, przed odpowiednimi przyrostkami podajemy (tak zwany ), czyli numer atomu węgla, przy którym wiązanie to ma swój początek.
Atomy węgla w cząsteczce alkenu lub alkinu (o prostym (nierozgałęzionym) łańcuchu węglowym) numerujemy, rozpoczynając od jednego ze skrajnych atomów węgla w taki sposób, aby wiązanie podwójne znajdowało się jak najbliżej pierwszego atomu węgla (aby miało jak najniższy lokant).
W poniższej tabeli zestawiono wzory półstrukturalne wybranych węglowodorów oraz ich nazwy.
Szereg homologiczny | Wzór półstrukturalny węglowodoru | Nazwa węglowodoru |
|---|---|---|
Alkany | ||
Alkeny | ||
Alkiny | ||
Indeks górny Źródło: John McMurry, Chemia organiczna, Tom I, 2000. Indeks górny koniecŹródło: John McMurry, Chemia organiczna, Tom I, 2000.
propan — 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8.
propyn — 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8.
heks——en — 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8.
but——en — 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8.
heksan — 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8.
Węglowodory – właściwości fizyczne
Węglowodory mogą występować w różnych stanach skupienia, w zależności od liczby atomów węgla zawartych w ich cząsteczkach. W poniższej tabeli znajdują się informacje dotyczące stanu skupienia węglowodorów, których cząsteczki zbudowane są z prostych (nierozgałęzionych) łańcuchów węglowych. Dane dla temperatury i ciśnienia .
GAZY | CIECZE | CIAŁA STAŁE | |
|---|---|---|---|
Alkany | do atomów węgla | od do atomów węgla | od atomów węgla |
Alkeny | od do atomów węgla | od atomów węgla | |
Alkiny | od do atomów węgla | od atomów węgla |
Indeks górny Źródło: John McMurry, Chemia organiczna, Tom I, 2000. Indeks górny koniecŹródło: John McMurry, Chemia organiczna, Tom I, 2000.
Jednym z kryteriów rozpuszczalności substancji w określonych rozpuszczalnikach jest podobieństwo budowy analizowanej pary substancja rozpuszczana–rozpuszczalnik. Podobne bowiem dobrze rozpuszcza się w podobnym. Oznacza to, że substancje polarne dobrze rozpuszczają się w rozpuszczalnikach polarnych, a substancje niepolarne w rozpuszczalnikach niepolarnych. Cząsteczki węglowodorów mają niepolarną budowę (różnica elektroujemności pomiędzy atomem węgla i wodoru jest nieznaczna – wynosi w skali Paulinga). W związku z tym węglowodory (niezależnie od szeregu homologicznego) są praktycznie nierozpuszczalne w polarnym rozpuszczalniku, jakim jest woda.
Niektóre właściwości fizyczne węglowodorów, o prostych (nierozgałęzionych) łańcuchach węglowych, zmieniają się odpowiednio w szeregach homologicznych wraz ze wzrostem liczby atomów węgla w cząsteczkach. Ogólne zmiany wybranych właściwości fizycznych węglowodorów, w zależności od liczby atomów węgla w cząsteczkach, zilustrowano na poniższej grafice.
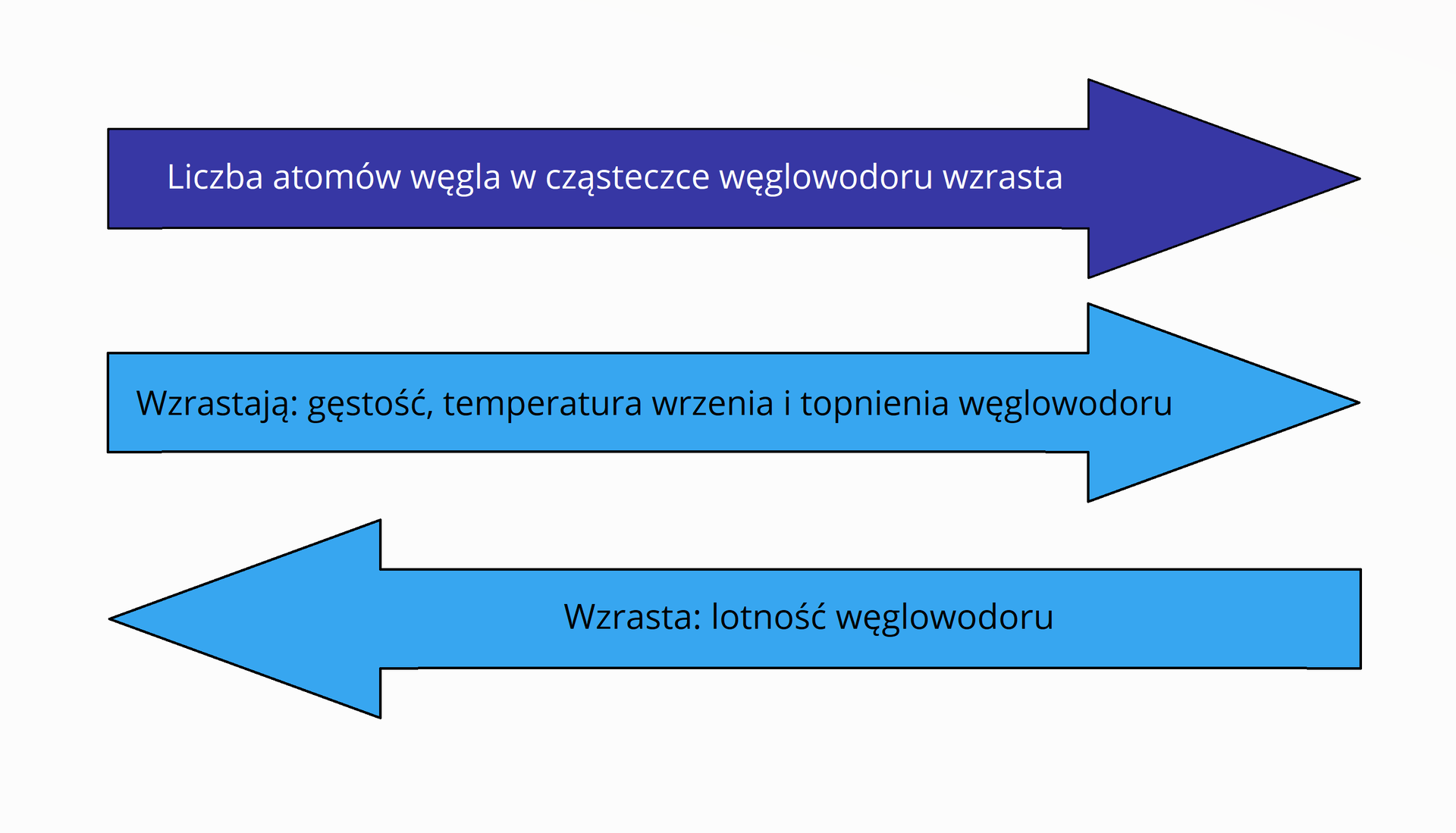
Wraz ze wzrostem liczby atomów węgla w cząsteczkach węglowodorów, o prostych łańcuchach węglowych, rosną ich masy cząsteczkowe. Im większa jest masa cząsteczkowa węglowodoru, tym bliżej siebie znajdują się kolejne jego cząsteczki – są bardziej upakowane. To z kolei powoduje zwiększanie się gęstości i zmniejszenie lotności węglowodorów wraz ze wzrostem długości łańcucha węglowego (a więc liczby zawartych w nim atomów węgla). Im dłuższe są łańcuchy węglowe, tym większych nakładów energii potrzeba, aby zmienić stan skupienia danego węglowodoru. Dlatego wraz ze wzrostem liczby atomów węgla w cząsteczkach węglowodorów rosną ich temperatury wrzenia i topnienia.
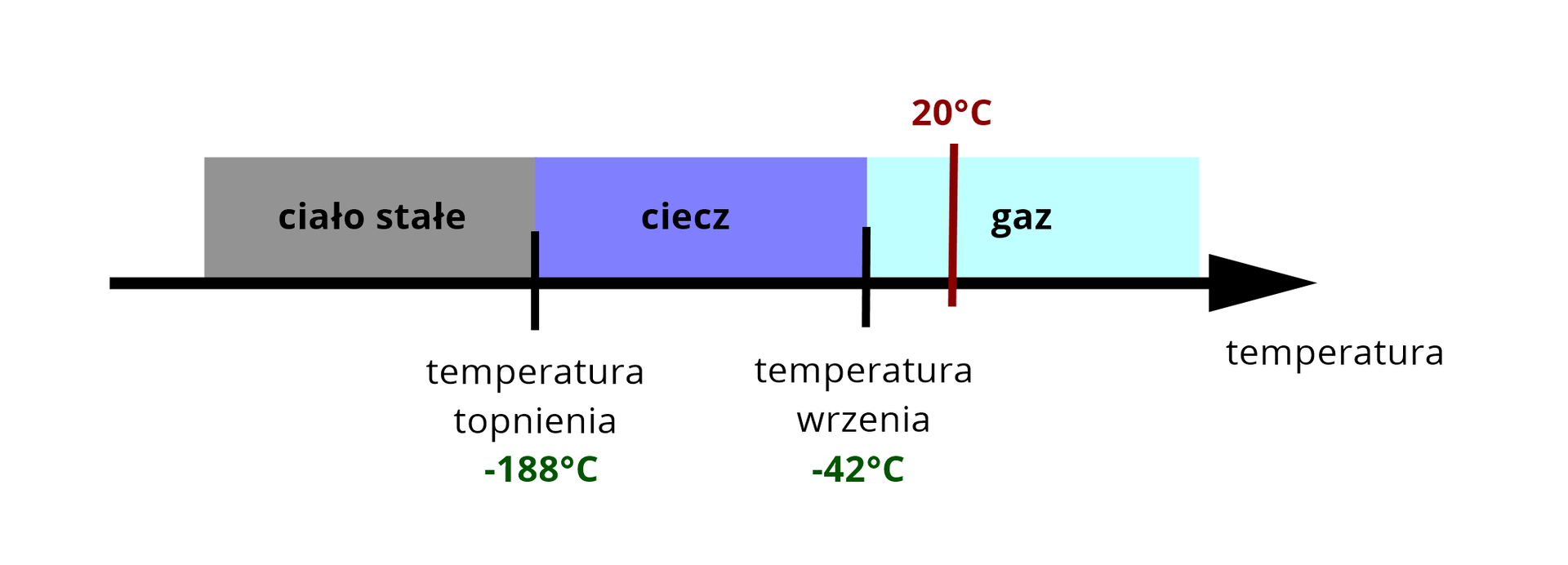
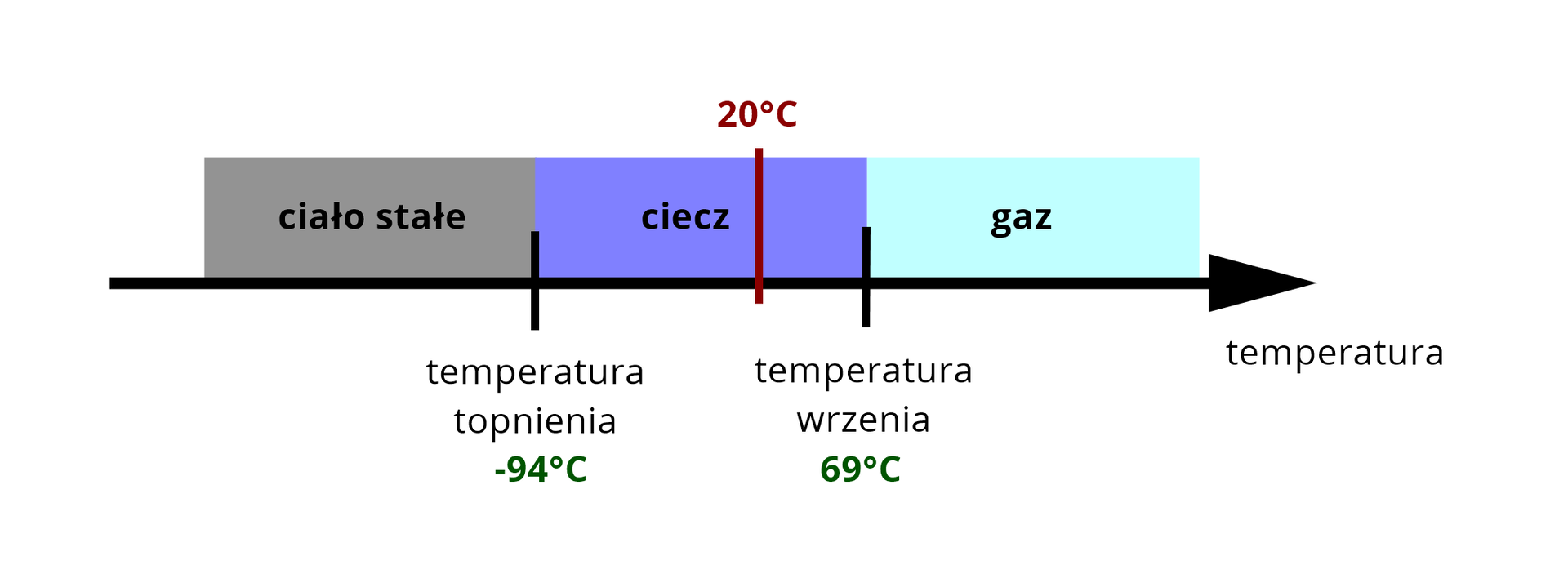
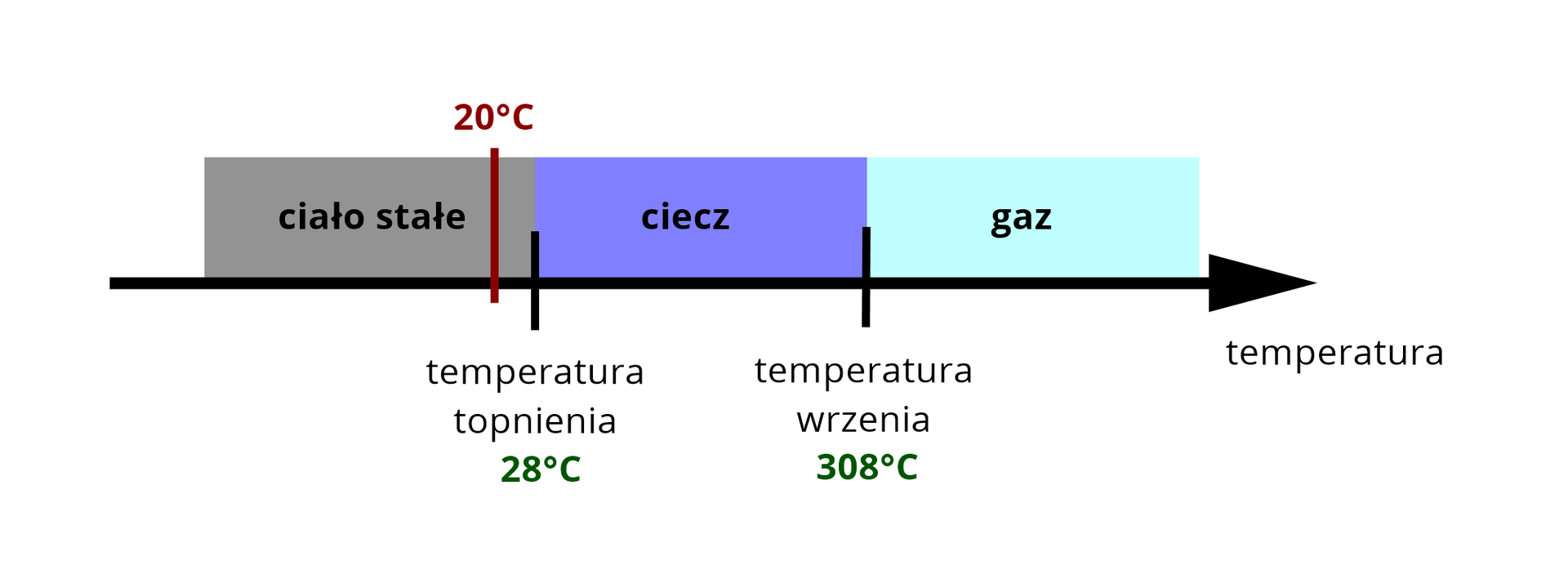
W poniższej tabeli zamieszczono temperatury wrzenia i topnienia trzech różnych węglowodorów, wyznaczone dla ciśnienia . Określ, w jakim stanie skupienia występują one w temperaturze i pod ciśnieniem .
Numer węglowodoru | Temperatura topnienia, °C | Temperatura wrzenia, °C |
|---|---|---|
Węglowodór I | ||
Węglowodór II | ||
Węglowodór III |
Węglowodory – właściwości chemiczne
Alkany są bierne chemicznie. Oznacza to, że „niechętnie” reagują z innymi substancjami. Jedną z przyczyn małej aktywności chemicznej węglowodorów nasyconych jest obecność w nich wyłącznie pojedynczych wiązań pomiędzy atomami węgla w ich cząsteczkach. Z kolei alkeny i alkiny, przez wzgląd na obecne w ich cząsteczkach wiązania wielokrotne, są aktywne chemicznie.
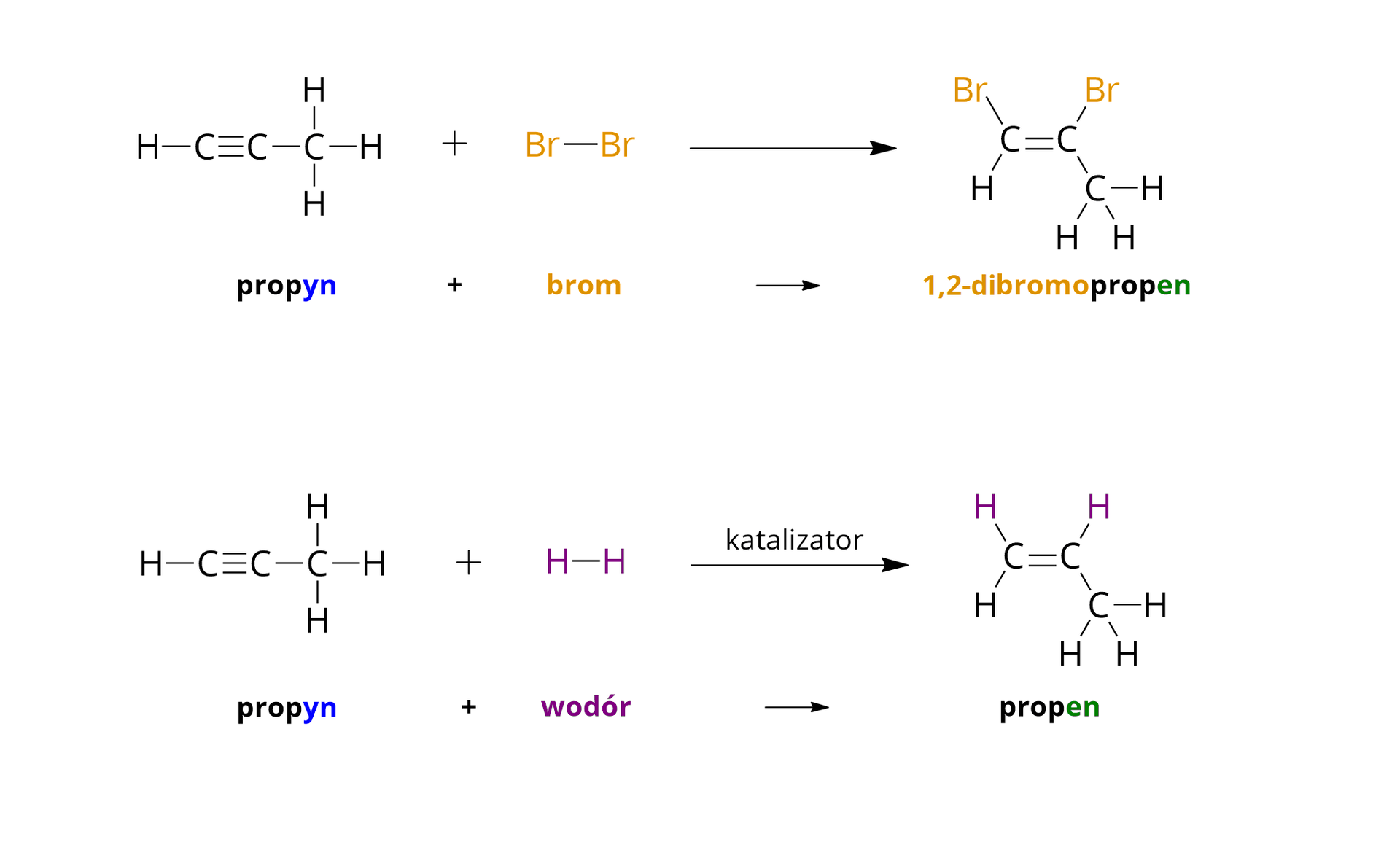
Reakcjami charakterystycznymi dla węglowodorów nienasyconych są reakcje typu addycji (przyłączania) oraz polimeryzacji. W reakcjach addycji do cząsteczki alkenu lub alkinu przyłączają się atomy określonych pierwiastków chemicznych, a produktem jest tylko jeden związek organiczny (inny niż wyjściowy). W temperaturze pokojowej węglowodory nienasycone reagują np. z bromem. Poniżej, wykorzystując wzory strukturalne poszczególnych związków chemicznych, zapisano równania reakcji wybranych węglowodorów nienasyconych z bromem (w środowisku bezwodnym).
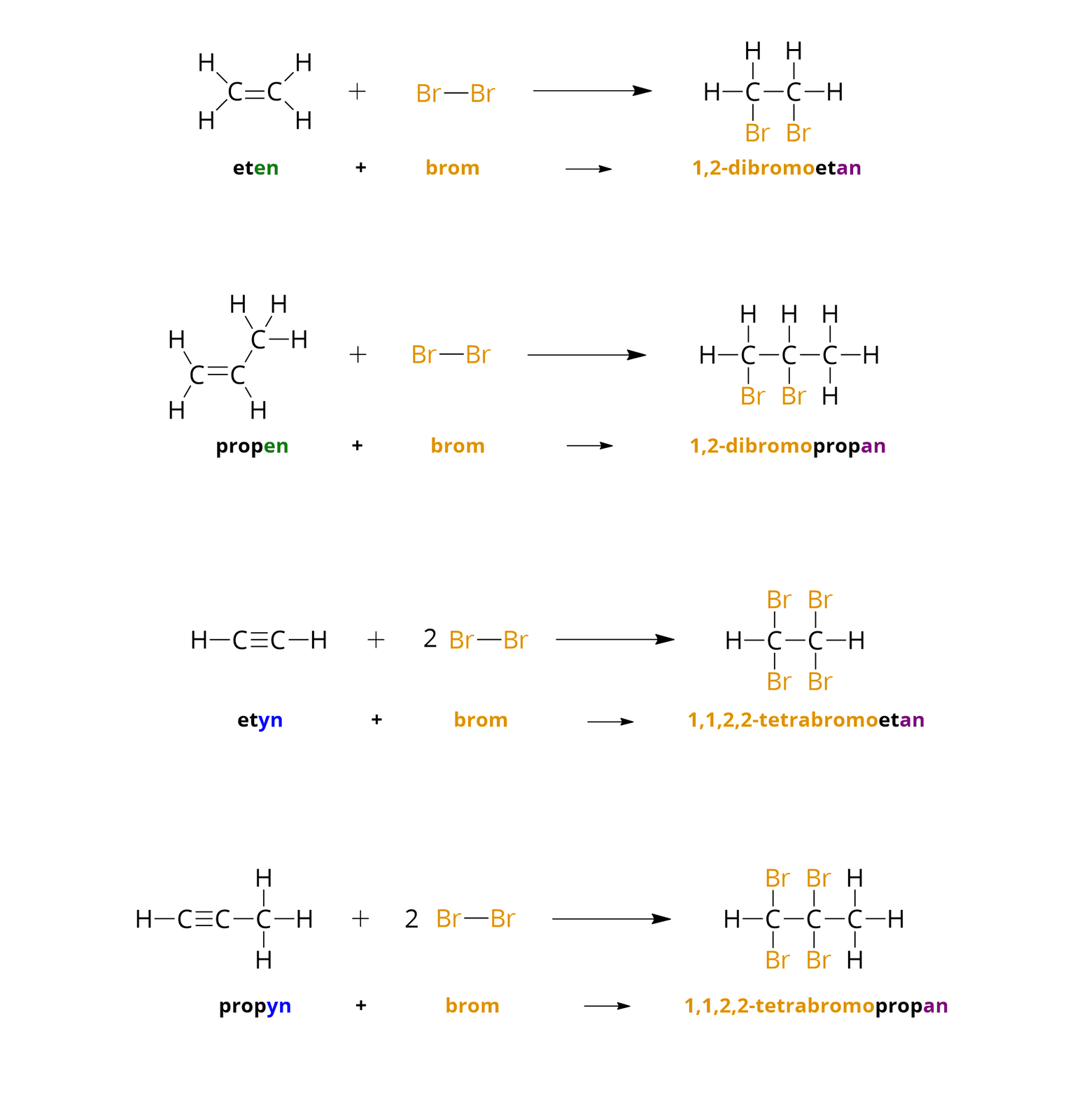
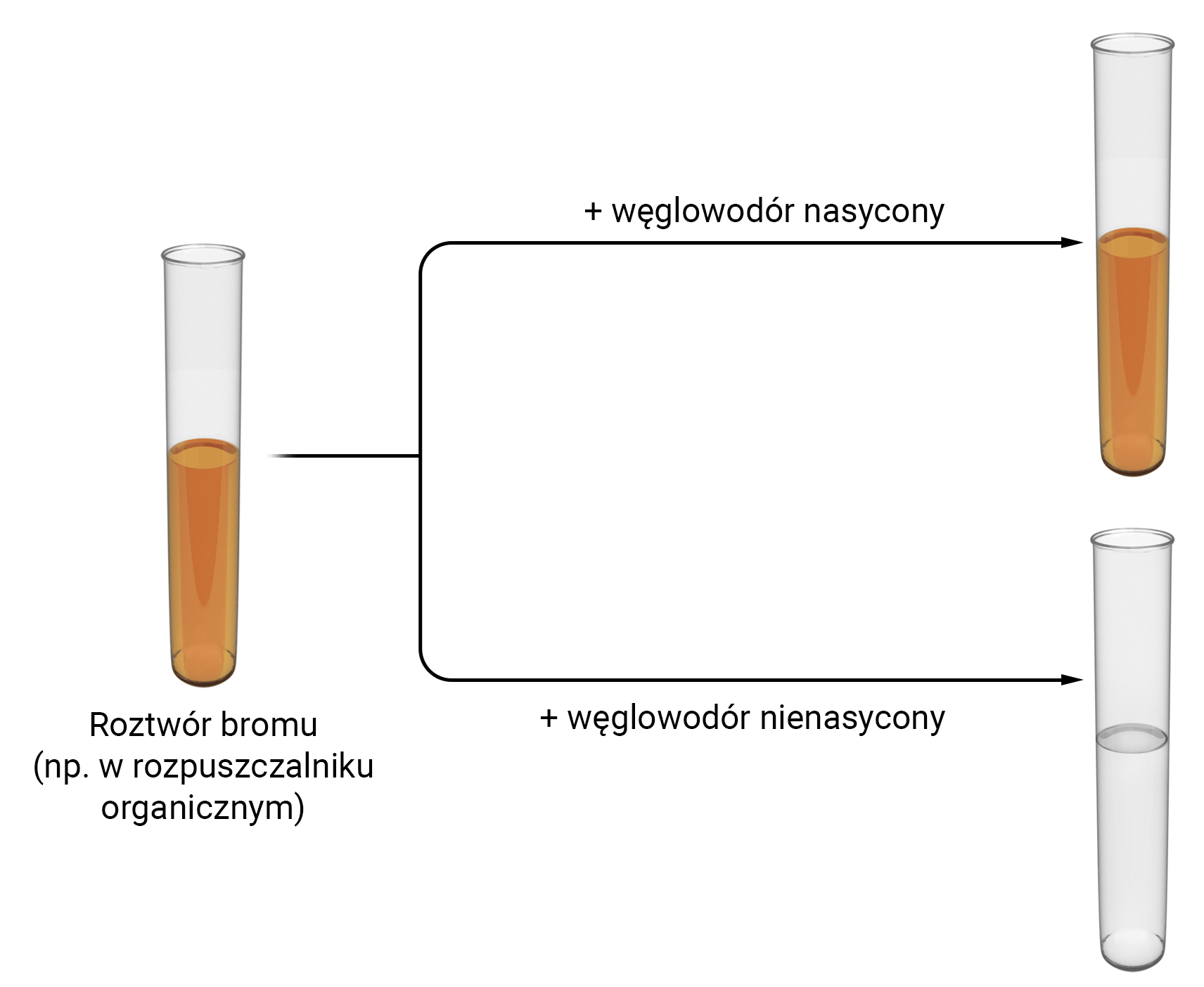
Brom rozpuszcza się zarówno w wodzie, jak i w rozpuszczalnikach organicznych, tworząc roztwory o charakterystycznym pomarańczowym (lub brunatnopomarańczowym) zabarwieniu. Powstające w opisanych reakcjach addycji związki chemiczne są bezbarwne. Stąd roztwory bromu można wykorzystywać w laboratoriach do wykrywania obecności związków nienasyconych. Związki te powodują odbarwienie roztworów bromu. Ponadto można je wykorzystać do odróżniania węglowodorów nienasyconych od węglowodorów nasyconych, które w temperaturze pokojowej nie reagują z bromem i nie odbarwiają jego roztworów.
W odpowiednich warunkach, w obecności odpowiedniego katalizatora (zwykle niklu, palladu lub platyny), alkeny i alkiny mogą przyłączyć także wodór. Reakcja addycji wodoru do węglowodorów nienasyconych nosi nazwę reakcji uwodornienia. Poniżej, wykorzystując wzory strukturalne poszczególnych związków chemicznych, zapisano równania reakcji wybranych węglowodorów nienasyconych z wodorem.
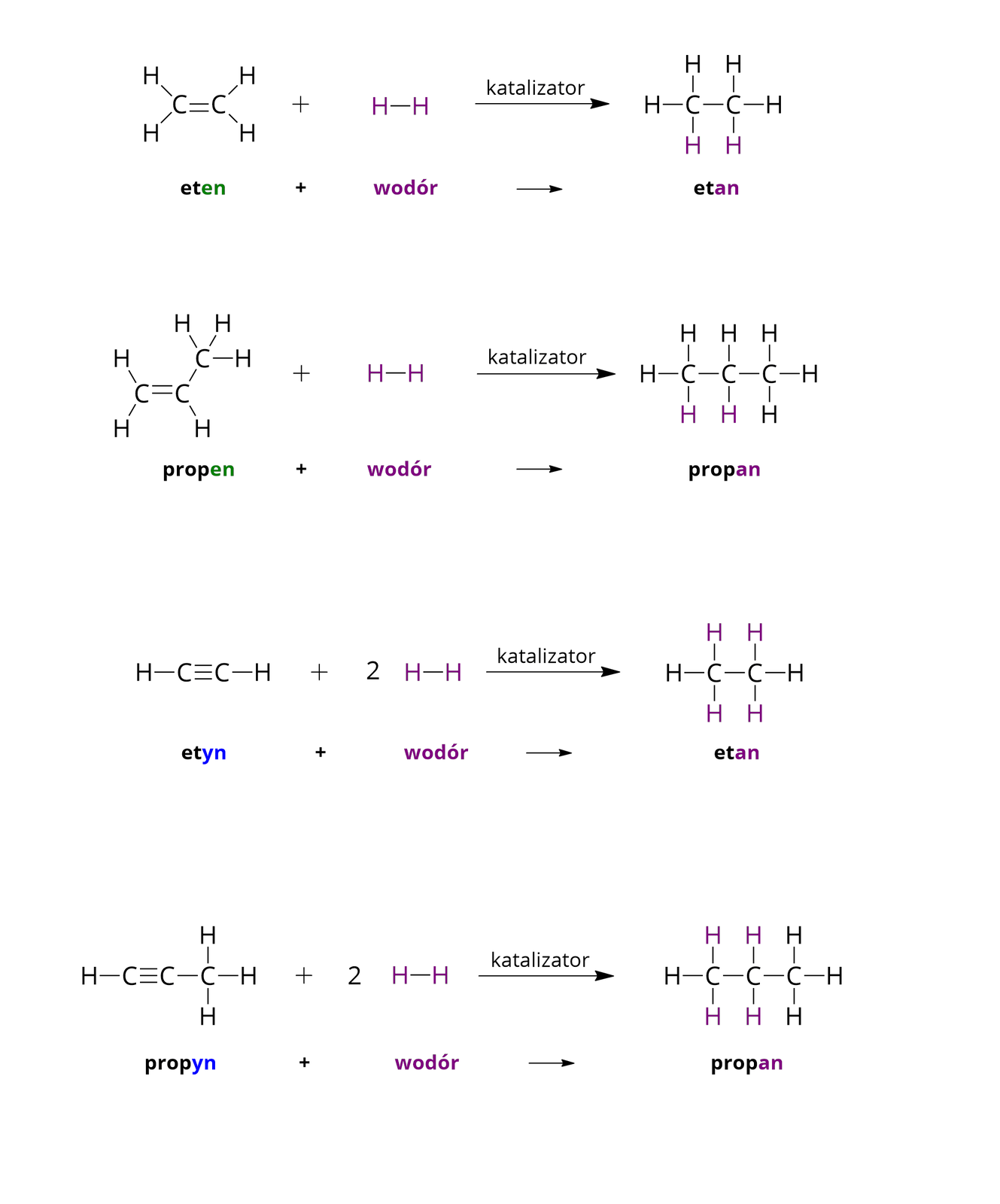
W powyższym materiale przeanalizowano reakcje addycji bromu oraz wodoru do alkinów, w wyniku których powstają nasycone związki chemiczne. Jednak wiązanie potrójne w wyniku reakcji addycji może się również przekształcić w wiązanie podwójne. Przez to produktami reakcji przyłączania bromu i wodoru do alkinów mogą być zarówno związki nasycone, jak i nienasycone, ale zawierające w swoich cząsteczkach wiązania węgiel–węgiel o mniejszej krotności (czyli wiązania podwójne).
Związki nienasycone, a więc między innymi alkeny i alkiny, w odpowiednich warunkach mogą ulegać reakcjom polimeryzacji. W reakcjach tych cząsteczki węglowodorów łączą się ze sobą, tworząc jedną dużą cząsteczkę (polimer), zbudowaną z długiego łańcucha węglowego. Poniżej, wykorzystując wzory półstrukturalne poszczególnych związków chemicznych, zapisano równania reakcji polimeryzacji wybranych węglowodorów nienasyconych.

Wszystkie węglowodory – zarówno te nasycone, jak i nienasycone – ulegają reakcjom spalania w tlenie. W zależności od dostępności tlenu, spalanie to może być całkowite lub niecałkowite. Z tym pierwszym mamy do czynienia wtedy, gdy dostęp tlenu jest nieograniczony. Produktami tego procesu są tlenek węgla() oraz woda (w postaci pary wodnej). Przy ograniczonym dostępie tlenu, węglowodory ulegają spalaniu niecałkowitemu, którego produktami są para wodna oraz węgiel (sadza) lub tlenek węgla() (czad).
Korzystając ze wzorów sumarycznych poszczególnych związków chemicznych, napisz równania opisanych poniżej reakcji spalania węglowodorów.
. Spalanie całkowite alkenu, który zawiera atomów wodoru w cząsteczce.
. Spalanie niecałkowite alkinu, który zawiera pięć atomów węgla w cząsteczce – załóż, że jednym z produktów tego spalania jest węgiel.
. Spalanie niecałkowite alkanu, który zawiera atomów wodoru w cząsteczce – załóż, że jednym z produktów tego spalania jest tlenek
węgla().
1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. , 18. , 19. , 20. , 21. , 22. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. , 18. , 19. , 20. , 21. , 22. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. , 18. , 19. , 20. , 21. , 22.
Spalanie niecałkowite alkinu, który zawiera pięć atomów węgla w cząsteczce — załóż, że jednym z produktów tego spalania jest węgiel.
1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. , 18. , 19. , 20. , 21. , 22. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. , 18. , 19. , 20. , 21. , 22. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. , 18. , 19. , 20. , 21. , 22.
Spalanie niecałkowite alkanu, który zawiera atomów wodoru w cząsteczce — załóż, że jednym z produktów tego spalania jest tlenek węgla().
1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. , 18. , 19. , 20. , 21. , 22. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. , 18. , 19. , 20. , 21. , 22. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. , 18. , 19. , 20. , 21. , 22. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. , 18. , 19. , 20. , 21. , 22.
Węglowodory – zastosowanie
Przez wzgląd na swoją palność, węglowodory (w szczególności alkany) wykorzystywane są jako różnego rodzaju paliwa.
Wśród nich przede wszystkim nienasycone są wykorzystywane jako surowce w produkcji związków chemicznych o dużym znaczeniu technologicznym i przemysłowym. Dużą rolę odgrywa tutaj reakcja polimeryzacji, w wyniku której otrzymuje się polimery syntetyczne, wchodzące w skład tworzyw sztucznych.
Z tworzyw sztucznych z kolei produkuje się wiele przedmiotów codziennego użytku (od zabawek, poprzez pojemniki do przechowywania np. żywności, aż po stolarkę okienną i wykładziny podłogowe).
Eten wykorzystywany jest również między innymi w rolnictwie do przyspieszania dojrzewania owoców i regulowania wzrostu upraw.
Etyn znalazł zastosowanie między innymi w palnikach acetylenowo–tlenowych, wykorzystywanych do cięcia i spawania metali.
Mapa pojęć
Skonstruuj mapę myśli do hasła „węglowodory”. Podczas jej tworzenia uwzględnij ogólny opis tej grupy związków, podział węglowodorów, właściwości chemiczne i fizyczne oraz ich zastosowania. Następnie wykonaj polecenia pod mapą myśli.
Mapa myśli opisuje węglowodory uwzględniając: zastosowanie, właściwości, podział oraz związki węgla z wodorem. Elementy opisujące zastosowanie mają kolor ciemnopomarańczowy. Rozróżnia się węglowodory nasycone i nienasycone. Węglowodory nasycone służą między innymi do wytwarzania parafiny (mieszaniny alkanów w stałym stanie skupienia), która wykorzystywana jest do produkcji sztucznej wazeliny i kremów, produkcji świec i smarów, a także jako środek przeczyszczający. Węglowodory nasycone wykorzystywane są również jako paliwo. Wyróżnić można olej napędowy, metan jako gaz opałowy w instalacjach na gaz ziemny oraz gaz propan–butan, który wykorzystywany jest jako paliwo samochodowe (gaz LPG), paliwo w butlach turystycznych, a także służy do napełniania zapalniczek. Węglowodory nienasycone wykorzystywane są między innymi do produkcji związków chemicznych o dużym znaczeniu przemysłowym, np. kwas octowy (etanowy) lub etanol, w rolnictwie do przyspieszania procesu dojrzewania owoców i regulowania wzrostu upraw, np. eten (hormon roślinny), a także jako palniki acetylenowo–tlenowe (etyn) do cięcia i spawania metali. Węglowodory nienasycone wykorzystuje się również do produkcji polimerów i tworzyw sztucznych. Wyróżnić można poli(chlorek winylu) (PCW, ang. PVC) wykorzystywany w stolarce okiennej, w wykładzinach podłogowych oraz rury kanalizacyjne, a także polietylen, który to jest produktem reakcji polimeryzacji etenu i wykorzystywany jest do produkcji folii opakowaniowych, butelek na wodę i chemikaliów, do produkcji “plastikowych” zabawek (np. klocków), izolacji kabli elektrycznych, wytwarzania rur do transportu wody i ścieków, a także służy jako materiał do produkcji nart. Wyróżniamy również polipropylen, który to stanowi produkt reakcji polimeryzacji propenu i wykorzystywany jest w “lekkich” częściach samochodu, np. zderzakach, w dywanach, w zabawkach, butelkach na napoje, obudowie sprzętów elektronicznych, jednorazowych strzykawkach oraz w pojemnikach do pakowania i przechowywania żywności. Następnym rozgałęzieniem są elementy opisujące właściwości, mają one kolor zielony. Wyróżniamy właściwości fizyczne i chemiczne. Jedną z właściwości fizycznych jest stan skupienia, który dzieli się na stały, ciekły i gazowy. W postaci stałej występują alkany: od siedemnastu atomów węgla w łańcuchu, alkeny: od siedemnastu atomów węgla w łańcuchu oraz alkiny: od szesnastu atomów węgla w łańcuchu. W postaci ciekłej występują alkany posiadające od pięciu do szesnastu atomów węgla w łańcuchu, alkeny posiadające od pięciu do szesnastu atomów węgla w łańcuchu oraz alkiny posiadające od pięciu do piętnastu atomów węgla w łańcuchu. W postaci gazowej występują alkany posiadające od jednego do czterech atomów węgla w łańcuchu, alkeny posiadające od dwóch do czterech atomów węgla w łańcuchu oraz alkiny posiadające od dwóch do czterech atomów węgla w łańcuchu. Kolejnymi właściwościami fizycznymi są: gęstość, która dla węglowodorów o nierozgałęzionych łańcuchach węglowych rośnie wraz ze wzrostem długości łańcucha; temperatura wrzenia i topnienia, które dla węglowodorów o nierozgałęzionych łańcuchach węglowych rosną wraz ze wzrostem długości łańcucha; lotność, która dla węglowodorów o nierozgałęzionych łańcuchach węglowych maleje wraz ze wzrostem długości łańcucha; rozpuszczalność w wodzie (cząsteczki węglowodorów mają niepolarną budowę i są praktycznie nierozpuszczalne w wodzie). Wśród właściwości chemicznych wyróżnić można polimeryzację. Węglowodory nasycone nie ulegają reakcjom polimeryzacji, natomiast węglowodory nienasycone – tak, a produkty tej reakcji są polimerami. Inną właściwością chemiczną jest spalanie: całkowite – przy nieograniczonym dostępie tlenu, gdzie produktami są i oraz niecałkowite – przy ograniczonym dostępie tlenu, gdzie produktami są i lub i . Pozostałymi właściwościami chemicznymi są przyłączanie bromu i przyłączanie wodoru . W przypadku przyłączania bromu, kiedy węglowodory nienasycone reagują z bromem, odbarwiają one wodę bromową i roztwory bromu w rozpuszczalnikach organicznych. Jest to reakcja addycji (przyłączania). Kiedy z kolei węglowodory nasycone reagują z bromem, reakcja między węglowodorami nasyconymi, a bromem przebiega powoli i objawów reakcji nie widać od razu. Do jej zajścia wymagana jest obecność światła. Jest to reakcja substytucji rodnikowej (podstawienia). W przypadku przyłączania wodoru, kiedy węglowodory nienasycone reagują z wodorem, produktami reakcji mogą być węglowodory nasycone. Jest to reakcja addycji (przyłączania). Węglowodory nasycone nie reagują z wodorem. Następnym rozgałęzieniem są elementy opisujące podział (klasyfikację), mają one kolor pomarańczowy. Węglowodory dzielą się na nasycone i nienasycone. Węglowodory nasycone są to alkany, w których to wszystkie wiązania węgiel–węgiel są pojedyncze: wiązanie pojedyncze . Wzór ogólny szeregu homologicznego to . Węglowodory nienasycone są to alkeny oraz alkiny. W alkenach występuje jedno wiązanie węgiel–węgiel podwójne: wiązanie podwójne , pozostałe (jeśli są) są pojedyncze: wiązanie pojedyncze . Wzór ogólny szeregu homologicznego to . W alkinach występuje jedno wiązanie węgiel–węgiel potrójne: wiązanie potrójne , pozostałe (jeśli są) są pojedyncze: wiązanie podwójne . Wzór ogólny szeregu homologicznego to . Ostatnim rozgałęzieniem są elementy opisujące związki węgla z wodorem, mają one kolor jasnożółty. Są to cząsteczki utworzone z łańcuchów prostych lub rozgałęzionych, a ich atomy węgla są zawsze czterowartościowe.
Słownik
związki chemiczne węgla i wodoru, w których cząsteczkach między atomami występują wyłącznie wiązania pojedyncze (węgiel–węgiel oraz węgiel–wodór); do węglowodorów nasyconych zaliczamy alkany
związki chemiczne węgla i wodoru, w których cząsteczkach między atomami węgla występuje przynajmniej jedno wiązanie wielokrotne (podwójne lub potrójne); do węglowodorów nienasyconych zaliczamy alkeny i alkiny
węglowodory nasycone; związki organiczne zbudowane z atomów węgla i wodoru, zawierające między atomami węgla wyłącznie wiązania pojedyncze; atomy węgla w cząsteczkach alkanów połączone są w proste lub rozgałęzione łańcuchy; alkany tworzą szereg homologiczny, którego wzór ogólny można zapisać jako
węglowodory nienasycone, związki organiczne zbudowane z atomów węgla i wodoru, zawierające między atomami węgla poza wiązaniami pojedynczymi jedno wiązanie podwójne; atomy węgla w cząsteczkach alkenów połączone są w proste lub rozgałęzione łańcuchy; alkeny tworzą szereg homologiczny, którego wzór ogólny można zapisać jako
węglowodory nienasycone, związki organiczne zbudowane z atomów węgla i wodoru, zawierające między atomami węgla poza wiązaniami pojedynczymi jedno wiązanie potrójne; atomy węgla w cząsteczkach alkinów połączone są w proste lub rozgałęzione łańcuchy; alkiny tworzą szereg homologiczny, którego wzór ogólny można zapisać jako
zbiór (ciąg) związków organicznych o podobnej budowie, posiadających takie same grupy funkcyjne (w przypadku alkoholi jest to grupa hydroksylowa); kolejne związki chemiczne w szeregu homologicznym różnią się od siebie o taki sam element budowy – grupę metylenową
miara zdolności atomów do przyciągania elektronów; istnieje kilka skal elektroujemności, na tym etapie kształcenia posługujemy się skalą elektroujemności Paulinga
(łac. additio „dodawanie”) reakcja przyłączenia atomów innych pierwiastków, np. fluorowców (chloru, bromu, jodu), do cząsteczki z wiązaniem wielokrotnym, bez wydzielenia produktów ubocznych
reakcja łączenia monomerów (związków organicznych o stosunkowo niewielkiej masie, posiadających w cząsteczkach wiązania wielokrotne) w duże cząsteczki – tak zwane polimery (o bardzo dużej masie cząsteczkowej, będącej wielokrotnością masy cząsteczkowej monomeru)
w uproszczeniu substancja, która dodana do układu reakcyjnego przyspiesza przebieg reakcji chemicznej, zachodzącej w tym układzie
(gr. polymeres „zbudowany z wielu części”) makrocząsteczki; związki chemiczne, których cząsteczki składają się z wielokrotnie powtarzających się jednostek – grup atomów zwanych merami