Jakie są właściwości fizyczne i chemiczne etenu i etynu?
Jeśli zanurzymy suchą gąbkę w wodzie, ciecz w nią wsiąknie. Czy węglowodory nienasycone też mogą coś „pochłonąć”? Czy w wyniku reakcji chemicznej mogą stać się związkami nasyconymi? W jaki sposób możemy wyjaśnić odbarwianie roztworu bromu w obecności węglowodorów nienasyconych?
Właściwości fizyczne alkenów
Do właściwości fizycznych substancji zaliczamy między innymi stan skupienia, gęstość, temperatury wrzenia i topnienia oraz rozpuszczalność w wodzie.
Alkeny, podobnie jak alkany, są bezbarwne i bardzo trudno rozpuszczają się w wodzie. Ich znikoma rozpuszczalność w wodzie wynika z niepolarnej (hydrofobowej) budowy ich cząsteczek.
W poniższej tabeli zebrano temperatury wrzenia i topnienia wybranych alkanów i alkenów zbudowanych z cząsteczek o prostych (nierozgałęzionych) łańcuchach węglowych. Zawarte w tabeli dane, dotyczące temperatur wrzenia i topnienia, przedstaw w postaci wykresów słupkowych. Na wykresach uwzględnij zależność temperatury wrzenia i topnienia od liczby atomów węgla w cząsteczkach alkanów i alkenów. Porównaj zależność temperatury wrzenia i topnienia od liczby atomów węgla w cząsteczkach alkenów i alkanów.
Liczba atomów węgla w cząsteczce | nazwa alkanów | temperatura wrzenia alkanów | temperatura topnienia alkanów | nazwa alkenów | temperatura wrzenia alkenów | temperatura topnienia alkenów |
|---|---|---|---|---|---|---|
metan | - | - | - | |||
etan | eten | |||||
propan | propen | |||||
butan | but‑1‑en | |||||
pentan | pent‑1‑en | |||||
heksan | heks‑1‑en | |||||
heptan | hept‑1‑en |
Indeks dolny Źródło: Mizerski W.,Tablice chemiczne, Warszawa 2004; https://www.ilo.org/dyn/icsc/showcard.listcards3?p_lang=en [dostęp 20.01.2022] Indeks dolny koniecŹródło: Mizerski W.,Tablice chemiczne, Warszawa 2004; https://www.ilo.org/dyn/icsc/showcard.listcards3?p_lang=en [dostęp 20.01.2022]
W poniższej tabeli zebrano temperatury wrzenia i topnienia wybranych alkanów i alkenów, zbudowanych z cząsteczek o prostych (nierozgałęzionych) łańcuchach węglowych. Porównaj zależność temperatury wrzenia i topnienia od liczby atomów węgla w cząsteczkach alkenów i alkanów, a następnie wykonaj polecenie .
Liczba atomów węgla w cząsteczce | nazwa alkanów | temperatura wrzenia alkanów | temperatura topnienia alkanów | nazwa alkenów | temperatura wrzenia alkenów | temperatura topnienia alkenów |
|---|---|---|---|---|---|---|
metan | - | - | - | |||
etan | eten | |||||
propan | propen | |||||
butan | but‑1‑en | |||||
pentan | pent‑1‑en | |||||
heksan | heks‑1‑en | |||||
heptan | hept‑1‑en |
Wskaż poprawną odpowiedź tak, aby twierdzenie było prawdziwe.
Właściwości fizyczne alkenów są podobne do właściwości odpowiednich alkanów, które zawierają taką samą liczbę atomów węgla w cząsteczkach. Zmieniają się one wraz ze wzrostem liczby atomów węgla w ich cząsteczkach.
Wzrost liczby atomów węgla w cząsteczkach alkenów o prostych łańcuchach węglowych wiąże się ze wzrostem ich mas cząsteczkowych. Im większa jest masa cząsteczkowa alkenu, tym bliżej siebie znajdują się kolejne cząsteczki tego alkenu – są bardziej upakowane. To z kolei powoduje zwiększanie się gęstości alkenów wraz ze wzrostem długości łańcucha węglowego w ich cząsteczkach.
Gęstość związana jest ze stanem skupienia. Alkeny, podobnie jak alkany, mogą występować w trzech stanach skupienia. Przeanalizujmy stan skupienia cząsteczek alkenów (w temperaturze i pod ciśnieniem ), o prostych (nierozgałęzionych) łańcuchach, w których wiązanie podwójne występuje pomiędzy pierwszym i drugim atomem węgla. Można stwierdzić, że pierwsze trzy alkeny, mające kolejno dwa, trzy i cztery atomy węgla w cząsteczkach, to gazy. Kolejne alkeny, zawierające od pięciu do atomów węgla w cząsteczkach, są cieczami, a mające i więcej atomów węgla w cząsteczkach to ciała stałe.
Temperatury wrzenia i topnienia w przypadku alkenów (podobnie jak w przypadku alkanów) zależą od długości łańcucha węglowego oraz budowy ich cząsteczek. Wartości tych temperatur na ogół wzrastają wraz ze wzrostem długości prostego (nierozgałęzionego) łańcucha węglowego, a więc wraz ze wzrostem liczby atomów węgla w cząsteczkach.
Warto jednak wspomnieć, że alkeny zbudowane z cząsteczek o rozgałęzionych łańcuchach węglowych mają niższe temperatury wrzenia niż alkeny, których cząsteczki utworzone są z prostych łańcuchów węglowych, zbudowanych z takiej samej liczby atomów węgla.

Niektóre alkeny, których cząsteczki zawierające wiązanie podwójne przy innym niż pierwszy atom węgla w łańcuchu, mogą występować w formie tzw. izomerów cis- lub trans-. Alken o wzorze sumarycznym może występować w postaci trzech izomerów, których cząsteczki zbudowane są z nierozgałęzionych łańcuchów węglowych. Na poniższej grafice przedstawiono wzory półstrukturalne cząsteczek tych izomerów.

Każdy z wymienionych izomerów charakteryzuje się innymi właściwościami fizycznymi.
W poniższej tabeli przedstawiono wybrane właściwości fizyczne izomerów alkenu o wzorze , których cząsteczki zbudowane są z nierozgałęzionych łańcuchów węglowych.
Nazwa alkenu | Wzór sumaryczny | Temperatura wrzenia | Temperatura topnienia | Gęstość () ( i ) |
|---|---|---|---|---|
but‑1‑en | ||||
cis‑but‑2‑en | 4 | |||
trans‑but‑2‑en | 1 |
Indeks dolny Źródło: Mizerski W., Tablice chemiczne, Warszawa 2004; https://www.ilo.org/dyn/icsc/showcard.listcards3?p_lang=en [dostęp 20.01.2022] Indeks dolny koniecŹródło: Mizerski W., Tablice chemiczne, Warszawa 2004; https://www.ilo.org/dyn/icsc/showcard.listcards3?p_lang=en [dostęp 20.01.2022]
Właściwości chemiczne alkenów
Przyjrzyj się piktogramom, zamieszczonym na butlach z etenem i propenem, i określ, na jakie zagrożenia należy zwrócić uwagę podczas korzystania z etenu i propenu.

Sprawdź, w jaki sposób spala się eten, pierwszy przedstawiciel alkenów. W tym celu wykonaj doświadczenie .
Wybierz hipotezę i zweryfikuj ją, przeprowadzając doświadczenie zgodnie z załączoną instrukcją. Napisz obserwacje i wnioski. Doświadczenie należy przeprowadzać pod sprawnie działającym wyciągiem i w okularach ochronnych.
Zapoznaj się z doświadczeniem i dowiedz się, w jaki sposób spala się eten, pierwszy przedstawiciel alkenów.
Problem badawczy: Jak spala się eten?
Zastanów się, która z podanych poniżej hipotez będzie właściwa.
Hipoteza : Eten spala się wybuchowo.
Hipoteza : Eten spala się całkowicie.
Hipoteza : Eten spala się niecałkowicie.
Co było potrzebne: probówka z zebranym etenem zamknięta korkiem; łuczywo; statyw na probówki; zapałki.
Przebieg doświadczenia: Z probówki napełnionej etanem wyjęto korek, a do jej wylotu zbliżono palące się łuczywo.
Obserwacje: Po zbliżeniu zapalonego łuczywa do wylotu probówki z etenem zaobserwowano, że płomień jest większy, ma żółte zabarwienie i świeci.
Wnioski: Eten jest gazem palnym. Przy pełnym dostępie powietrza ulega spalaniu całkowitemu.
Przy pełnym dostępie powietrza (tlenu) eten spala się żółtym, świecącym płomieniem. Zachodzi wówczas spalanie całkowite, które możemy opisać za pomocą równania reakcji:

Przy ograniczonym dostępie tlenu zachodzi niecałkowite spalanie etenu, a płomień jest kopcący. W wyniku niecałkowitego spalania etenu powstają tlenek węgla (czad) lub węgiel (sadza) oraz woda (w postaci pary wodnej). Niecałkowite spalanie etenu można opisać za pomocą równań reakcji:

Pozostałe alkeny, podobnie jak ich przedstawiciel eten, ulegają reakcjom spalania całkowitego lub niecałkowitego, w zależności od dostępu tlenu.
Napisz równania reakcji spalania całkowitego i niecałkowitego alkenu, który zawiera siedem atomów węgla w cząsteczce.
Sprawdź, czy eten reaguje z bromem. W tym celu wykonaj doświadczenie i przekonaj się, jak eten zachowuje się wobec roztworu bromu w rozpuszczalniku organicznym.
Wybierz hipotezę i zweryfikuj ją, przeprowadzając doświadczenie zgodnie z załączoną instrukcją.
Doświadczenie należy przeprowadzać pod sprawnie działającym wyciągiem i w okularach ochronnych.
Zbadano, czy eten reaguje z bromem. Przeanalizuj więc poniższe doświadczenie i wykonaj ćwiczenie.
Problem badawczy: Czy eten reaguje z bromem?
Hipoteza: Eten reaguje z bromem.
Co było potrzebne: dwie probówki; statyw na probówki; gumowy wężyk; butla z etenem; roztwór bromu w rozpuszczalniku organicznym (np. w chloroformie).
Przebieg doświadczenia: Do obydwu probówek wlano przygotowany roztwór bromu (do około ich pojemności). Następnie, bezpośrednio do roztworu w jednej z probówek, za pomocą gumowego wężyka, wprowadzono eten.
Obserwacje: W probówce, do której wprowadzono eten, zaobserwowano odbarwienie się pomarańczowego roztworu. W probówce, do której nie wprowadzono etenu, nie zaobserwowano objawów reakcji chemicznej.
Wnioski: Odbarwienie roztworu bromu świadczy o tym, że eten reaguje z bromem.
Eten jest związkiem o dużej reaktywności (aktywności chemicznej). Przyczyną tego jest obecność wiązania podwójnego w jego cząsteczce. Zaobserwowane przez Ciebie odbarwienie roztworu świadczy o tym, że pomiędzy etenem i bromem, w środowisku bezwodnym, zaszła reakcja chemiczna. Podobne obserwacje można odnotować, kiedy wprowadzimy eten do kolby z parami bromu.

Zawartość kolby ulegnie wówczas odbarwieniu. W tym przypadku, pomiędzy etenem i bromem, zachodzi taka sama reakcja chemiczna, której objawy można było zaobserwować w doświadczeniu . Równanie tej reakcji możemy przedstawić za pomocą modeli i wzorów strukturalnych.

Równanie to możemy również zapisać, wykorzystując wzory sumaryczne związków chemicznych:
ale nie odzwierciedla on dokładnej budowy cząsteczek reagentów.
W wyniku analizowanej reakcji chemicznej, zerwaniu ulega jedna z wiążących par elektronowych w wiązaniu wielokrotnym (podwójnym) i powstaje związek nasycony o nazwie ,-dibromoetan (przedrostek „di-” informuje, że w cząsteczce znajdują się dwa atomy bromu, a cyfry i wskazują, że każdy z tych atomów przyłączony jest do innego atomu węgla w cząsteczce powstałego związku chemicznego – jeden atom bromu do pierwszego, a drugi atom bromu do drugiego atomu węgla w cząsteczce). Ten typ reakcji nazywamy reakcją addycji, czyli przyłączenia. Reakcjom tego typu ulegają wszystkie alkeny.
W reakcjach addycji do cząsteczki związku organicznego, który najczęściej zawiera wiązanie wielokrotne, przyłączają się atomy innych pierwiastków chemicznych, a produktem jest tylko jeden związek organiczny (inny niż wyjściowy).
W odpowiednich warunkach (z wykorzystaniem odpowiedniego katalizatora), alkeny mogą przyłączyć także wodór. Reakcję taką nazywamy reakcją uwodornienia.
Reakcja etynu z wodorem przebiega zgodnie z równaniem:
Analizowane równanie reakcji można również zilustrować za pomocą modeli lub z wykorzystaniem wzorów strukturalnych.

Pamiętaj, że tak jak zaznaczono w przypadku etenu, tak i w przypadku innych związków chemicznych, których cząsteczki zawierają wiązanie podwójne, nowe atomy przyłączają się w reakcjach addycji do obydwu atomów węgla, połączonych wiązaniem podwójnym:

Sam zaś związek nienasycony w reakcjach addycji „nasyca się” – poprzez zerwanie jednej z par elektronowych w wiązaniu podwójnym, przekształca się w związek nasycony.
Węglowodory nienasycone – alkiny
Alkiny, podobnie jak alkany i alkeny, są bezbarwne i bardzo trudno rozpuszczają się w wodzie.
W poniższej tabeli zebrano temperatury wrzenia i topnienia wybranych alkinów, zbudowanych z cząsteczek o prostych (nierozgałęzionych) łańcuchach węglowych. Zawarte w tabeli dane dotyczące temperatur wrzenia wskazanych alkanów przedstaw w postaci wykresu kolumnowego (słupkowego). Na wykresach uwzględnij zależność temperatury wrzenia od liczby atomów węgla w cząsteczkach alkinów. Porównaj zależność temperatury wrzenia od liczby atomów węgla w cząsteczkach alkinów, alkenów i alkanów.
Liczba atomów węgla w cząsteczce | nazwa alkinu | temperatura wrzenia alkinu | temperatura topnienia alkinu |
|---|---|---|---|
propyn | |||
but‑1‑yn | |||
pent‑1‑yn | |||
heks‑1‑yn | |||
hept‑1‑yn |
Indeks dolny Źródło: Mizerski W., Tablice chemiczne, Warszawa 2004; https://www.ilo.org/dyn/icsc/showcard.listcards3?p_lang=en [dostęp 20.01.2022] Indeks dolny koniecŹródło: Mizerski W., Tablice chemiczne, Warszawa 2004; https://www.ilo.org/dyn/icsc/showcard.listcards3?p_lang=en [dostęp 20.01.2022]
W poniższej tabeli zebrano temperatury wrzenia i topnienia wybranych alkinów zbudowanych z cząsteczek o prostych (nierozgałęzionych) łańcuchach węglowych. Porównaj zależność temperatury wrzenia od liczby atomów węgla w cząsteczkach alkinów, alkenów i alkanów, a następnie wykonaj poniższe polecenie.
Liczba atomów węgla w cząsteczce | nazwa alkinu | temperatura wrzenia alkinu | temperatura topnienia alkinu |
|---|---|---|---|
propyn | |||
but‑1‑yn | |||
pent‑1‑yn | |||
heks‑1‑yn | |||
hept‑1‑yn |
Właściwości fizyczne alkinów są podobne do właściwości odpowiednich alkanów i alkenów, które zawierają taką samą liczbę atomów węgla w cząsteczkach. Właściwości te zmieniają się wraz ze wzrostem liczby atomów węgla w ich cząsteczkach, co skutkuje wzrostem ich mas cząsteczkowych. Im są one większe, tym większa jest ich gęstość. Alkiny, podobnie jak alkany i alkeny, mogą występować w trzech stanach skupienia. W temperaturze i pod ciśnieniem 1013 hPa pierwsze trzy są gazami. Kolejne, które zawierają od pięciu do około atomów węgla w cząsteczkach, to ciecze, a te, które zawierają więcej atomów węgla w cząsteczkach, to ciała stałe.
Temperatury wrzenia i topnienia w przypadku alkinów (podobnie jak gęstość) zależą od długości łańcucha węglowego oraz budowy ich cząsteczek. Wartości tych temperatur na ogół wzrastają wraz ze wzrostem długości prostego (nierozgałęzionego) łańcucha węglowego, a więc wraz ze wzrostem liczby atomów węgla w cząsteczkach.

Właściwości chemiczne alkinów
Sprawdź, w jaki sposób spala się etyn – pierwszy przedstawiciel szeregu homologicznego alkinów. W tym celu wykonaj doświadczenie .
Wybierz hipotezę i zweryfikuj ją, przeprowadzając doświadczenie zgodnie z załączoną instrukcją. Napisz obserwacje i wnioski.
Doświadczenie należy przeprowadzać pod sprawnie działającym wyciągiem i w okularach ochronnych.
Sprawdzono, w jaki sposób spala się etyn – pierwszy przedstawiciel szeregu homologicznego alkinów. W tym celu wykonano doświadczenie.
Problem badawczy: Jak spala się etyn?
Weryfikacji poddano trzy hipotezy.
Hipoteza : Etyn spala się wybuchowo.
Hipoteza : Etyn spala się całkowicie.
Hipoteza : Etyn spala się niecałkowicie.
Co było potrzebne: probówka z zebranym etynem zamknięta korkiem, łuczywo, statyw na probówki, zapałki.
Przebieg doświadczenia: Z probówki napełnionej etynem zdjęto korek, a następnie do jej wylotu zbliżono palące się łuczywko.
Obserwacje: Po zbliżeniu zapalonego łuczywa do wylotu probówki z etynem, zaobserwowano, że płomień jest większy, ma żółte zabarwienie i jest silnie kopcący.
Wnioski: Etyn jest gazem palnym. W powietrzu spala się niecałkowicie.
Etyn jest gazem palnym. W powietrzu spala się żółtym, silnie kopcącym płomieniem. Podczas jego spalania na ściankach probówki może być widoczna sadza (czarny nalot). Świadczy to o dużej zawartości procentowej węgla w etynie. Produktami niecałkowitego spalania etynu są tlenek węgla (czad) lub węgiel (sadza) oraz woda (w postaci pary wodnej). Równania reakcji spalania niecałkowitego możemy zapisać jako:
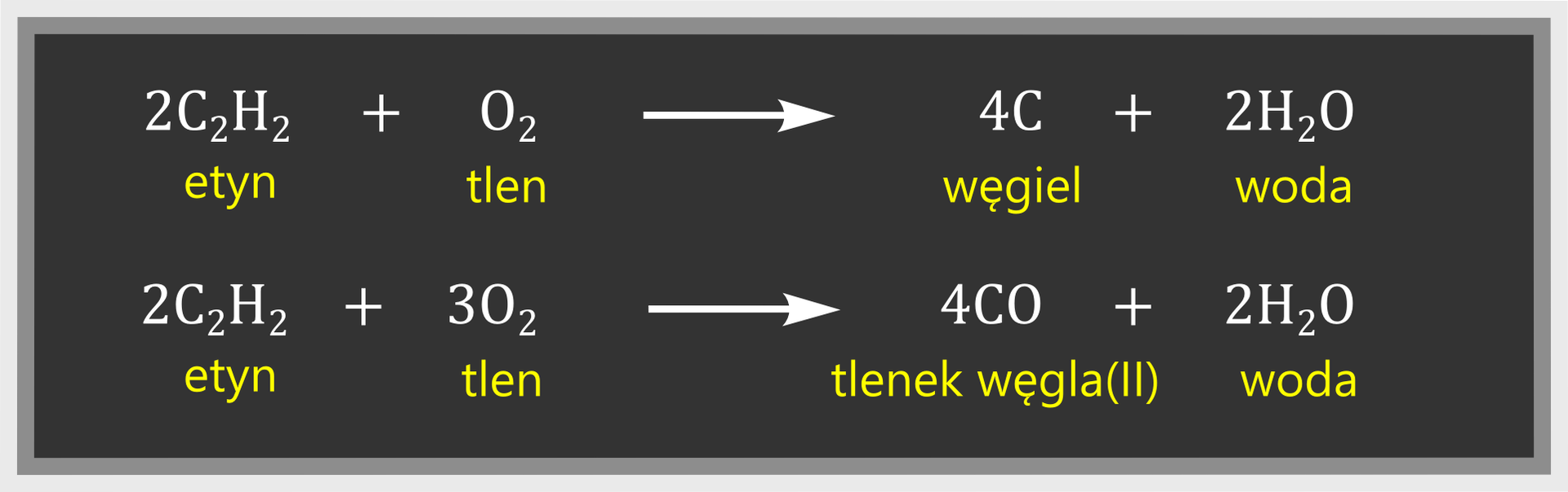
Całkowite spalanie etynu zachodzi przy zwiększonym dostępie tlenu, np. w palnikach acetylenowo‑tlenowych. Równanie reakcji całkowitego spalania etynu ma postać:

Pozostałe alkiny, podobnie jak ich przedstawiciel etyn, ulegają reakcjom spalania całkowitego lub niecałkowitego, w zależności od dostępu tlenu.
Napisz równania reakcji spalania całkowitego i niecałkowitego alkinu, który zawiera cztery atomy węgla w cząsteczce.
Sprawdź, czy etyn reaguje z bromem. W tym celu wykonaj doświadczenie i przekonaj się, jak etyn zachowuje się wobec roztworu bromu w rozpuszczalniku organicznym.
Wybierz hipotezę i zweryfikuj ją, przeprowadzając doświadczenie zgodnie z załączoną instrukcją. Napisz obserwacje i wnioski.
Doświadczenie należy przeprowadzać pod sprawnie działającym wyciągiem i w okularach ochronnych.
W poniższym doświadczeniu sprawdzono, czy etyn reaguje z bromem.
Problem badawczy: Czy etyn reaguje z bromem?
Hipoteza: Etyn reaguje z bromem.
Co było potrzebne: dwie probówki, statyw na probówki, gumowy wężyk, butla z etynem, roztwór bromu w rozpuszczalniku organicznym (np. w chloroformie).
Instrukcja: Do obydwu probówek wlano przygotowany roztwór bromu (do ok. ⅓ ich pojemności). Bezpośrednio do roztworu w jednej z probówek, za pomocą gumowego wężyka, wprowadzono etyn.
Obserwacje: W probówce, do której wprowadzono etyn, zaobserwowano odbarwienie się pomarańczowego roztworu. W probówce, do której nie wprowadzono etynu, nie zaobserwowano objawów reakcji chemicznej.
Wnioski: Odbarwienie roztworu bromu świadczy o tym, że etyn reaguje z bromem.
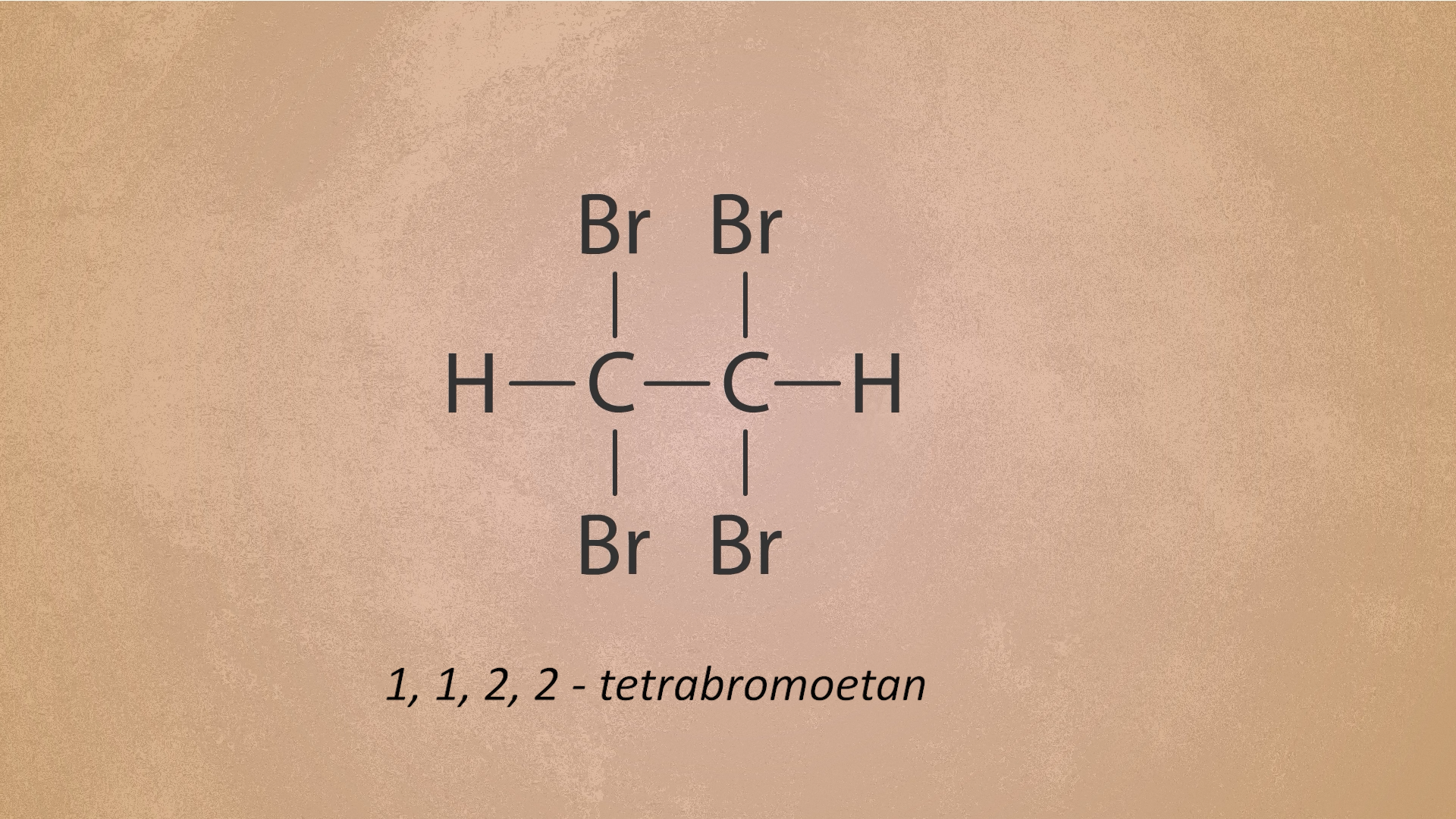
Etyn, podobnie jak eten, powoduje odbarwienie roztworu bromu. Obserwacja ta świadczy o tym, że pomiędzy etynem i bromem zachodzi reakcja chemiczna. Przebiega ona łatwo, co świadczy o dużej reaktywności chemicznej etynu. Równanie tej reakcji (przebiegającej w środowisku bezwodnym) możemy zapisać jako:

Jak widzisz, jest to reakcja addycji – do cząsteczki związku nienasyconego przyłączają się cząsteczki bromu i powstaje tylko jeden produkt. Przeanalizuj poniższą animację, a dowiesz się, jaki jest schemat przebiegu reakcji addycji bromu do etynu.
Film dostępny pod adresem /preview/resource/RL5NZD3r72nVy
Animacja przedstawia poszczególne kroki przyłączania atomów bromu do cząsteczki etynu podczas reakcji addycji.
W wyniku reakcji addycji bromu do etynu, w cząsteczce etynu początkowo ulega zerwaniu jedna z trzech wiążących par elektronowych w wiązaniu potrójnym, a następnie druga. W efekcie powstaje związek nasycony ,,,-tetrabromoetan (przedrostek „tetra-” informuje, że w cząsteczce znajdują się cztery atomy bromu, a cyfry , , i wskazują, że dwa z tych atomów przyłączone są do pierwszego, a następne dwa do drugiego z atomów węgla w cząsteczce).
Zwróć uwagę, że alkany – w przeciwieństwie do alkenów i alkinów – nie reagują z bromem i nie powodują odbarwienia roztworu bromu. Reakcja z bromem może zatem zostać wykorzystana do odróżniania związków nasyconych (alkanów) od związków nienasyconych (alkenów i alkinów).
W dwóch niepodpisanych butlach znajdowały się gazy: w jednej propan, a w drugiej propen. W celu odróżnienia tych dwóch gazów przeprowadzono doświadczenie, zilustrowane na poniższym schemacie.

W czasie wykonywania doświadczenia, odnotowano następujące obserwacje: roztwór, do którego wprowadzono gaz 1 odbarwił się, a roztwór, do którego wprowadzono gaz , pozostał barwny.
Etyn i inne alkiny ulegają reakcjom addycji (przyłączania) – m.in. z wodorem i fluorowcami (np. chlorem, bromem). Aktywność alkinów w reakcjach addycji jest większa niż aktywność alkenów. W wyniku tych reakcji mogą powstać związki nasycone o pojedynczych wiązaniach między atomami węgla.
Równanie reakcji uwodornienia etynu możemy zapisać jako:

Pamiętaj, że tak jak to zaznaczono w przypadku etynu, tak i w przypadku cząsteczek innych alkinów, nowe atomy przyłączają się w reakcjach addycji do obydwu atomów węgla, połączonych wiązaniem potrójnym.

Alkeny i alkiny odbarwiają również wodę bromową. Jednak reakcja chemiczna, która zachodzi po wprowadzeniu związku nienasyconego do wody bromowej, jest nieco bardziej skomplikowana od reakcji tych związków z bromem, w środowisku bezwodnym. Produktami tych reakcji są tzw. bromohydryny. Przykładowo, po wprowadzeniu etenu do wody bromowej powstanie związek chemiczny o wzorze:

Podsumowanie
Właściwości fizyczne alkenów oraz alkinów są podobne do właściwości fizycznych alkanów. Zmieniają się wraz ze wzrostem liczby atomów węgla w łańcuchu.
Alkeny i alkiny są reaktywne chemicznie, są palne i ulegają reakcjom typu addycji.
Alkiny są bardziej reaktywne od alkenów.
Słownik
związek organiczny o wzorze sumarycznym ; bezbarwna ciecz stosowana jako rozpuszczalnik substancji o budowie niepolarnej; dawniej wykorzystywany do narkozy
(łac. additio „dodawanie”) reakcja przyłączenia atomów innych pierwiastków, np. fluorowców (chloru, bromu, jodu), do cząsteczki z wiązaniem wielokrotnym, bez wydzielenia produktów ubocznych
substancja chemiczna, która dodana do układu reakcyjnego zwiększa szybkość danej reakcji chemicznej
reakcja przyłączenia cząsteczki wodoru do cząsteczki z wiązaniem wielokrotnym, bez wydzielenia produktów ubocznych
urządzenie stosowane do spawania i cięcia metali; wysoka temperatura niezbędna do spawania osiągana jest w wyniku spalania mieszaniny etynu (acetylenu) w czystym tlenie
nasycony wodny roztwór bromu o barwie brunatnej (lub pomarańczowej w przypadku roztworów rozcieńczonych)