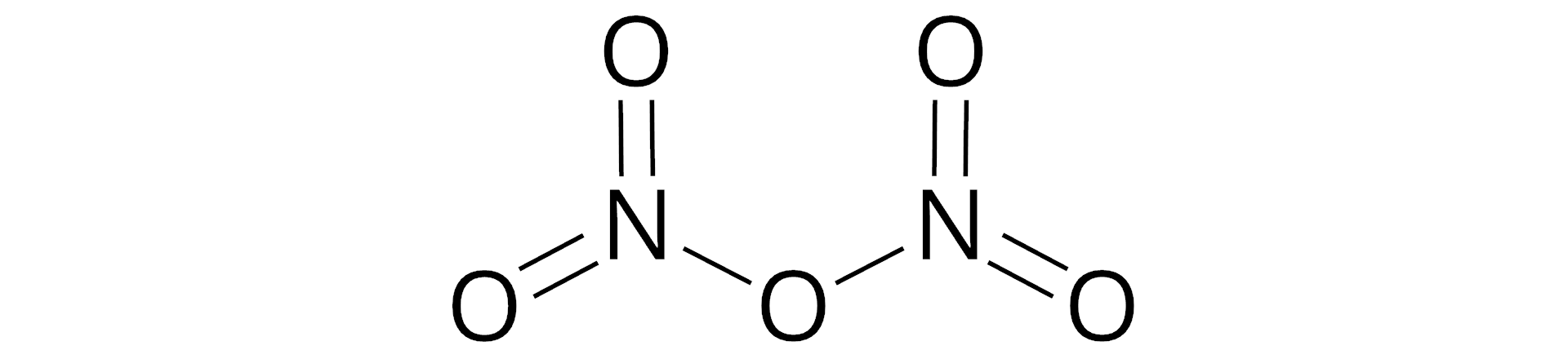
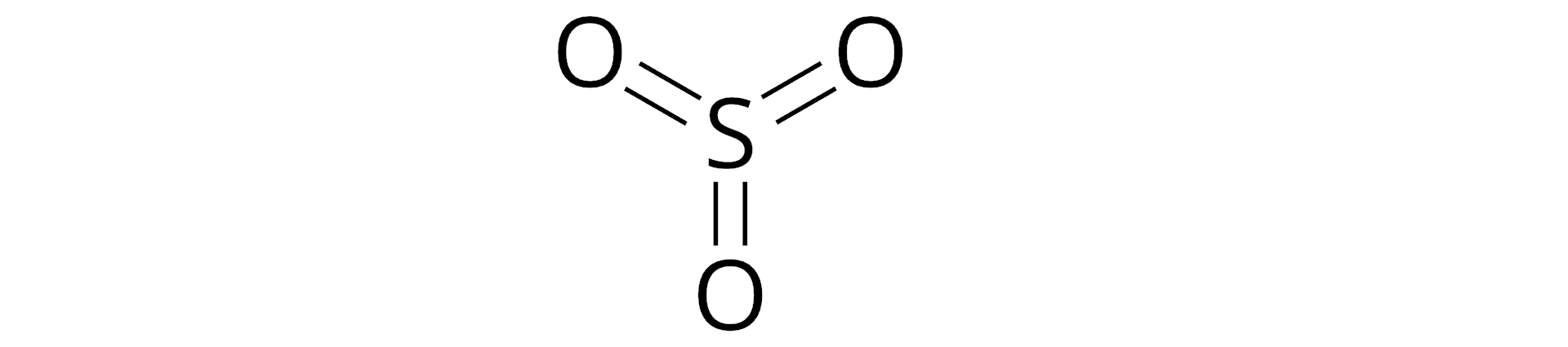
Na zakończenie - sprawdź, czy umiesz
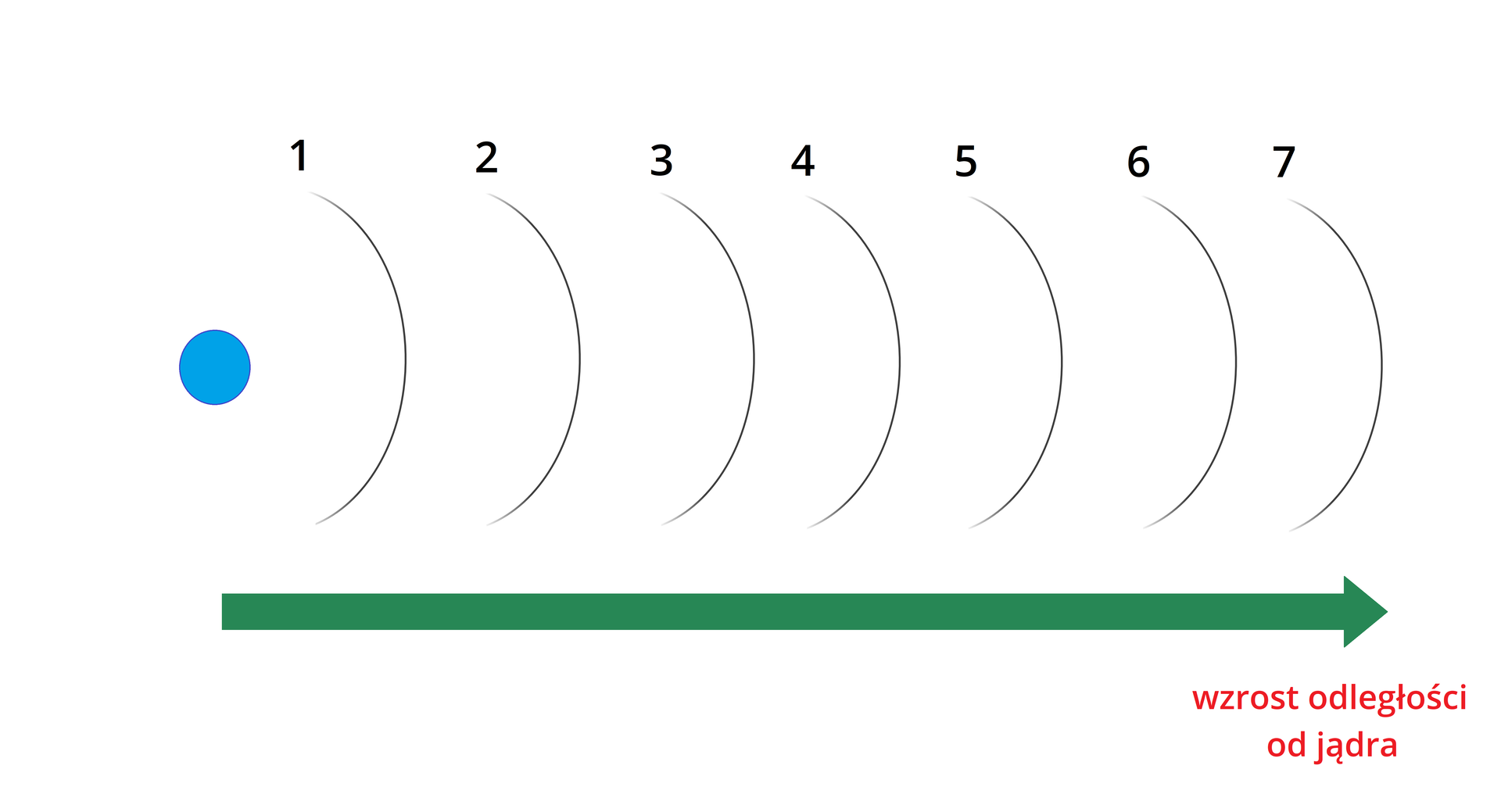
Jak zmienia się energia elektronów w zależności od odległości od jądra? Wstaw właściwe wyrażenie.
Wskaż nieprawidłowe zapisy konfiguracji elektronowej dla atomu pierwiastka o liczbie atomowej Z = 18.
- [1, 8, 2]
- [2, 2, 8]
- [8, 8, 2]
- [2, 8, 8]
Wskaż zapis, który przedstawia konfigurację elektronową atomu pierwiastka chemicznego o liczbie atomowej 17.
Dopasuj oznaczenie literowe powłok elektronowych w atomie oraz podaj maks. liczbę elektronów, które mogą się na nich znajdować. Uzupełnij tabelę, wybierając elementy z listy.
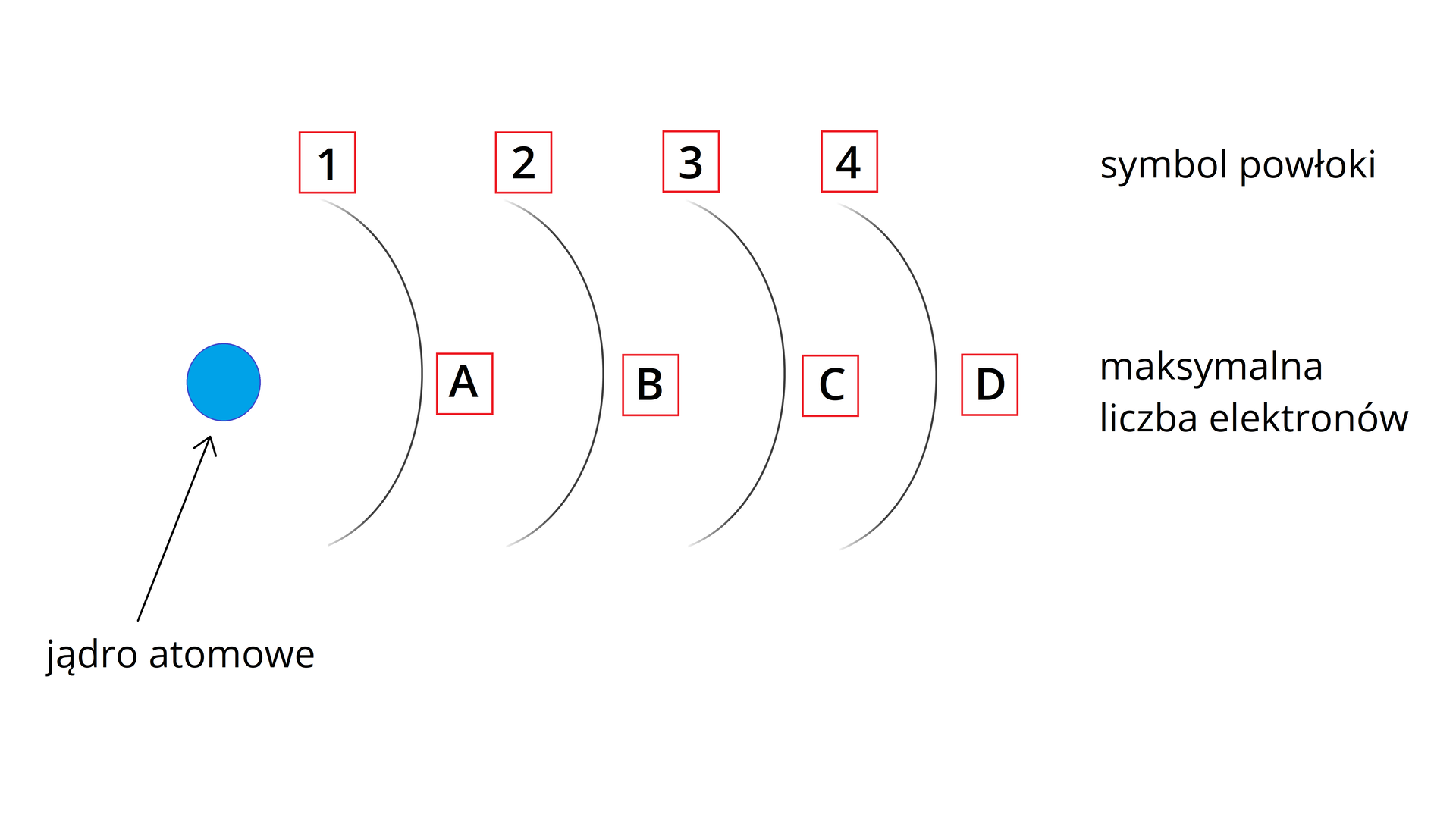
Połącz w pary symbole powłok elektronowych z maks. liczbą elektronów, jaka może się na nich znajdować.
Zapisz konfigurację elektronową sodu .
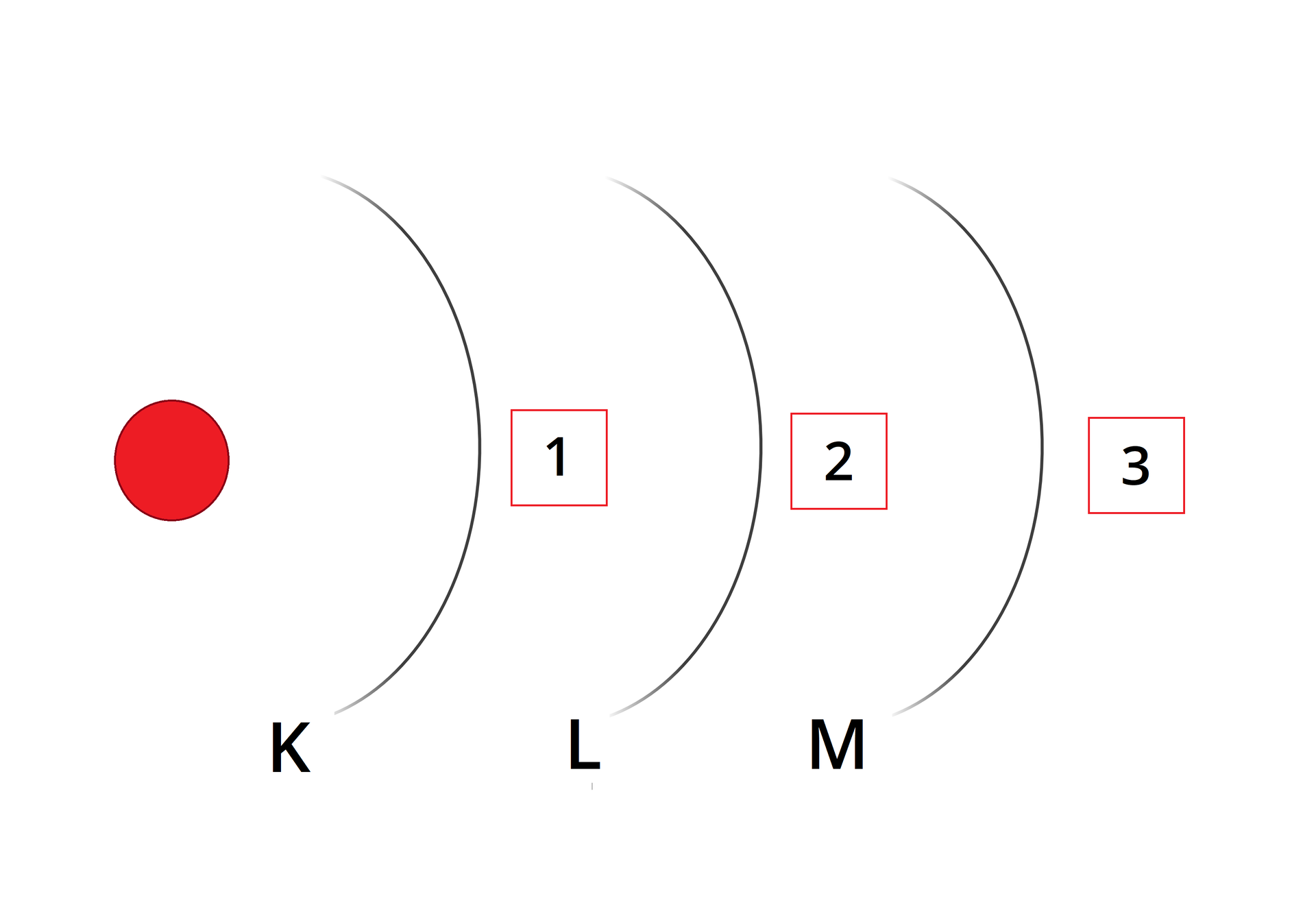
Zapisz konfigurację elektronową sodu .
Zapisz konfigurację elektronową siarki .
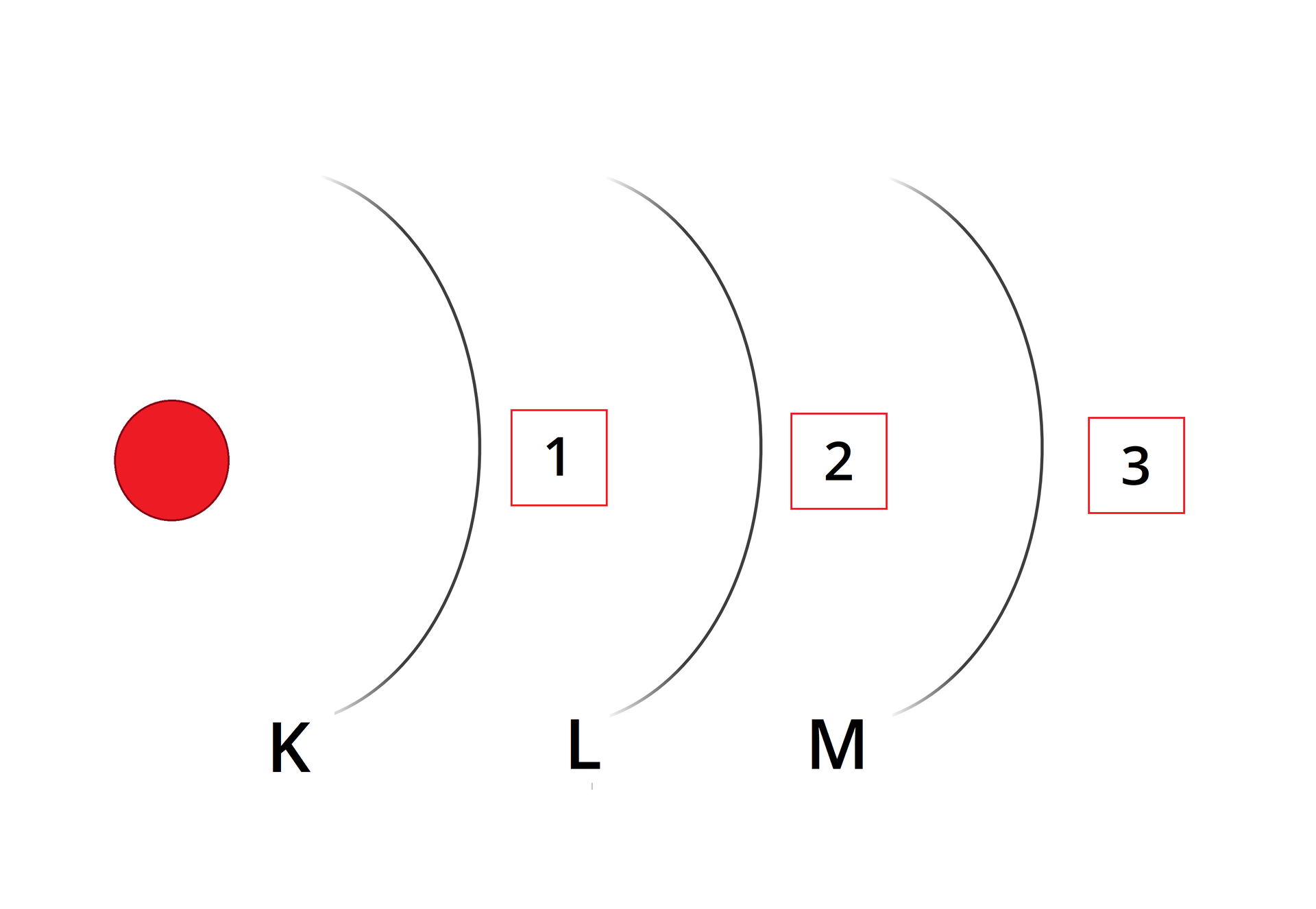
Zapisz konfigurację elektronową siarki .
Zapisz konfigurację elektronową chloru .
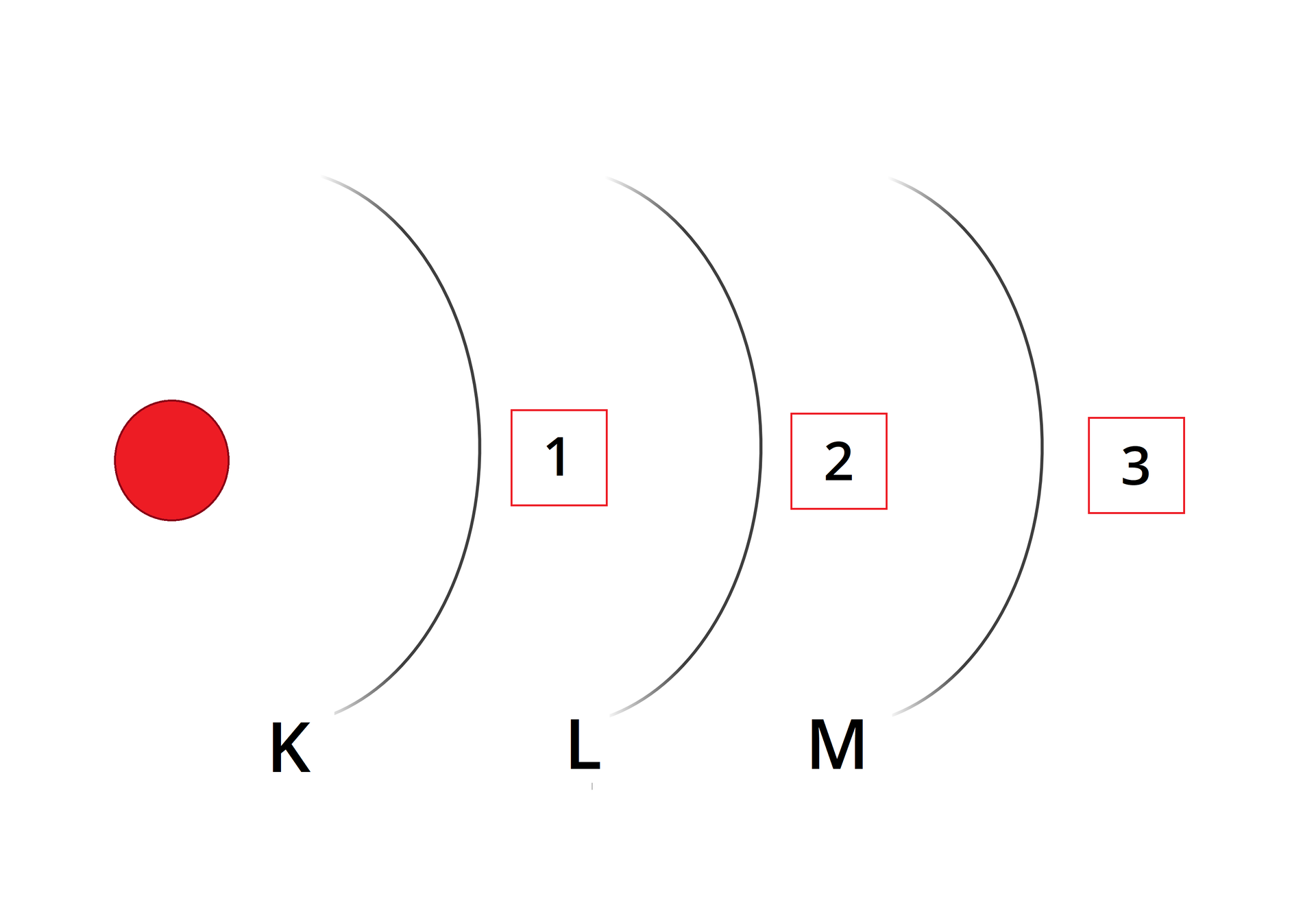
Zapisz konfigurację elektronową chloru , wykorzystując symbole powłok.
Określ prawdziwość zdań.
| Prawda | Fałsz | |
| Im bliżej jądra znajduje się dana powłoka elektronowa w atomie, tym więcej elektronów może ją tworzyć. | □ | □ |
| Zapis [2, 8, 2] przedstawia konfigurację elektronową atomu, który zawiera dwanaście elektronów. | □ | □ |
| Tylko w przypadku pierwszych dwóch powłok elektronowych obowiązuje reguła, według której elektrony mogą tworzyć kolejną powłokę dopiero po wypełnieniu powłoki niższej maksymalną liczbą elektronów. | □ | □ |
| Elektrony walencyjne znajdują się zawsze na pierwszej od jądra atomowego powłoce elektronowej. | □ | □ |
Uzupełnij luki w tekście. Wybierz właściwe określenie z listy.
dwa elektrony, osiemnaście elektronów, dwa elektrony, konfiguracją, osiem elektronów, niższą, lokalizacją, wyższą, osiem elektronów, osiemnaście elektronów, ściśle określonej, całej
Każdy elektron w atomie porusza się w ................................................ przestrzeni wokół jądra.
Im elektron znajduje się na powłoce bliżej jądra atomowego, tym ma ................................................ energię.
Umowny zapis przedstawiający rozmieszczenie elektronów w atomie nazywa się ................................................ elektronową.
Pierwsza powłoka może pomieścić maksymalnie ................................................,
trzecia zaś .................................................
Atom of which chemical element has the following electron configuration?
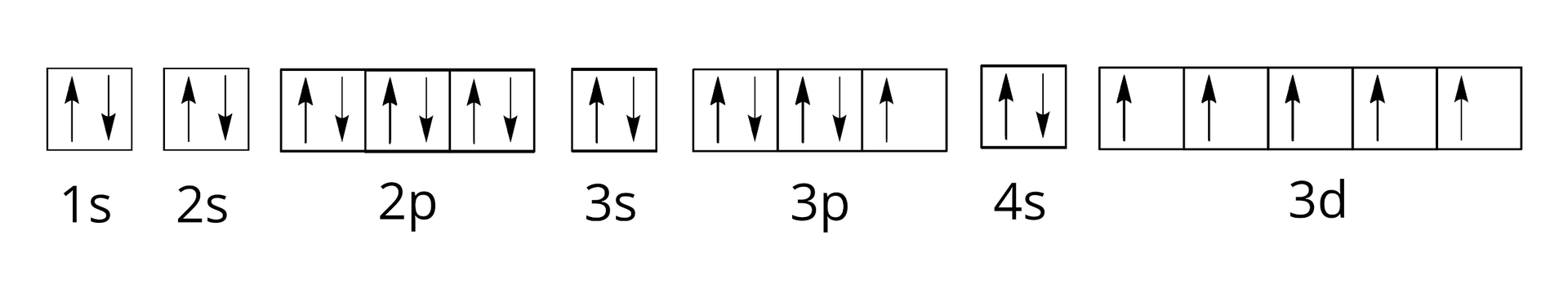
Poniżej przedstawiono konfigurację orbitalną (zapis klatkowy) pewnego pierwiastka chemicznego.
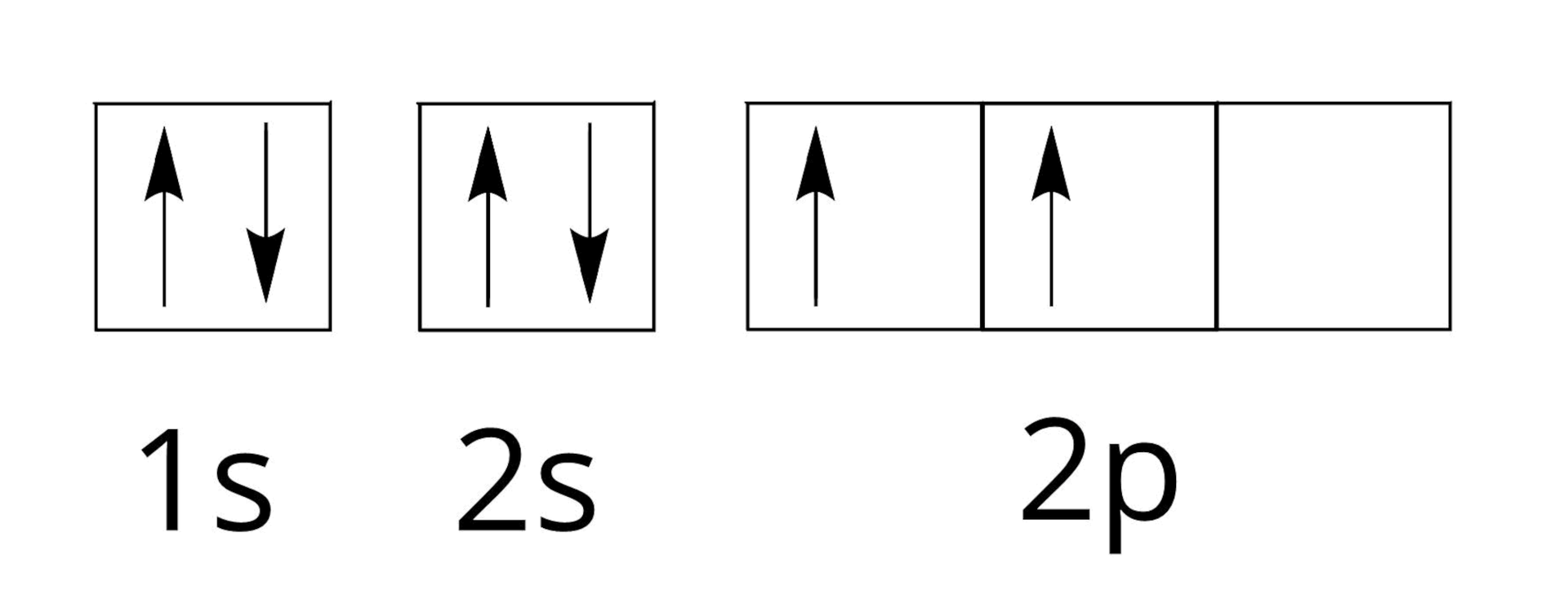
Poniżej przedstawiono konfigurację elektronową pewnego pierwiastka chemicznego.
Wskaż symbol pierwiastka, którego konfigurację elektronową przedstawiono poniżej:
Zapisz pełną podpowłokową konfigurację elektronową atomu chloru.
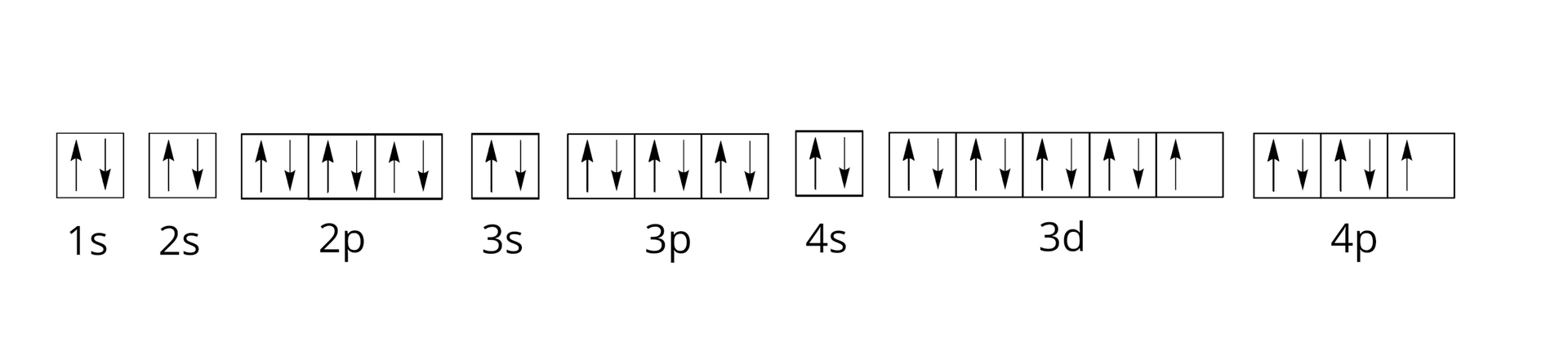
Uzupełnij zapis orbitalny pełnej konfiguracji elektronowej (zapis klatkowy) atomu manganu, wstawiając strzałki w odpowiednie miejsca.
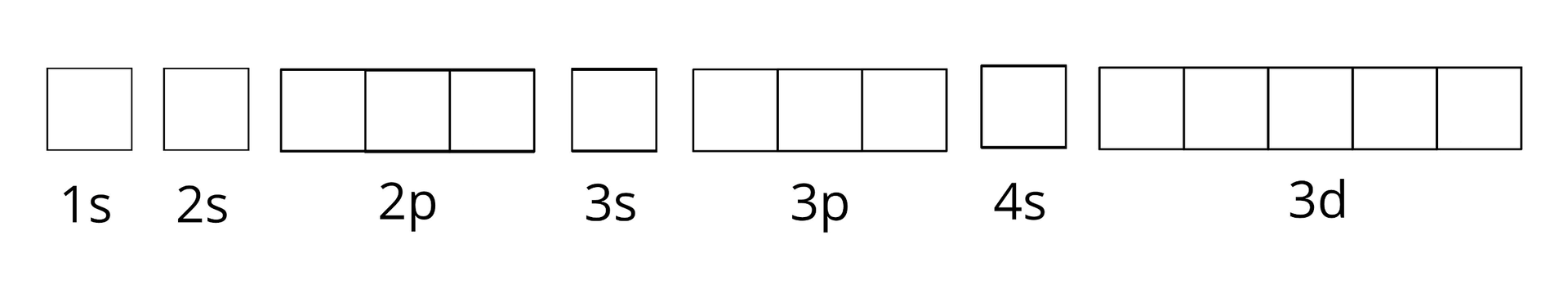
Pewien pierwiastek chemiczny ma następującą podpowłokową konfigurację elektronową:
Ile poziomów orbitalnych jest całkowicie zajętych przez elektrony?
Pewien pierwiastek chemiczny ma następującą podpowłokową konfigurację elektronową:
Ile poziomów orbitalnych jest całkowicie zajętych przez elektrony?
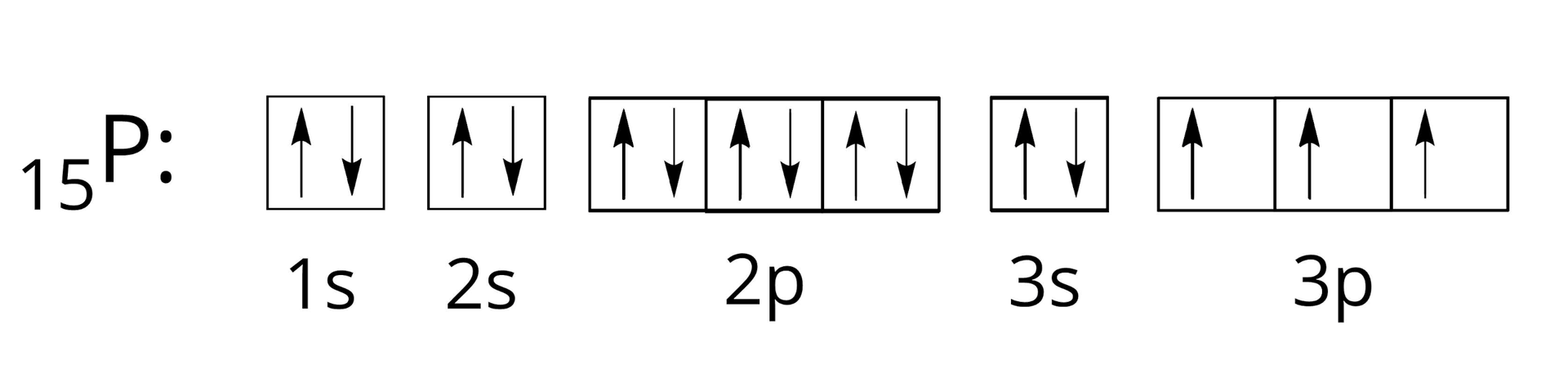
Zapisz pełną orbitalną konfigurację elektronową (zapis klatkowy) atomu fosforu.
Uzupełnij zdanie, wybierając właściwe wyrażenia z listy. Izotopy tego samego pierwiastka mają jednakową liczbę:
- protonów.
- elektronów.
- atomową.
- elektronów walencyjnych.
- powłok elektronowych.
- nukleonów.
- neutronów.
- masową.
Wskaż zapis przedstawiający izotop chloru, którego jądro zawiera 20 neutronów.
Oblicz, jaką przybliżoną masę atomową ma izotop kobaltu: . Wybierz właściwą odpowiedź.
- 59 u
- 32 u
- 86 u
- 27 u
Oblicz, jaką masę atomową ma izotop jodu, jeśli w jego jądrze znajdują się 74 neutrony. Wskaż właściwą odpowiedź.
- 127 u
- 74 u
- 53 u
- 21 u
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Każdy z pierwiastków składa się z co najmniej dwóch izotopów. | □ | □ |
| Wszystkie izotopy danego pierwiastka mają jednakową masę. | □ | □ |
| Tryt zawiera trzy nukleony. | □ | □ |
| Masa prezentowana przy symbolu pierwiastka w układzie okresowym jest masą najpowszechniej występującego izotopu tego pierwiastka. | □ | □ |
| Masa izotopu jest równa liczbowo w przybliżeniu sumie jego protonów i neutronów. | □ | □ |
Oblicz średnią masę atomową żelaza, jeśli jego skład izotopowy jest następujący: , , , . Wskaż poprawną odpowiedź.
- 55,8546 u
- 56,2500 u
- 56,000 u
Oblicz, jaką masę wyrażoną w atomowych jednostkach masy ma 10 000 atomów miedzi, jeśli skład izotopowy tego pierwiastka jest następujący: , Wskaż właściwą odpowiedź.
- 636 166 u
- 10 000 u
- 65 000 u
- 630 000 u
- 29 u
- 63,616 u
Wskaż grupę pierwiastków, których atomy mogą tworzyć wiązania kowalencyjne.
- wodór, tlen, azot
- sód, chlor, wodór
- chlor, tlen, wapń
- węgiel, glin, azot
Ustal nazwy gazów szlachetnych, których konfiguracje elektronowe uzyskały atomy pierwiastków chemicznych w cząsteczce chlorowodoru.
- wodór: hel, chlor: argon
- wodór: neon, chlor: krypton
- wodór: hel, chlor: hel
- wodór: hel, chlor: neon
Podaj nazwę gazu szlachetnego, którego konfigurację elektronową uzyskały atomy pierwiastków w cząsteczce amoniaku.
- azot: neon, wodór: hel
- azot: hel, wodór: hel
- azot: argon, wodór: neon
- azot: neon, wodór: neon
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Wiążąca para elektronowa między dwoma atomami tego samego pierwiastkaw należy w jednakowym stopniu do obu atomów. | □ | □ |
| Atomy azotu w cząsteczce azotu uwspólniają jedną parę elektronów. | □ | □ |
| W cząsteczce chlorowodoru występuje wiązanie atomowe spolaryzowane. | □ | □ |
| Wiązanie podwójne tworzą cztery elektrony. | □ | □ |
| W tworzeniu wiązania atomowego biorą udział wszystkie elektrony walencyjne każdego z połączonych ze sobą atomów. | □ | □ |
Uzupełnij luki w tekście. Wybierz właściwe określenia spośród podanych.
elektronowym, elektrony, elektrony, protony, neutronów, dalej od, protony, elektrony, bliżej, protonów, atomowym, neutrony, elektronów, protony, atomy, neutrony
Wiązanie chemiczne łączy ze sobą ......................... Wiązanie kowalencyjne nazywane jest także wiązaniem ........................ i tworzy się, gdy atomy oddają do wspólnego użytku ......................... Wspólna para ........................ w wiązaniu kowalencyjnym spolaryzowanym znajduje się ........................ atomu, który silniej przyciąga .........................
Uporządkuj nazwy drobin według rosnącej liczby wszystkich wiązań w cząsteczce.
- cząsteczka dwutlenku węgla
- cząsteczka wodoru
- cząsteczka azotu
Przyporządkuj cząsteczki do właściwych kategorii w zależności od rodzaju występujących w nich wiązań chemicznych.
<span aria-label="N indeks dolny, 2" role="math"><math><mrow><msub><mtext>N</mtext><mtext>2</mtext></msub></mrow></math></span>, <span aria-label="Cl indeks dolny, 2" role="math"><math><mrow><msub><mtext>Cl</mtext><mtext>2</mtext></msub></mrow></math></span>, <span aria-label="HCl" role="math"><math><mrow><mi>HCl</mi></mrow></math></span>, <span aria-label="NH indeks dolny, 3" role="math"><math><mrow><msub><mtext>NH</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="CO indeks dolny, 2" role="math"><math><mrow><msub><mtext>CO</mtext><mtext>2</mtext></msub></mrow></math></span>, <span aria-label="H indeks dolny, 2, O" role="math"><math><mrow><msub><mtext>H</mtext><mtext>2</mtext></msub><mtext>O</mtext></mrow></math></span>, <span aria-label="H indeks dolny, 2" role="math"><math><mrow><msub><mtext>H</mtext><mtext>2</mtext></msub></mrow></math></span>
| wiązanie atomowe (kowalencyjne) | |
|---|---|
| wiązanie atomowe (kowalencyjne) spolaryzowane |
W cząsteczce bromowodoru () występuje wiązanie kowalencyjne spolaryzowane. Okazuje się, że jedyna istniejąca wiążąca para elektronowa w cząsteczce znajduje się bliżej atomu bromu. Wybierz właściwy wniosek, który można wysnuć na podstawie podanych informacji.
- Atom bromu ma większą zdolność do przyciągania elektronów niż atom wodoru.
- Atom wodoru ma większą zdolność do przyciągania elektronów niż brom.
- Atom wodoru nie uwspólnił elektronu z atomem bromu.
- Atom bromu oddał dwa elektrony do wspólnego użytkowania z atomem wodoru.
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Kation powstaje z atomu, który przyjął proton. | □ | □ |
| W anionie liczba elektronów jest większa od liczby protonów w jądrze atomowym. | □ | □ |
| Metale mają zdolność tworzenia kationów. | □ | □ |
| Jony utworzone przez różne pierwiastki chemiczne mogą mieć jednakową liczbę elektronów. | □ | □ |
| Jon obdarzony ładunkiem dodatnim to kation. | □ | □ |
| Związki jonowe są zbudowane z cząsteczek. | □ | □ |
| Jony utworzone przez atomy różnych pierwiastków chemicznych zawsze różnią się ładunkiem. | □ | □ |
Uzupełnij luki w tekście. Wybierz właściwe określenie spośród podanych.
protonów w jądrze atomowym, elektronów, neutronów w jądrze atomowym, protonów, elektronów, niższe, odpychają się, przyciągają się, protonów w jądrze atomowym, elektronów, atomów, neutronów w jądrze atomowym, jonów tego samego znaku, jonów przeciwnego znaku, wyższe
Jony powstają z ............................................................. Aniony mają więcej ............................................................ niż ............................................................. Związek jonowy zbudowany jest z ............................................................, które ............................................................ siłami elektrostatycznymi. Związki jonowe mają w porównaniu ze związkami kowalencyjnymi ............................................................ temperatury wrzenia i topnienia.
Wskaż pierwiastki chemiczne, których atomy mogą tworzyć kationy, i te, których atomy mogą tworzyć aniony. Uporządkuj nazwy pierwiastków chemicznych według tworzonych przez nie rodzajów jonów.
sód, chlor, glin, magnez, siarka
| kationy | |
|---|---|
| aniony |
Wskaż zapis przedstawiający konfigurację elektronową kationu magnezu: ?
- [2, 8]
- [2, 8, 2]
- [8, 2]
- [10, 2]
Wskaż, który zapis przedstawia konfigurację elektronową anionu chlorkowego: ?
- [2, 8, 8]
- [2, 8, 1]
- [2, 8, 7]
- [2, 8]
Uporządkuj nazwy jonów według wzrastającego ładunku, którym są obdarzone (od tego, który ma najniższy ładunek, do tego, który ma najwyższy ładunek).
- jon sodu
- jon glinu
- jon magnezu
- jon chlorkowy
- jon siarczkowy
Uporządkuj atomy i jony według liczby obecnych w nich elektronów.
<span aria-label="Mg" role="math"><math><mrow><mi>Mg</mi></mrow></math></span>, <span aria-label="Al indeks górny, trzy, plus" role="math"><math><mrow><msup><mi>Al</mi><mrow><mn>3</mn><mo>+</mo></mrow></msup></mrow></math></span>, <span aria-label="Mg indeks górny, dwa, plus" role="math"><math><mrow><msup><mi>Mg</mi><mrow><mn>2</mn><mo>+</mo></mrow></msup></mrow></math></span>, <span aria-label="Ne" role="math"><math><mrow><mi>Ne</mi></mrow></math></span>, <span aria-label="Na indeks górny, &plus;" role="math"><math><mrow><msup><mi>Na</mi><mrow><mo>&plus;</mo></mrow></msup></mrow></math></span>, <span aria-label="Na" role="math"><math><mrow><mi>Na</mi></mrow></math></span>
| 10 | |
|---|---|
| 11 | |
| 12 |
Uzupełnij luki w tekście. Wybierz właściwe określenia spośród podanych.
16., III, V, 14., tlenkami, VI, 17., VII, VIII, 13., I, 13., II, 2., 13., 1., 17., zawsze mają, metalikami, 16., 15., 1., 14., 14., 2., wodorkami, 17., 16., IV, 15., 15., mogą mieć
Pierwiastki ........................ jednakową wartościowość we wszystkich związkach. Pierwiastki należące do grupy 1. układu okresowego mają we wszystkich związkach wartościowość ......................... Wartościowość równą dwa jest charakterystyczna dla pierwiastków ........................ grupy układu okresowego. Związki metali z tlenem nazywa się ......................... W nazwie tlenku nie podaje się wartościowości pierwiastków grupy ........................ i .........................
Uzupełnij luki w tekście. Wybierz właściwe określenie spośród podanych.
można, nie można, wszystkich, jonowej, cząsteczkowej, tylko cząsteczkowych, tylko jonowych
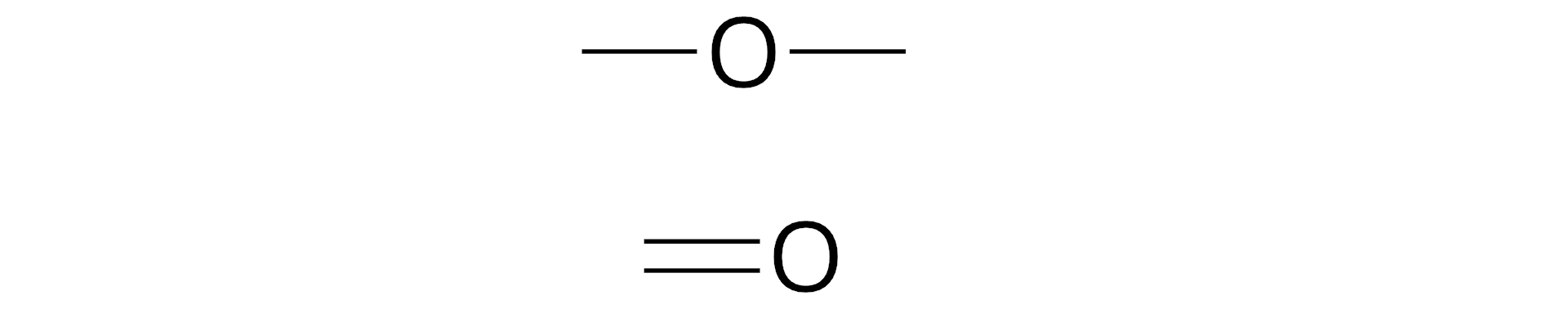
Wzór sumaryczny można zapisać dla .......................................... związków. Wzoru strukturalnego nie można przedstawić dla związków o budowie ........................................... Na podstawie wzoru strukturalnego .......................................... określić wartościowość atomów tworzących cząsteczkę.
Połącz wzory tlenków z ich nazwami.
<span aria-label="Mn indeks dolny, 2, O indeks dolny, 7" role="math"><math><mrow><msub><mtext>Mn</mtext><mtext>2</mtext></msub><msub><mtext>O</mtext><mtext>7</mtext></msub></mrow></math></span>, <span aria-label="PbO" role="math"><math><mrow><mi>PbO</mi></mrow></math></span>, <span aria-label="SO indeks dolny, trzy" role="math"><math><mrow><msub><mi>SO</mi><mn>3</mn></msub></mrow></math></span>, <span aria-label="MnO indeks dolny, dwa" role="math"><math><mrow><msub><mi>MnO</mi><mn>2</mn></msub></mrow></math></span>, <span aria-label="PbO indeks dolny, dwa" role="math"><math><mrow><msub><mi>PbO</mi><mn>2</mn></msub></mrow></math></span>
| tlenek ołowiu(II) | |
| tlenek ołowiu(IV) | |
| tlenek manganu(IV) | |
| tlenek manganu(VII) | |
| tlenek siarki(VI) |
Wskaż nazwę związku o wzorze .
- tlenek rtęci(II)
- tlenek rtęci(I)
- tlenek rtęci(IV)
- tlenek wodoru
- tlenek magnezu
- tlenek helu