Jak interpretować równania reakcji chemicznej?
W efekcie zmieszania dwóch różnych substancji może powstać ich mieszanina (zjawisko fizyczne) bądź też zajść reakcja chemiczna, w wyniku której utworzy się nowa substancja (lub substancje). Jest to uzależnione od właściwości samych substancji oraz od warunków, w jakich się znajdują (np. temperatury otoczenia). Dlatego wiedza na temat ich właściwości jest przydatna podczas przewidywania rodzaju przemian, które zachodzą pod wpływem działania różnych czynników.
W jaki sposób przedstawiamy przebieg reakcji chemicznej?
Chemicy znaleźli uniwersalny sposób opisywania przemian chemicznych podczas których jedne substancje przemieniają się w inne. Każdą reakcję chemiczną można opisać słownie lub za pomocą tak zwanych równań reakcji chemicznych.
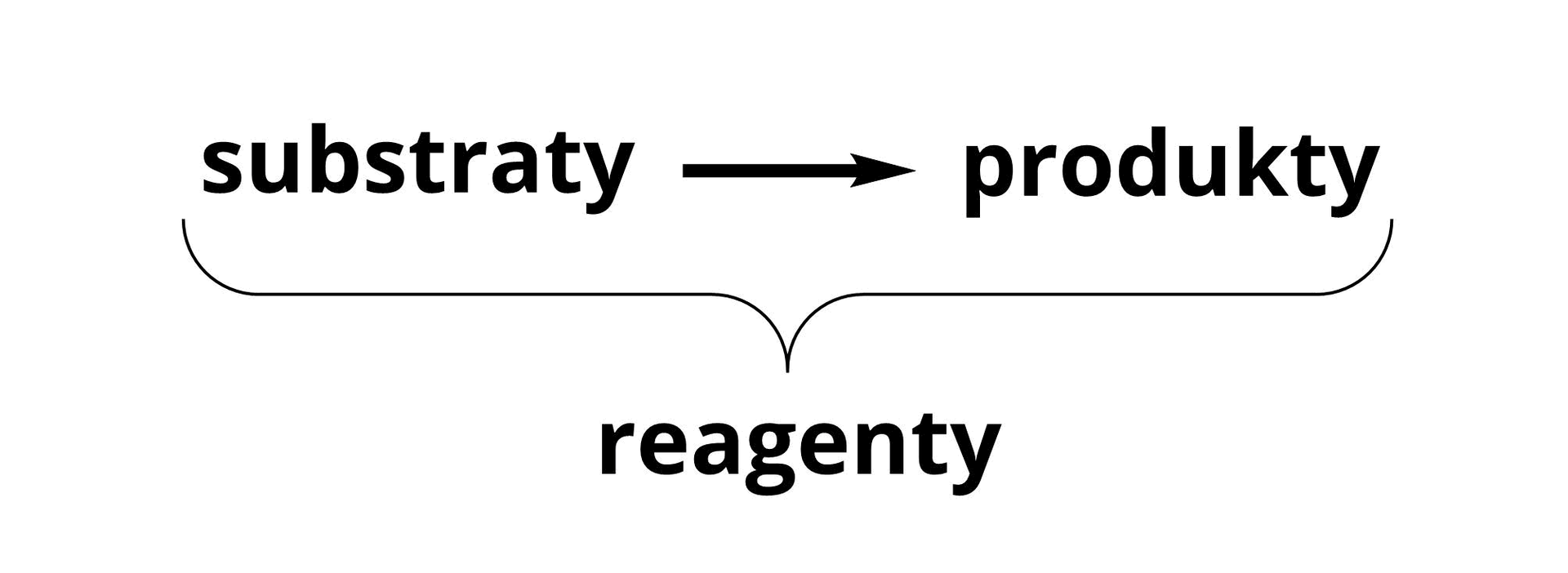
Substancje, które ulegają przemianom w wyniku reakcji chemicznej, to substraty, natomiast te, które w ich wyniku powstają, to produkty. Substraty oraz produkty czasami określamy wspólnie jako reagenty.
Przemianę chemiczną opisuje się za pomocą równania reakcji. Po jego lewej stronie zapisuje się substraty, po prawej zaś produkty. Przy użyciu strzałki zaznacza się kierunek reakcji – od substratów do produktów:
Jak możemy zapisywać równania reakcji chemicznych?
W równaniach reakcji można posługiwać się nazwami pierwiastków i związków chemicznych, ale najczęściej stosuje się symbole pierwiastków i wzory związków chemicznych.
Zapis z użyciem nazw substancji:
Zapis z użyciem symboli i wzorów chemicznych:
W poprawnie zapisanym równaniu, liczby atomów poszczególnych pierwiastków występujących po obu jego stronach są identyczne:

Poniżej przedstawiono słowny zapis równania reakcji, prowadzącej do otrzymania tlenku magnezu.
Przy użyciu symboli i wzorów chemicznych zapisz równanie reakcji magnezu z tlenem, w wyniku której powstaje tlenek magnezu.
Poniżej przedstawiono słowny zapis równania reakcji, prowadzącej do otrzymania tlenku magnezu.
Zaznacz poprawne równanie reakcji magnezu z tlenem, w wyniku której powstaje tlenek magnezu.
Liczba atomów każdego z pierwiastków po obu stronach równania jest taka sama. Równanie reakcji jest zapisane prawidłowo. Mówi się, że jest ono uzgodnione lub zbilansowane. Czynności, które wykonywaliśmy od momentu napisania równania reakcji przy użyciu symboli i wzorów, do uzyskania jego prawidłowego zapisu, nazywa się uzgadnianiem (lub bilansowaniem) równania reakcji.
W jaki sposób uzgodnić równanie reakcji otrzymywania wody z wodoru i tlenu? Zapoznaj się z poniższym filmem, a następnie rozwiąż ćwiczenie.
Film dostępny pod adresem /preview/resource/R2LHSRPgd5atn
Na filmie ukazano, w jaki sposób poprawnie uzgodnić równanie reakcji na przykładzie reakcji wodoru z tlenem.
W jaki sposób interpretujemy równania reakcji chemicznych?
Wszystkie poznane wcześniej reguły dotyczące opisu atomów, cząsteczek, jonów stosujemy również do interpretacji równań reakcji chemicznych, np.:
Jeden atom węgla reaguje z jedną cząsteczką tlenu i powstaje jedna cząsteczka tlenku węgla().
Jedna cząsteczka azotu reaguje z trzema cząsteczkami wodoru i powstają dwie cząsteczki amoniaku.
Dwie cząsteczki jodowodoru rozkładają się i powstaje jedna cząsteczka wodoru i jedna cząsteczka jodu.
W obliczeniach stechiometrycznych najczęściej posługujemy się interpretacją molową równań reakcji. Mol jest jednostką liczności materii – jedną z siedmiu podstawowych wielkości w układzie , podobnie jak masa, długość czy czas. Liczność materii jest miarą liczby drobin zawartych w materii (w przypadku związków o budowie kowalencyjnej) lub jednostek formalnych (w przypadku substancji jonowych). Współczynniki stechiometryczne w równaniach reakcji odpowiadają liczbie moli. Zatem powyższe równania reakcji chemicznych możemy również zinterpretować następująco:
Dwa mole magnezu reagują z jednym molem tlenku węgla() i powstają dwa mole tlenku magnezu i jeden mol węgla.
Jeden mol kwasu siarkowego() reaguje z dwoma molami wodorotlenku sodu i powstaje jeden mol siarczanu() sodu oraz dwa mole wody.
Jeden mol węgla reaguje z jednym molem tlenu i powstaje jeden mol tlenku
węgla().
Jeden mol azotu reaguje z trzema molami wodoru i powstają dwa mole amoniaku.
Dwa mole jodowodoru rozkładają się i powstaje jeden mol wodoru i jeden mol jodu.
Dwa mole magnezu reagują z jednym molem tlenku węgla() i powstają dwa mole tlenku magnezu oraz jeden węgla.
\ Jeden mol kwasu siarkowego() reaguje z dwoma molami wodorotlenku sodu i powstaje jeden mol siarczanu() sodu oraz dwa mole wody.
Poćwicz interpretację zapisów chemcznych
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D5KSX4N1p