Gazy szlachetne - właściwości i zastosowania
Poniższy materiał stanowi uzupełnienie treści zawartych w materiale: https://zpe.gov.pl/a/gazy-szlachetne/DOD8hfNGQ
Szlachetność pierwiastków chemicznych przejawia się w ich bierności (niewielkiej aktywności) chemicznej. Z czego wynika bierność chemiczna gazów szlachetnych? Jakie właściwości fizykochemiczne posiadają te gazy? Czy pomimo swojej niewielkiej aktywności gazy szlachetne znalazły jakieś zastosowania? Odpowiedź na te pytania ułatwi Ci analiza poniższego materiału.
przykłady właściwości fizycznych i chemicznych substancji;
nazwy i symbole pierwiastków chemicznych należących do gazów szlachetnych;
definicje: atom, izotop promieniotwórczy, pierwiastek promieniotwórczy oraz promieniotwórczość;
budowę atomu;
zależność pomiędzy budową atomu a położeniem pierwiastka w układzie okresowym;
skład powietrza.
projektować i przeprowadzać doświadczenie pozwalające na zbadanie niektórych właściwości fizykochemicznych wybranych gazów szlachetnych;
wyjaśniać, dlaczego gazy szlachetne są bierne chemicznie;
omawiać związek pomiędzy wybranymi właściwościami fizykochemicznymi gazów szlachetnych a ich zastosowaniem.
Gazy szlachetne jako pierwiastki chemiczne będące składnikami powietrza
Do gazów szlachetnychgazów szlachetnych zaliczamy pierwiastki chemiczne położone w grupie układu okresowego, z wyłączeniem pierwiastka o nazwie oganeson. Na chwilę obecną właściwości oganesonu nie poznano wystarczająco dobrze, ale wydają się być one znacznie różne od pozostałych pierwiastków chemicznych, należących do grupy (przewiduje się, że pierwiastek ten w warunkach normalnychwarunkach normalnych byłby ciałem stałym).
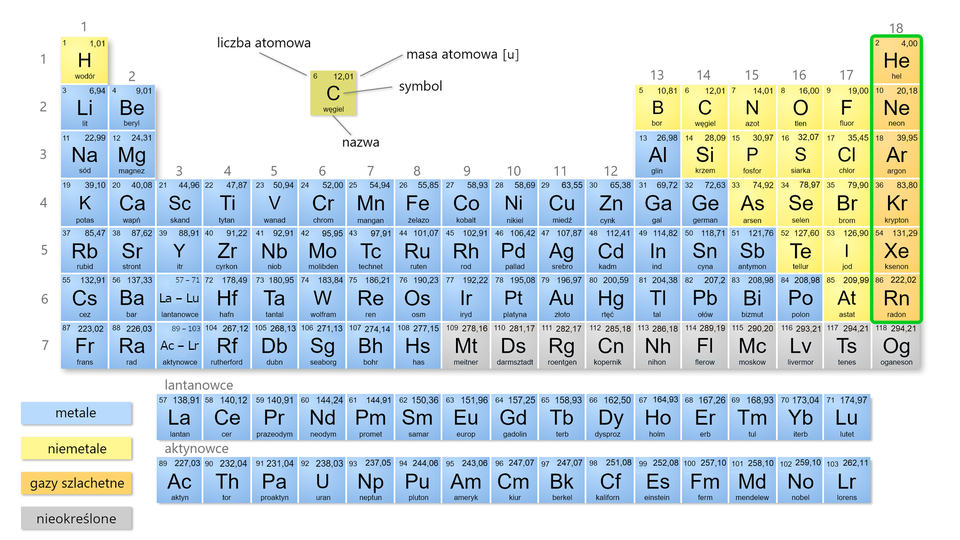
Jak sama nazwa wskazuje, pierwiastki należące do gazów szlachetnych są w warunkach normalnych gazami. Ich zawartość na Ziemi, gdzie występują głównie w atmosferze, jest stosunkowo niewielka. W poniższej tabeli przedstawiono zawartości wybranych gazów (w tym gazów szlachetnych) w suchym powietrzu (w procentach objętościowych).
Symbol/wzór gazu | ||||||||
|---|---|---|---|---|---|---|---|---|
objętości powietrza |
Indeks górny Zawartość procentowa wybranych gazów w suchym powietrzu. Źródło: Orlińska I., Orliński K., Na krańcu układu – gazy szlachetne, [w:] Chemia w szkole, Warszawa 2018, nr 3, s. 10 Indeks górny koniecZawartość procentowa wybranych gazów w suchym powietrzu. Źródło: Orlińska I., Orliński K., Na krańcu układu – gazy szlachetne, [w:] Chemia w szkole, Warszawa 2018, nr 3, s. 10
Zwróć uwagę, że w tabeli, przedstawiającej zawartość poszczególnych gazów w powietrzu, nie wymieniono radonu. Gaz ten nie jest naturalnym składnikiem powietrza, choć może być w nim obecny w bardzo małych ilościach, zależnych od miejsca pomiaru. Największe stężenie radonu odnotowuje się zwykle w okolicach kopalń. Radon jest bowiem pierwiastkiem promieniotwórczympierwiastkiem promieniotwórczym (będącym mieszaniną radionuklidówradionuklidów), który stanowi końcowy produkt rozpadu złóż uranu i toru.
Jak już wspomniano, ogenesonu nie zalicza się do gazów szlachetnych, choć tak naprawdę dane o właściwościach fizykochemicznych tego pierwiastka są jedynie przypuszczalne – opracowane jedynie na podstawie założeń i obliczeń.
Oganeson otrzymano w na drodze fuzji jądrowej między jądrami atomów kalifornu i wapnia, opisanej poniższym równaniem:
Badania prowadzono w tak zwanym „zagłębiu pierwiastkowym”, czyli w Zjednoczonym Instytucie Badań Jądrowych w Dubnej (Rosja). Sama zaś nazwa „oganeson” wywodzi się od nazwiska kierownika zespołu badawczego – Jurija Cołakiewicza Oganesjana.

Atomy tego pierwiastka chemicznego są bardzo niestabilne i nie jest możliwe doświadczalne zbadanie jego właściwości – czas połowicznego rozpadu oganesonu szacowany jest na około milisekundy (). Z tego względu, choć przewiduje się, że oganeson jest ciałem stałym, raczej nigdy nie zobaczymy i nie zbadamy jego próbki (tak jak możemy to zrobić w przypadku choćby siarki czy miedzi).
Wybrane właściwości fizykochemiczne gazów szlachetnych.
Przeprowadź eksperyment w wirtualnym laboratorium. Przyjrzyj się dostępnym w nim odczynnikom i sprzętowi laboratoryjnemu. Zastanów się, jakie właściwości fizykochemiczne gazów szlachetnych można zbadać, mając do dyspozycji wspomniane wyposażenie laboratorium. Wykonaj odpowiednie eksperymenty, a w ich trakcie uzupełnij dziennik laboratoryjny (polecenie ). Następnie, na podstawie prób przeprowadzonych w wirtualnym laboratorium, wykonaj polecenia od do .
W wirtualnym laboratorium dostępne są trzy doświadczenia mające na celu zbadanie właściwości fizykochemicznych gazów szlachetnych: helu, neonu, argonu, kryptonu i ksenonu.
W doświadczeniu pierwszym do dyspozycji jest następujący sprzęt laboratoryjny: tablica ze świetlówkami, przewody elektryczne, generator prądu.
Na tablicy ze świetlówkami za pomocą przewodów łączone są szeregowo poszczególne świetlówki wypełnione gazami szlachetnymi. Następnie do tablicy podłączane jest źródło prądu, zamykając obwód. Po uruchomieniu generatora można zaobserwować świecenie gazów szlachetnych wewnątrz świetlówek. Hel świeci na żółty lub pomarańczowy kolor, neon świeci kolorem czerwono pomarańczowym, argon na kolor fioletowy, krypton świeci się na jasny bladoniebieski kolor, a ksenon świeci światłem niebiesko fioletowym.
W doświadczeniu drugim do dyspozycji jest następujący sprzęt: zbiorniki z badanymi gazami, wężyk gumowy, balony gumowe.
Balon umieszczany jest na stojaku, a koniec wężyka mocowany jest pod balonem, tak, aby gaz wylatujący z wężyka napełniał balon. Drugi koniec wężyka podłączany jest do zbiornika z gazem szlachetnym. Po odkręceniu zaworu zbiornika, balon jest napełniany gazem. Następnie zawór jest zakręcany, a balon zdejmowany ze stojaka i jego otwór zawiązywany. Balony są kolejno puszczane swobodnie, aby sprawdzić czy gazy są cięższe czy lżejsze od powietrza. Balony napełnione helem i neonem unoszą się w górę, natomiast balony napełnione argonem, kryptonem lub ksenonem opadają na ziemię.
W doświadczeniu trzecim do dyspozycji jest następujący sprzęt: zbiorniki z badanymi gazami, wężyk gumowy, probówki z korkiem, łuczywo, zapalarka.
Do probówki umieszczonej na stojaku wpuszczany jest gaz za pomocą wężyka. Dla helu i neonu, probówka ustawiana jest dnem do góry, dla argonu, kryptonu i ksenonu ustawia się ją dnem do dołu. Zawór zbiornika jest odkręcany i gaz jest wpuszczany do probówki. Badane gazy są bezbarwne, nie widać więc jaka część probówki jest nimi napełniana. Następnie zwór jest zakręcany a probówka zatykana korkiem. Łuczywo jest podpalane zapalarką a następnie ostrożnie umieszczane w gazie znajdującym się w probówce. We wszystkich pięciu przypadkach ogień szybko gaśnie wewnątrz probówki.
Wszystkie gazy szlachetne charakteryzują się podobnymi właściwościami fizykochemicznymi. W pewnym laboratorium chemicznym, z zachowaniem wszelkich środków ostrożności, do probówki wypełnionej radonem wprowadzono zapalone łuczywo.
Napisz, jakich obserwacji należy spodziewać się w doświadczeniu wykonanym we wspomnianym laboratorium i o jakich właściwościach radonu świadczą te obserwacje.
Uwaga: Podczas pracy z radonem należy zachować wszelkie środki ostrożności. Wg raportu Agencji Ochrony Środowiska Stanów Zjednoczonych z radon stanowił drugą (po paleniu tytoniu) przyczynę raka płuc u tamtejszych mieszkańców.
Jak zapewne udało Ci się wykazać w wirtualnym laboratorium, badane w nim substancje (hel, neon, argon, krypton i ksenon) to bezbarwne, niepalne i nie podtrzymujące spalania gazy. Do listy ich „wspólnych” właściwości należy również dopisać, że są to gazy bezwonne, bez smaku, praktycznie nierozpuszczalne w wodzie. Takimi samymi właściwościami charakteryzuje się również radon.
Gazy szlachetne pod wpływem wyładowań elektrycznych emitują światło widzialne. Barwy światła emitowanego przez poszczególne gazy szlachetne, pod wpływem wyładowań elektrycznych, przedstawiono na poniższej grafice.
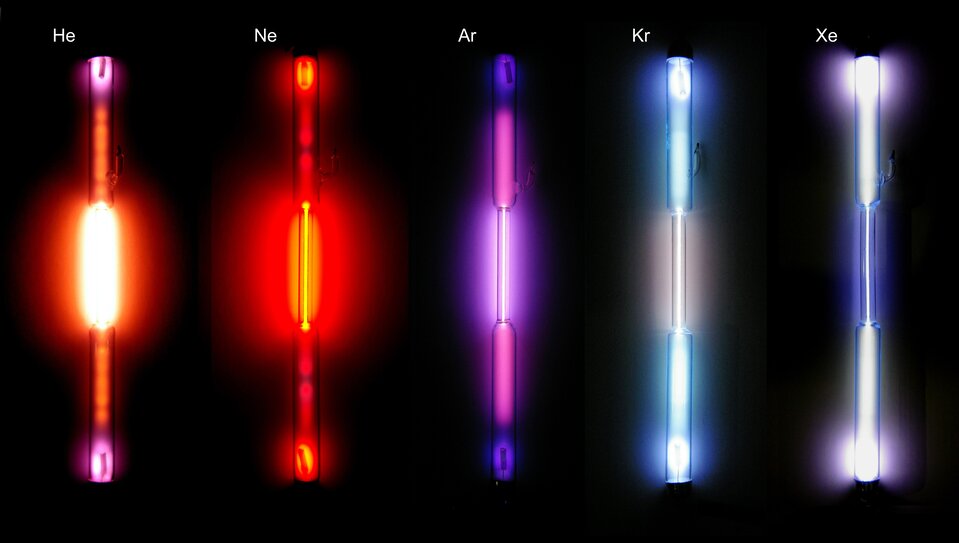
W momencie kiedy przez gaz szlachetny zaczyna płynąć prąd o odpowiednich parametrach, elektrony walencyjne w atomach tego gazu zostają wybijane ze swoich poziomów energetycznych, co wiąże się ze wzrostem ich energii. Powracające „na swoje miejsca” elektrony, pozbywają się nadmiarowej energii, emitując ją na sposób światła.
Gazy szlachetne charakteryzują się zróżnicowaną gęstością, przewodnością cieplnąprzewodnością cieplną oraz temperaturami wrzenia i topnienia. Wartości wymienionych wielkości fizycznych dla gazów szlachetnych zestawiono w poniższej tabeli. Dla porównania, w tabeli zamieszczono również przybliżone dane dotyczące suchego powietrza pod ciśnieniem atmosferycznym. Dzięki niskim wartościom przewodności cieplnej niektóre z gazów szlachetnych znalazły zastosowanie w produkcji szyb zespolonych, czyli szyb termoizolacyjnych. Szyby te składają się z dwóch lub więcej tafli szkła płaskiego, pomiędzy którymi powstaje hermetycznie zamknięta przestrzeń międzyszybowa. Przestrzeń ta wypełniona jest gazem szlachetnym (najczęściej argonem) lub suchym powietrzem, co powoduje zmniejszenie przewodności cieplnej.
Symbol gazu szlachetnego | Gęstość, | Temperatura wrzenia, | Temperatura topnienia, | Przewodność cieplna, |
|---|---|---|---|---|
nie ulega zestaleniu pod ciśnieniem normalnym | ||||
powietrze |
Indeks górny Wybrane właściwości fizyczne gazów szlachetnych i powietrza. Dla porównania, gęstość wody w temperaturze pokojowej wynosi około . Dane z tabeli pochodzą ze stron Wikipedii dotyczących poszczególnych gazów szlachetnych/powietrza. Przewodność cieplna powietrza – dana ze strony: https://www.muratorplus.pl/. Indeks górny koniecWybrane właściwości fizyczne gazów szlachetnych i powietrza. Dla porównania, gęstość wody w temperaturze pokojowej wynosi około . Dane z tabeli pochodzą ze stron Wikipedii dotyczących poszczególnych gazów szlachetnych/powietrza. Przewodność cieplna powietrza – dana ze strony: https://www.muratorplus.pl/.
W wirtualnym laboratorium wykazano, że badane w nim helowce są niepalnymi gazami. Innymi słowy, nie reagują one z tlenem. Gazy szlachetne charakteryzują się bardzo małą aktywnością chemiczną – są obojętne (odporne) na działanie większości substancji chemicznych, stąd ich nazwa szlachetne.
Za właściwości chemiczne pierwiastków odpowiedzialne są między innymi elektrony walencyjne w ich atomach. Dlatego też, aby odpowiedzieć na pytanie, z czego wynika bierność chemiczna gazów szlachetnych, należy przyjrzeć się konfiguracjom elektronowym ich atomów.
pierwiastek | konfiguracja elektronowa atomu | konfiguracja elektronowa atomu | konfiguracja elektronowa poziomu walencyjnego |
|---|---|---|---|
hel | 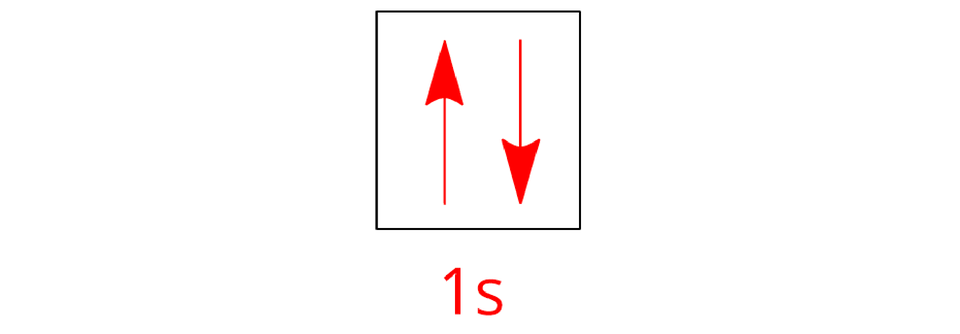 Konfiguracja elektronowa helu Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | ||
neon | 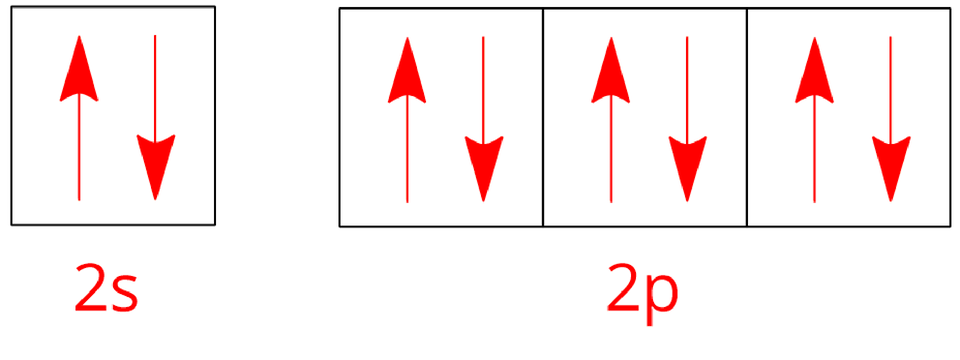 Konfiguracja elektronowa neonu Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | ||
argon | 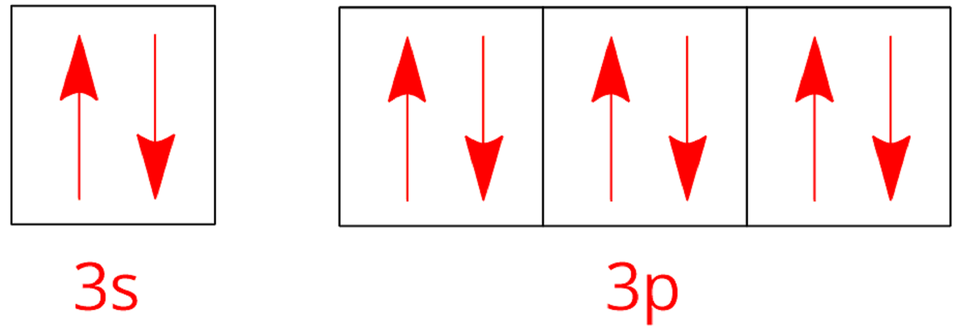 Konfiguracja elektronowa argonu Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | ||
krypton | 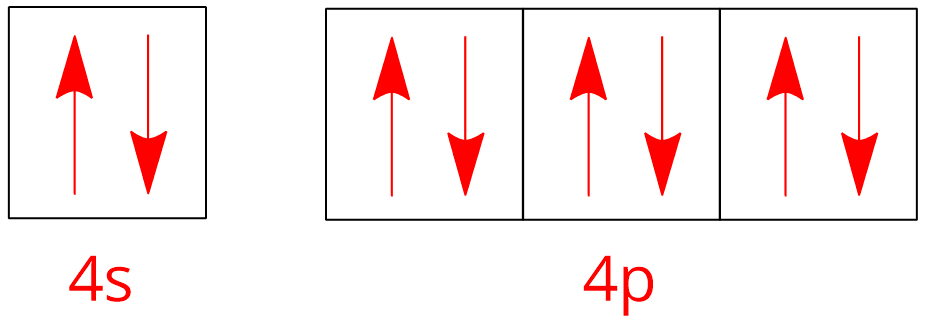 Konfiguracja elektronowa kryptonu Źródło: GroMar sp. z o. o., licencja: CC BY-SA 3.0. | ||
ksenon | 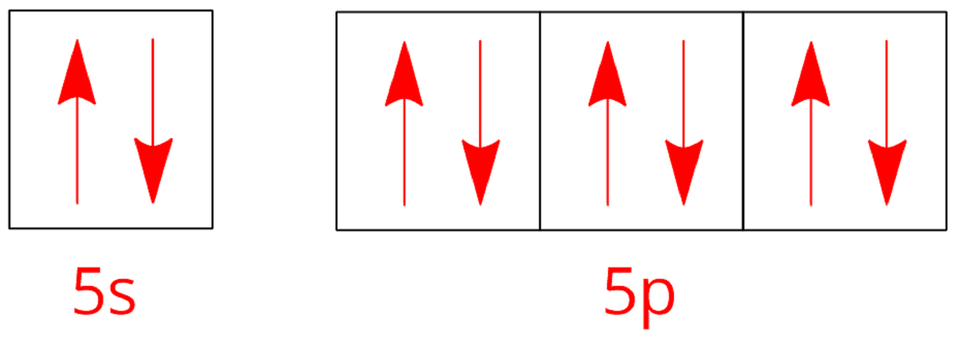 Konfiguracja elektronowa ksenonu Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | ||
radon | 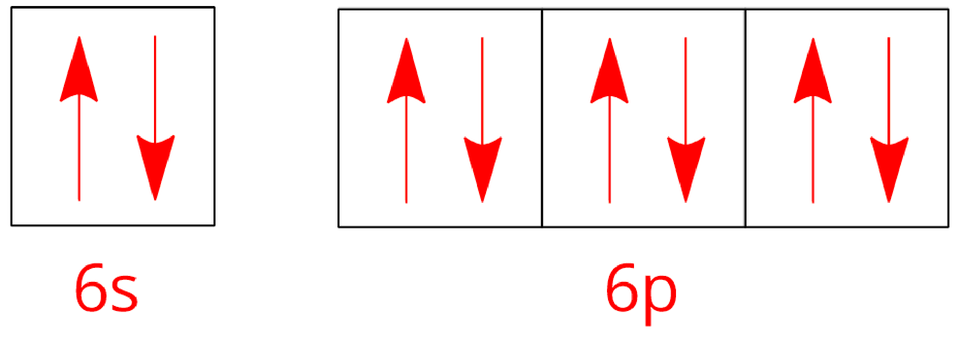 Konfiguracja elektronowa radonu Źródło: GroMar sp. z o. o., licencja: CC BY-SA 3.0. |
Indeks górny Konfiguracje elektronowe atomów wybranych gazów szlachetnych. Na czerwono zaznaczono elektrony walencyjne atomów poszczególnych helowców. Indeks górny koniecKonfiguracje elektronowe atomów wybranych gazów szlachetnych. Na czerwono zaznaczono elektrony walencyjne atomów poszczególnych helowców.
Zwróć uwagę, że konfiguracje poziomów walencyjnych atomów poszczególnych gazów szlachetnych są do siebie podobne. Choć wydaje się, że wyjątkiem jest tutaj hel, to zarówno w jego atomach, jak i w atomach pozostałych gazów szlachetnych nie ma niesparowanych elektronów (na każdym poziomie energrtycznym (w jednej klatce) znajdują się dwa elektrony).
Konfiguracja elektronowa, jaką posiadają atomy gazów szlachetnych, jest bardzo trwała (stabilna) energetycznie. To między innymi brak niesparowanych elektronów utrudnia atomom helowców tworzenie cząsteczek zarówno z atomami tego samego gazu szlachetnego, jak i z innymi pierwiastkami chemicznymi. Dlatego też gazy szlachetne, w przeciwieństwie do innych gazowych pierwiastków wchodzących w skład powietrza (tlenu i azotu), nie tworzą cząsteczek – występują w powietrzu w formie atomowej.
Pomimo swojej bierności chemicznej, gazy szlachetne w odpowiednich warunkach ciśnienia i temperatury mogą tworzyć pewne związki chemiczne z innymi pierwiastkami. Wzory sumaryczne wybranych związków chemicznych helowców zamieszczono poniżej:
Ze względu na bardzo małą gęstość helu, prędkość rozchodzenia się dźwięku w tym gazie jest niemal trzykrotnie większa niż prędkość rozchodzenia się dźwięku w powietrzu (w tych samych warunkach).
gaz | prędkość rozchodzenia się dźwięku, |
|---|---|
hel | |
powietrze |
Indeks górny Prędkość rozchodzenia się dźwięku w helu i w powietrzu w temperaturze pokojowej. Źródło: https://pl.wikipedia.org/. Indeks górny koniecPrędkość rozchodzenia się dźwięku w helu i w powietrzu w temperaturze pokojowej. Źródło: https://pl.wikipedia.org/.
Dlatego też, jeśli w płucach człowieka znajdzie się hel, ton jego głosu będzie nienaturalnie wysoki. Wynika to z faktu szybszego drgania poszczególnych części ośrodka mowy.
Posłuchaj poniższego nagrania.
Nagranie dostępne pod adresem https://zpe.gov.pl/a/D5noH5gm9
Nagranie
Jeśli masz możliwość samodzielnego sprawdzenia tonu swojego głosu po wdychaniu helu, zrób to, ale zachowaj ostrożność. Koniecznie sprawdź, czy hel, którego zamierzasz użyć, nie jest zanieczyszczony. Pamiętaj, że do wykonania próby wystarczy jeden wdech helu – czystym helem nie wolno oddychać.
Wybrane zastosowania gazów szlachetnych
W poniższej galerii zdjęć omówiono wybrane zastosowania gazów szlachetnych, wynikające z ich właściwości fizykochemicznych. Zapoznaj się z nimi.
Indeks górny Wybrane zastosowania gazów szlachetnych. Indeks górny koniecWybrane zastosowania gazów szlachetnych.
Mieszanina helu z tlenem (tak zwany Heliox) stosowana jest przez nurków jako gaz do oddychania w czasie nurkowania. Hel rozpuszcza się we krwi wolniej niż azot, który to przy gwałtownej zmianie ciśnienia (np. podczas szybkiego wynurzania się z wody) wydziela się z krwi w postaci pęcherzyków, które mogą zamykać naczynia krwionośne.
Krypton i ksenon wykorzystuje się również w diagnostyce rentgenowskiej.
Co ciekawe, zastosowanie w medycynie znalazł również szkodliwy dla zdrowia radon. W niewielkich, kontrolowanych ilościach, można wykorzystać radon między innymi w tak zwanych kąpielach radonowych, zalecanych w leczeniu cukrzycy i chorób tarczycy. Pamiętaj jednak, że długotrwałe przebywanie w miejscach, w których stężenie radonu w powietrzu jest duże, zwiększa ryzyko zachorowania na raka płuc.
Słownik
inaczej helowce; niemetale położone w grupie układu okresowego (do gazów szlachetnych nie zalicza się oganesonu); w warunkach normalnych bezbarwne, bezwonne gazy, występujące w postaci atomów – w przeciwieństwie do innych gazowych pierwiastków chemicznych (między innymi azotu), nie tworzą cząsteczek; substancje bierne (mało aktywne) chemicznie; mała aktywność gazów szlachetnych wynika ze stabilnych (trwałych) energetycznie konfiguracji elektronowych ich atomów
temperatura () i ciśnienie ()
pierwiastek chemiczny, który nie posiada trwałych izotopów; pierwiastek promieniotwórczy jest mieszaniną izotopów promieniotwórczych (radionuklidów)
izotopy promieniotwórcze; izotopy, których jądra atomowe ulegają samorzutnym rozpadom, przekształcając się w jądra atomowe innych izotopów; rozpadowi jądra atomowego izotopu promieniotwórczego zawsze towarzyszy emisja promieniowania
właściwość fizyczna opisująca zdolność danej substancji do przekazywania energii na sposób ciepła; im większą przewodnością cieplną charakteryzuje się substancja, tym więcej ciepła może przez nią przepłynąć w określonej jednostce czasu w zadanych warunkach; jednostką przewodności cieplnej w układzie jest (czytaj: dżul na metr razy sekundę razy kelwin), ale często wielkość tę przedstawia się z jednostką (czytaj: wat na metr razy kelwin)
Ćwiczenia
Uczeń miał za zadanie napełnić probówkę gazowym helem. Poniżej znajduje się schemat zestawu doświadczalnego, jaki przygotował uczeń.
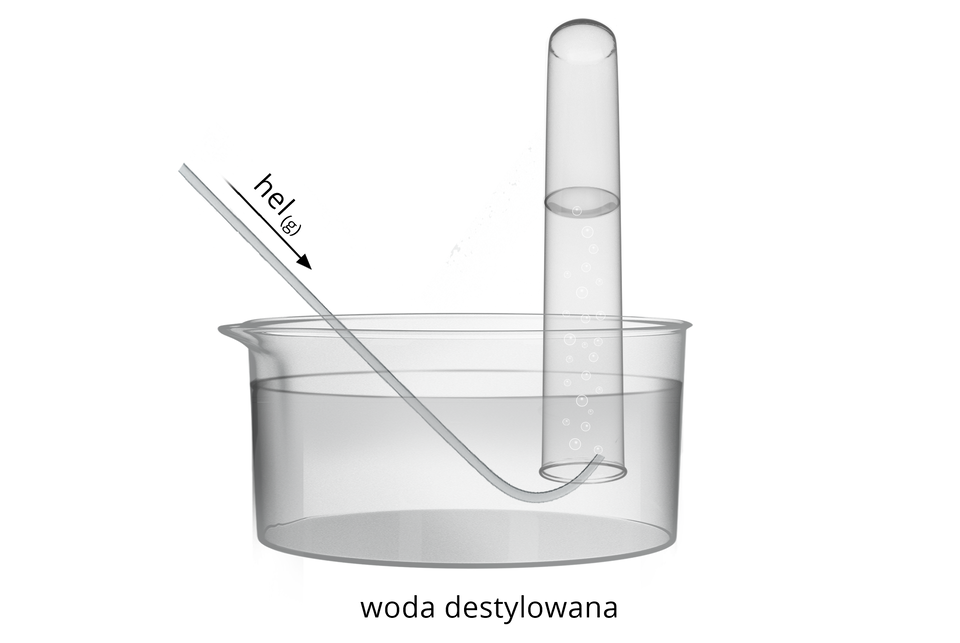
Uczeń miał za zadanie napełnić probówkę gazowym helem. Zestaw doświadczalny, przygotowany przez ucznia składał się ze zlewki wypełnionej wodą destylowaną, w której zanurzony był wylot probówki odwróconej dnem do góry. Do wylotu probówki włożono rurkę, przez którą wprowadzany miał być hel.
Uczeń przygotował dwa baloniki. Jeden z nich napełnił helem, a drugi argonem, każdorazowo zawiązując wylot balonika. Następnie wypuścił obydwa baloniki z rąk.
Zastanów się i odpowiedz na pytanie, jakich obserwacji powinien spodziewać się uczeń. Określ, jaką właściwość helu i argonu badał uczeń i sformułuj odpowiedni wniosek.
Bibliografia
Bielański A., Podstawy chemii nieorganicznej 2, Warszawa 2007.
Encyklopedia PWN
Orlińska I., Orliński K., Na krańcu układu – gazy szlachetne, „Chemia w szkole” 2018, nr 3, s. 6‑15.