Właściwości węglowodorów nienasyconych
Gdy zanurzymy suchą gąbkę w wodzie, gąbka „nasyci się” nią, czyli ją pochłonie. Czy węglowodory nienasycone też mogą coś „pochłonąć”? Czy w wyniku reakcji chemicznej mogą stać się związkami nasyconymi? W jaki sposób możemy wyjaśnić odbarwianie roztworu bromu?
w jaki sposób tworzy się wzory ogólne szeregu homologicznego węglowodorów;
w jaki sposób zapisuje się wzór sumaryczny węglowodoru o podanej liczbie atomów węgla;
jakie związki nazywamy alkanami, a jakie – alkenami i alkinami.
jakie właściwości mają eten i etyn;
projektować doświadczenie pozwalające odróżnić węglowodory nasycone od nienasyconych.
1. Właściwości fizyczne alkenów
Przedstaw dane z . w postaci wykresu słupkowego, uwzględniając zależność liczby atomów węgla od temperatury wrzenia i topnienia. Porównaj je z wartościami w przypadku alkanów.
Zbuduj wszystkie możliwe modele cząsteczki butenu i porównaj je ze sobą.
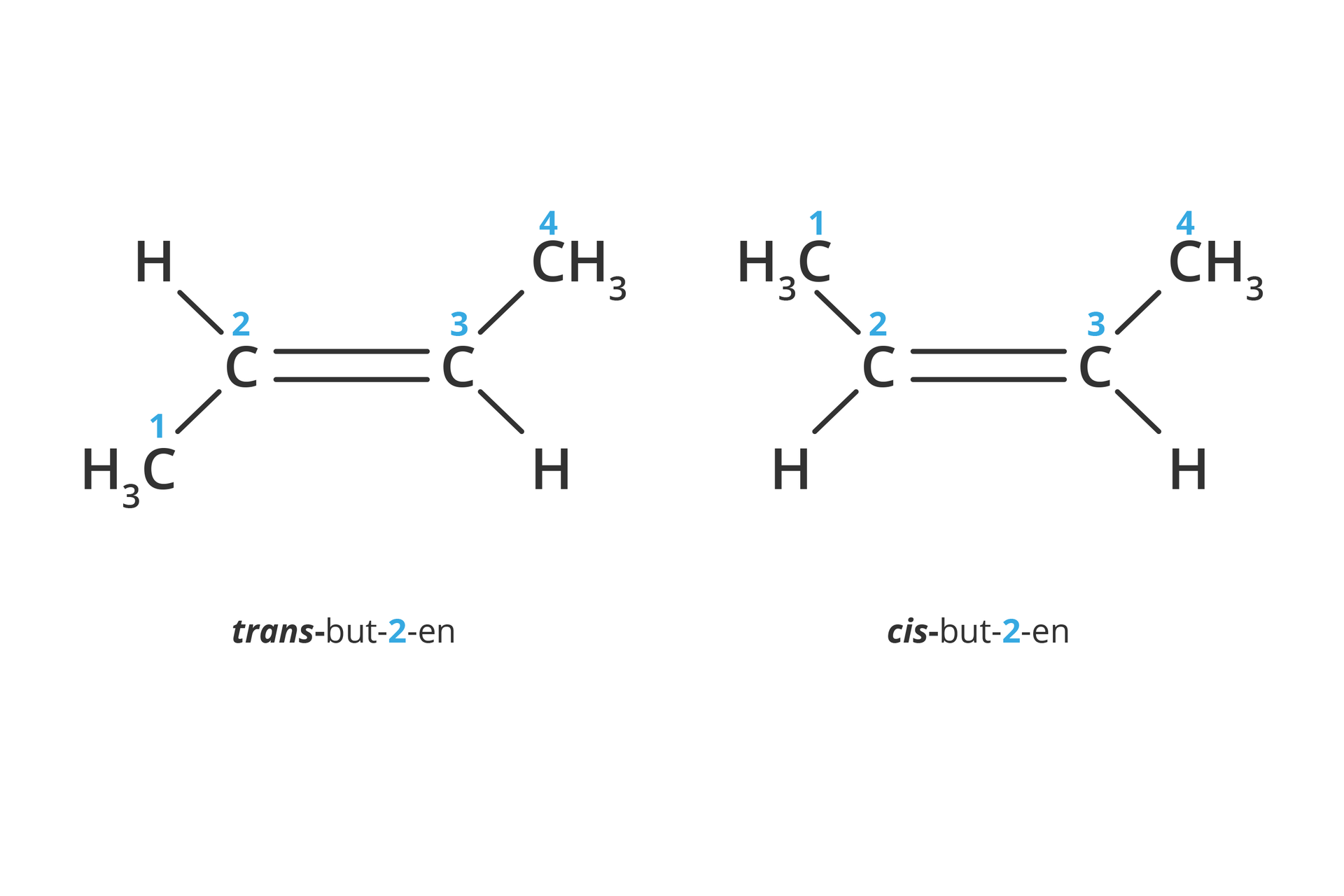
Alkeny zawierające wiązanie podwójne przy innym niż pierwszy atom węgla w łańcuchu mogą występować w formie izomerów cis- (obie grupy metylowe – podstawniki znajdują się po tej samej stronie płaszczyzny, w której leży wiązanie) i izomerów trans- (podstawniki znajdują się po przeciwnych stronach płaszczyzny).
Od rodzaju wiązań, jakie tworzą atomy węgla w cząsteczkach związków organicznych, zależą właściwości tych związków ().
Alken | Wzór chemiczny | Temperatura wrzenia | Temperatura topnienia | Gęstość (g·cmIndeks górny -3-3) |
buten | -6,2 | -185,3 | 0,588 | |
buten | 0,8 | -105,5 | 0,599 | |
buten | 3,7 | -138,9 | 0,616 |
Właściwości fizyczne alkenów są podobne do właściwości odpowiednich alkanów. Zmieniają się wraz ze wzrostem liczby atomów węgla w ich cząsteczkach – przechodzą od stanu gazowego, poprzez ciekły, do stanu stałego. Alkeny, podobnie jak alkany, są bezbarwne i bardzo trudno rozpuszczają się w wodzie. Temperatura wrzenia i topnienia zależy w ich przypadku od długości łańcucha węglowego oraz budowy. Węglowodory o łańcuchu rozgałęzionym mają niższe temperatury wrzenia. W temperaturze 20°C i pod ciśnieniem 1013 hPa pierwsze trzy alkeny, mające po 2–4 atomy węgla w cząsteczce, to gazy. Kolejne, zawierające od 5 do 10 atomów węgla w cząsteczce, są cieczami, a mające 11 i więcej atomów węgla w cząsteczce – ciałami stałymi.
Przypomnij, o czym informują piktogramy umieszczone na opakowaniach etenu, propenu i butenu.

2. Właściwości chemiczne alkenów
Doświadczenie należy przeprowadzać w okularach ochronnych.
Jak spala się eten?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Eten spala się wybuchowo.
Eten spala się całkowicie.
Eten spala się niecałkowicie.
probówka z zebranym etenem zamknięta korkiem,
łuczywo.
Wyjmij korek z probówki napełnionej etenem.
Do wylotu probówki zbliż palące się łuczywo.
Obserwuj zachodzące zmiany.
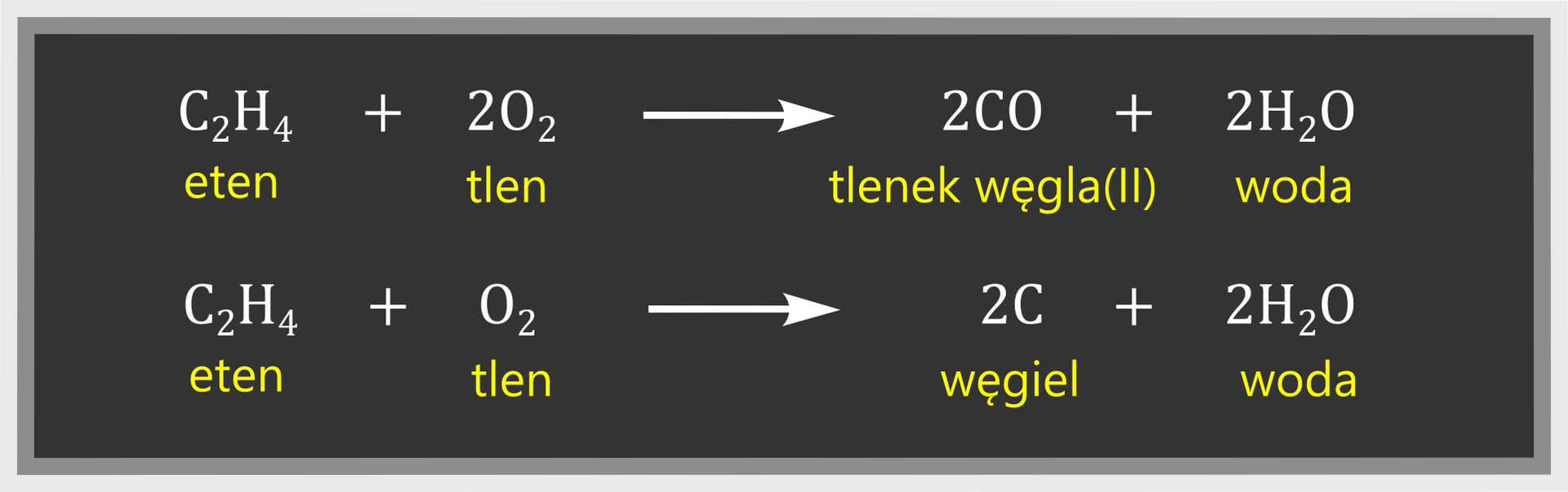
Eten jest gazem palnym. Przy pełnym dostępie powietrza spala się spokojnym płomieniem. Zachodzi wówczas spalanie całkowite:

Przy ograniczonym dostępie tlenu zachodzi spalanie niecałkowite, a płomień jest kopcący:
Czy eten reaguje z bromem?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Eten nie reaguje z bromem.
Eten reaguje z bromem.
dwie probówki (w tym jedna z etenem),
korek,
roztwór bromu.
Do pierwszej probówki wlej do 1/3 jej objętości roztwór bromu (próba kontrolna).
Do drugiej probówki (z zebranym etenem) wlej taką samą ilość roztworu bromu. Probówkę zamknij korkiem i dobrze wymieszaj przez wytrząsanie.
Obserwuj zachodzące zmiany.
Porównaj barwę obu probówek.
R1OeJneCZ1XHy1  Źródło: Tomorrow Sp. z o.o., licencja: CC BY-SA 3.0.
Źródło: Tomorrow Sp. z o.o., licencja: CC BY-SA 3.0.
Eten jest związkiem o dużej reaktywności. Odbarwia roztwór bromu. Przyczyną dużej reaktywności jest wiązanie podwójne.
Reakcja etenu z bromem w środowisku bezwodnym przebiega zgodnie z równaniem:
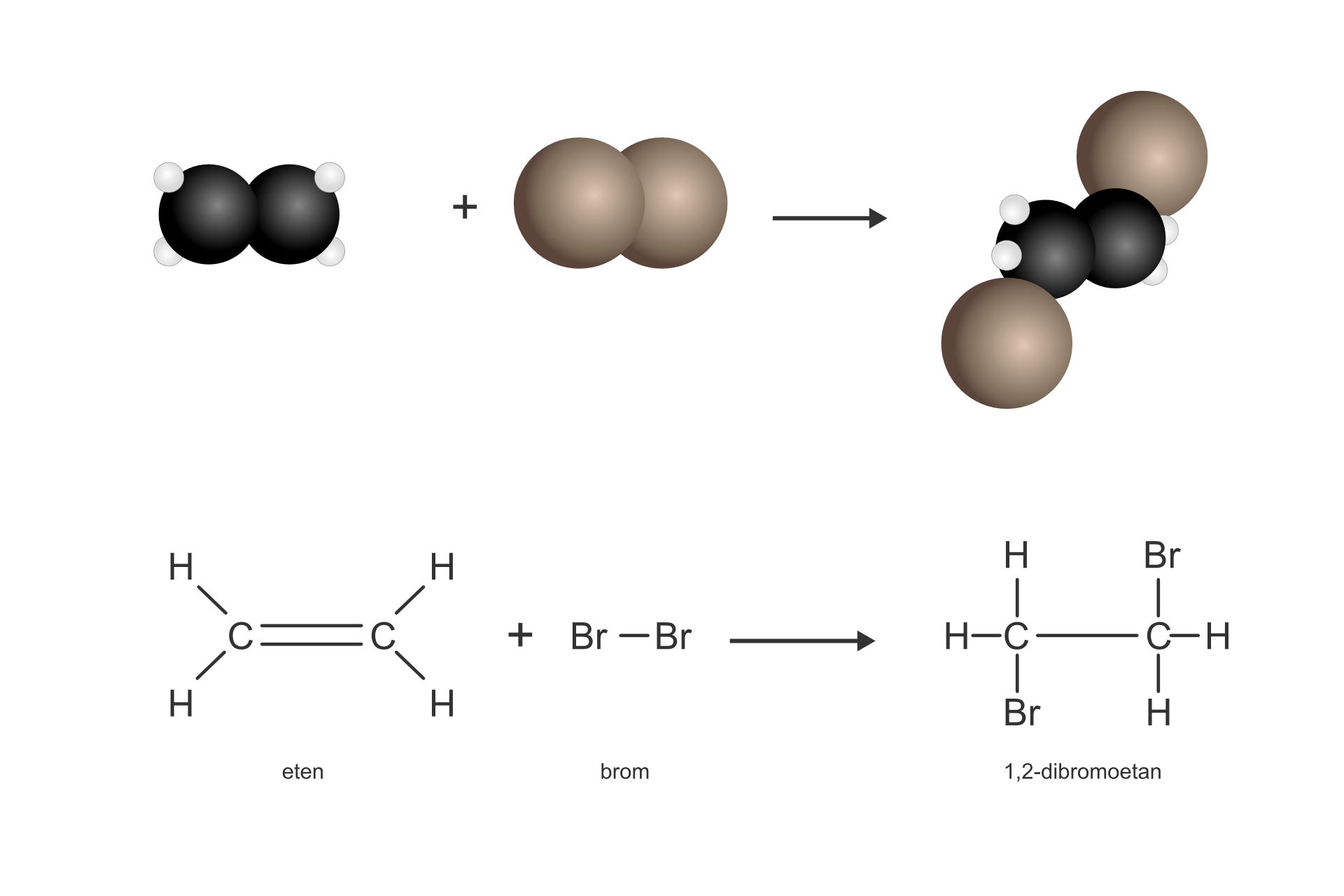
W wyniku tej reakcji zerwaniu ulega wiązanie wielokrotne i powstaje związek nasycony dibromoetan (przedrostek di- informuje, że w cząsteczce znajdują się dwa atomy bromu). Ten typ reakcji nazywamy reakcją addycjireakcją addycji, czyli przyłączenia.
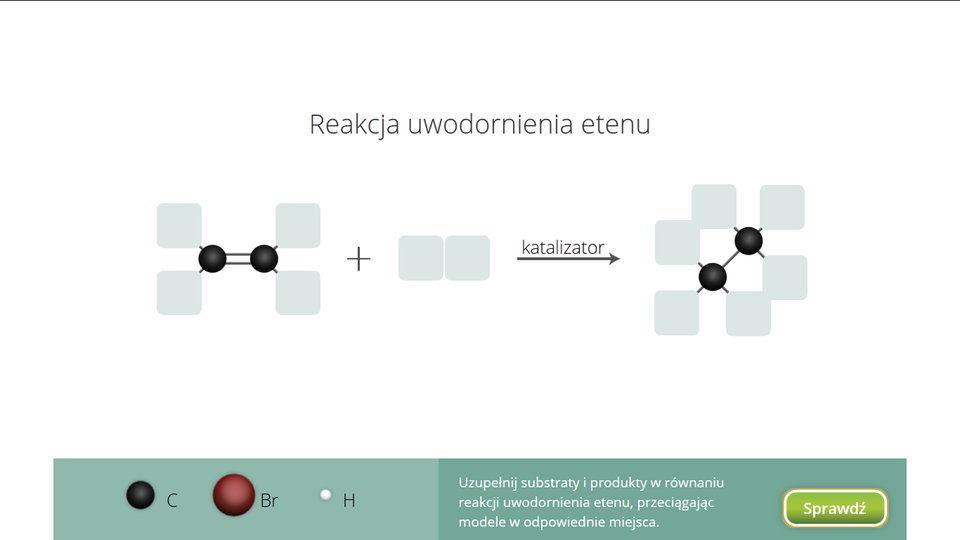
W odpowiednich warunkach alkeny mogą przyłączyć także wodór. Reakcję taką nazywamy reakcją uwodornieniareakcją uwodornienia.
Reakcja etylenu z wodorem przebiega zgodnie z równaniem:

3. Węglowodory nienasycone – alkiny
Przedstaw w postaci wykresu liniowego dane z tabel 1. (seria 1.) oraz 2. (seria 2.), uwzględniając zależność liczby atomów węgla od temperatury wrzenia i topnienia. ()
Alkiny | Wzór chemiczny | Temperatura wrzenia | Temperatura topnienia | Gęstość (g·cmIndeks górny -3-3) |
etyn | -84,7 | -80,7 | 0,377 w temp. 25°C | |
propyn | -23,2 | -102,7 | 0,607 w temp. 25°C | |
butyn | 8,0 | -125,7 | 0,678 w temp. 0°C | |
butyn | 26,9 | -32,2 | 0,691 w temp. 20°C |
Właściwości fizyczne alkinów zmieniają się wraz ze wzrostem liczby atomów węgla w ich cząsteczkach – przechodzą od stanu gazowego, poprzez ciekły, do stanu stałego. Alkiny, podobnie jak alkany i alkeny, są bezbarwne i bardzo trudno rozpuszczają się w wodzie. Temperatura wrzenia i topnienia w ich przypadku zwiększa się wraz ze wzrostem liczby atomów węgla w cząsteczce. W temperaturze 20°C i pod ciśnieniem 13 hPa pierwsze trzy alkiny, o 2–4 atomach węgla w cząsteczce, są gazami.
4. Właściwości chemiczne alkinów
Doświadczenie należy przeprowadzać w okularach ochronnych.
Jak spala się etyn?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Etyn spala się wybuchowo.
Etyn spala się całkowicie.
Etyn spala się niecałkowicie.
probówka z zebranym etynem zamknięta korkiem,
łuczywo.
Zdejmij korek z probówki napełnionej etynem.
Do wylotu probówki zbliż palące się łuczywo.
Obserwuj zachodzące zmiany.
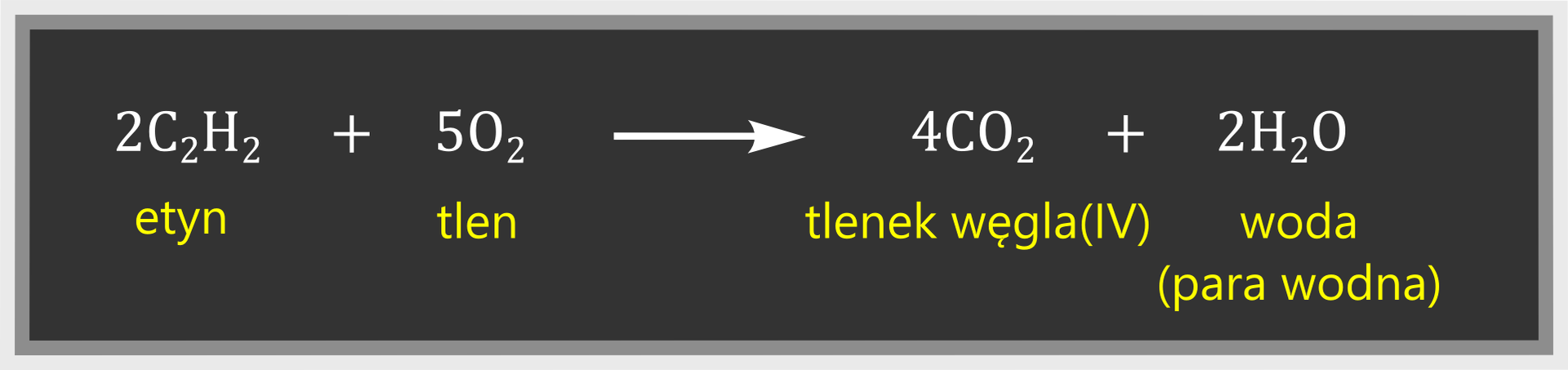
Etyn jest gazem palnym. W powietrzu spala się spokojnym, kopcącym płomieniem, a na ściankach probówki jest widoczna sadza. Świadczy to o dużej zawartości procentowej węgla w acetylenie. Spalanie niecałkowite zachodzi zgodnie z równaniem:

Spalanie całkowite przy zwiększonym dostępie tlenu, np. w palnikach acetylenowo‑tlenowych, zachodzi zgodnie z równaniem:
Czy etyn reaguje z bromem?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Etyn nie reaguje z bromem.
Etyn reaguje z bromem.
dwie probówki ( w tym jedna napełniona etynem),
korek,
roztwór bromu.
Do pierwszej probówki wlej do 1/3 objętości roztwór bromu (próba kontrolna).
Do drugiej probówki (napełnionej etynem) wlej taką samą ilość roztworu bromu. Probówkę zamknij korkiem i dobrze wymieszaj przez wytrząsanie.
Obserwuj zachodzące zmiany.
Porównaj zawartość obu probówek.
Etyn, podobnie jak eten, powoduje odbarwienie roztworu bromu. Reakcja ta przebiega łatwo i świadczy o nienasyconym charakterze etynu.
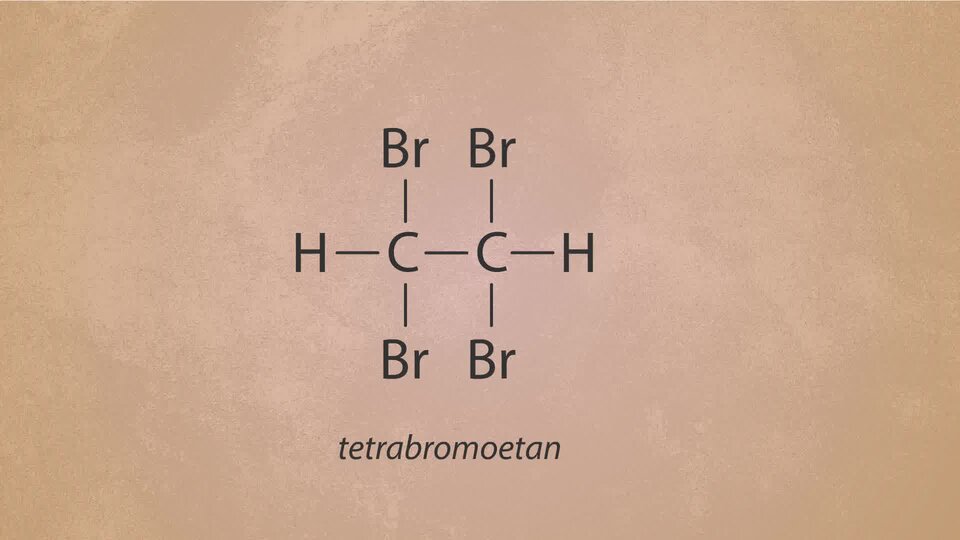
Reakcja etynu z bromem w środowisku bezwodnym przebiega zgodnie z równaniem:
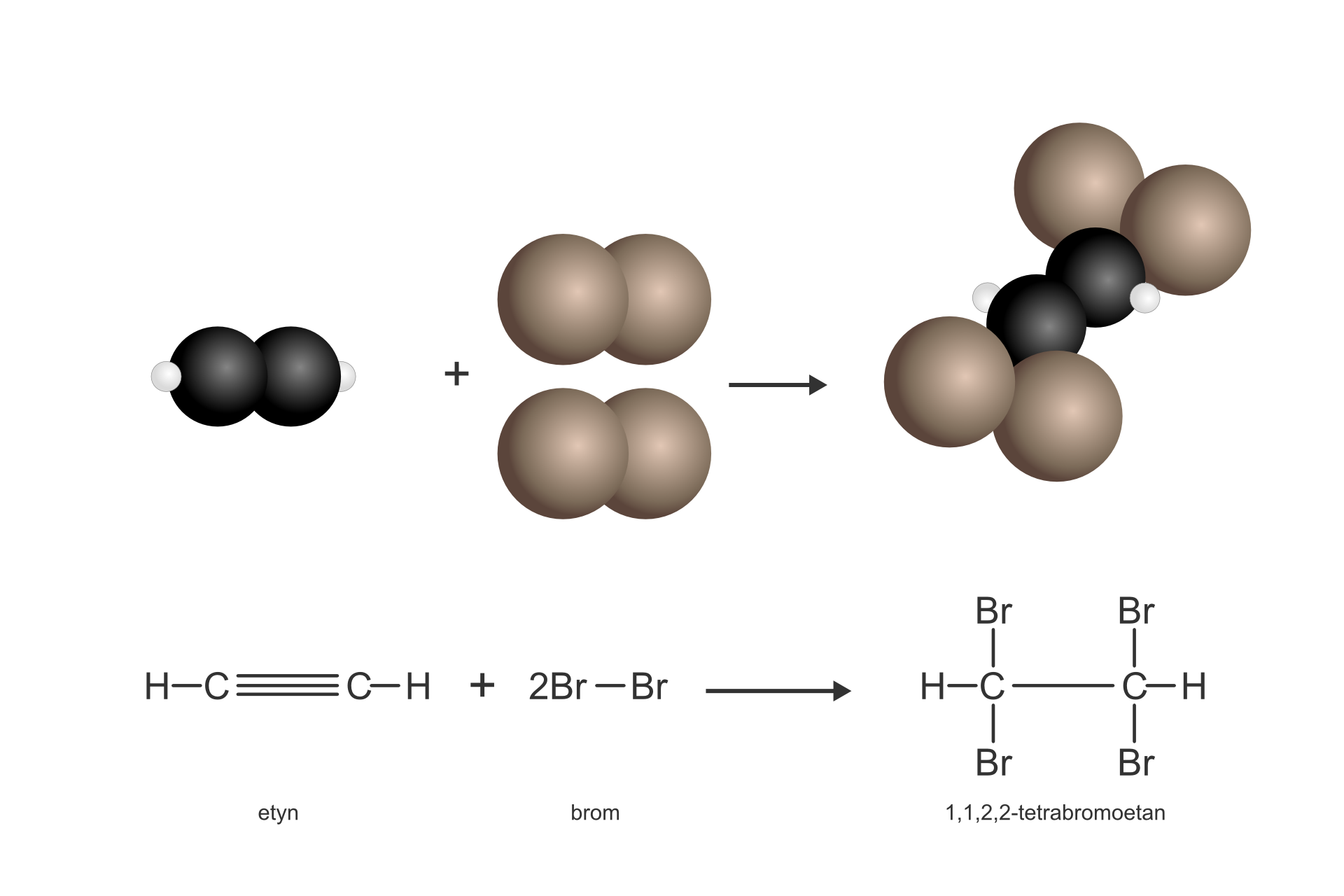
W wyniku tej reakcji ulega zerwaniu wiązanie wielokrotne (potrójne) i powstaje związek nasycony tetrabromoetan (przedrostek tetra- informuje, że w cząsteczce znajdują się cztery atomy bromu). Ten typ reakcji nazywamy reakcją addycji, czyli przyłączenia.
Film dostępny na portalu epodreczniki.pl
Na ekranie pojawiają sie dwa wzory: CnH2n-2 i C2H2. Następnie zerwaniu ulega wiązanie potrójne, pozostaje podwójne. Jednocześnie przyłączają się bromy i powstaje alken z wiązaniem podwójnym; Analogicznie w następnym etapie. Następnie pęka wiązanie podwójne i pozostaje pojedyncze, równocześnie przyłączają się bromy w wyniku czego powstaje związek nasycony z wiązaniem pojedynczym.
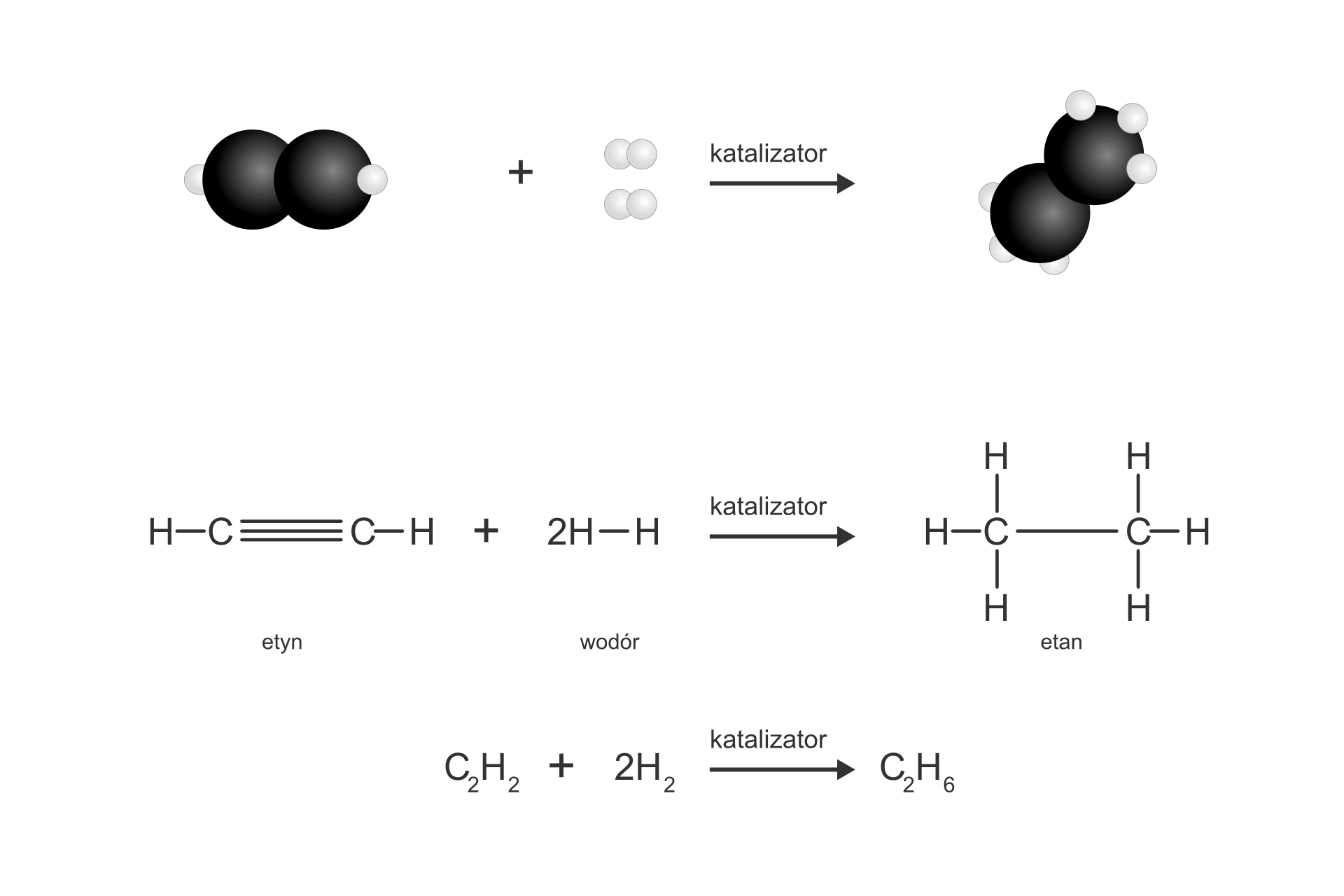
Acetylen i inne alkiny łatwo ulegają reakcjom przyłączania, m.in. z wodorem, fluorowcami (np. chlorem). W wyniku tych reakcji mogą powstać związki nasycone o pojedynczych wiązaniach między atomami węgla.
Reakcja uwodornienia etynu:
Podsumowanie
Właściwości fizyczne alkenów oraz alkinów są podobne do właściwości fizycznych alkanów. Zmieniają się wraz ze wzrostem liczby atomów węgla w łańcuchu.
Alkeny i alkiny są reaktywne chemicznie, palne, ulegają reakcjom addycji.
Alkiny są bardziej reaktywne od alkenów.
Wyjaśnij, na czym polegają różnice między cząsteczkami etanu, etenu i etynu.
Zestaw w formie tabeli wspólne właściwości fizyczne i chemiczne alkenów oraz alkinów.
Słowniczek
reakcja przyłączenia atomów innych pierwiastków, np. fluorowców (chloru, bromu, jodu), do cząsteczki z wiązaniem wielokrotnym, bez wydzielenia produktów ubocznych
reakcja przyłączenia cząsteczki wodoru do cząsteczki z wiązaniem wielokrotnym, bez wydzielenia produktów ubocznych
Zadania
Uzupełnij luki w tekście, wykorzystując znajomość właściwości fizycznych węglowodorów nienasyconych.
bardzo trudno rozpuszczają się, wyższe, trzy, łańcucha węglowego, wiązania, bezbarwne, cztery, rozpuszczają się, niższe
Alkeny, podobnie jak alkany, są ................................................................; ................................................................ w wodzie. Temperatura wrzenia i topnienia zależy od długości ................................................................ oraz budowy. Węglowodory o łańcuchu rozgałęzionym mają ................................................................ temperatury wrzenia. W temperaturze 20°C i pod ciśnieniem 1013 hPa pierwsze ................................................................ alkeny, o 2–4 atomach węgla w cząsteczce, są gazami.
Rozwiąż zadanie.
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D6EpMSBXK
Na podstawie tabeli oceń, które podane informacje są prawdziwe, a które fałszywe.
Węglowodór nienasycony | Wzór chemiczny | Temperatura wrzenia (°C) | Temperatura topnienia (°C) |
Eten | -103,7 | -169,0 | |
Propen | -47,6 | -185,2 | |
Buten (but‑1‑en) | -6,2 | -185,3 | |
Etyn | -84,7 | -80,7 | |
Propyn | -23,2 | -102,7 | |
Butyn (but‑1‑yn) | 8,0 | -125,7 |
| Prawda | Fałsz | |
| Wraz ze wzrostem liczby atomów węgla w cząsteczce alkenów maleje ich temperatura wrzenia. | □ | □ |
| Wraz ze wzrostem liczby atomów węgla w cząsteczce węglowodorów nienasyconych wzrasta ich temperatura wrzenia. | □ | □ |
| Wraz ze wzrostem liczby atomów węgla w cząsteczce alkenów maleje ich temperatura topnienia. | □ | □ |
| Wraz ze wzrostem liczby atomów węgla w cząsteczce alkinów wzrasta ich temperatura topnienia. | □ | □ |
Rozwiąż zadanie.
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D6EpMSBXK