Przeczytaj
Dlaczego atomy łączą się ze sobą?
Reakcje chemiczne zachodzą, gdy atomy zbliżą się do siebie. W zależności od rodzaju atomów, reakcje te mogą zachodzić poprzez oddziaływania (siły):
odpychające, które wynikają z nakładania się powłok elektronowych (efekty kwantowe) i oddziaływania elektrostatycznego jednoimiennych ładunków;
przyciągające, które wynikają z oddziaływania elektrostatycznego różnoimiennych ładunków, np. oddziaływań między elektronami a jądrami atomowymi oraz ze zmian rozkładu gęstości ładunków.
Niepodważalna w przyrodzie tendencja (prawo) dążenia do osiągnięcia minimalnej energii dotyczy także atomów i jest przyczyną tworzenia się wiązań chemicznych – atomy łączą się, jeżeli jest to korzystne energetycznie.
Wiązania kowalencyjne
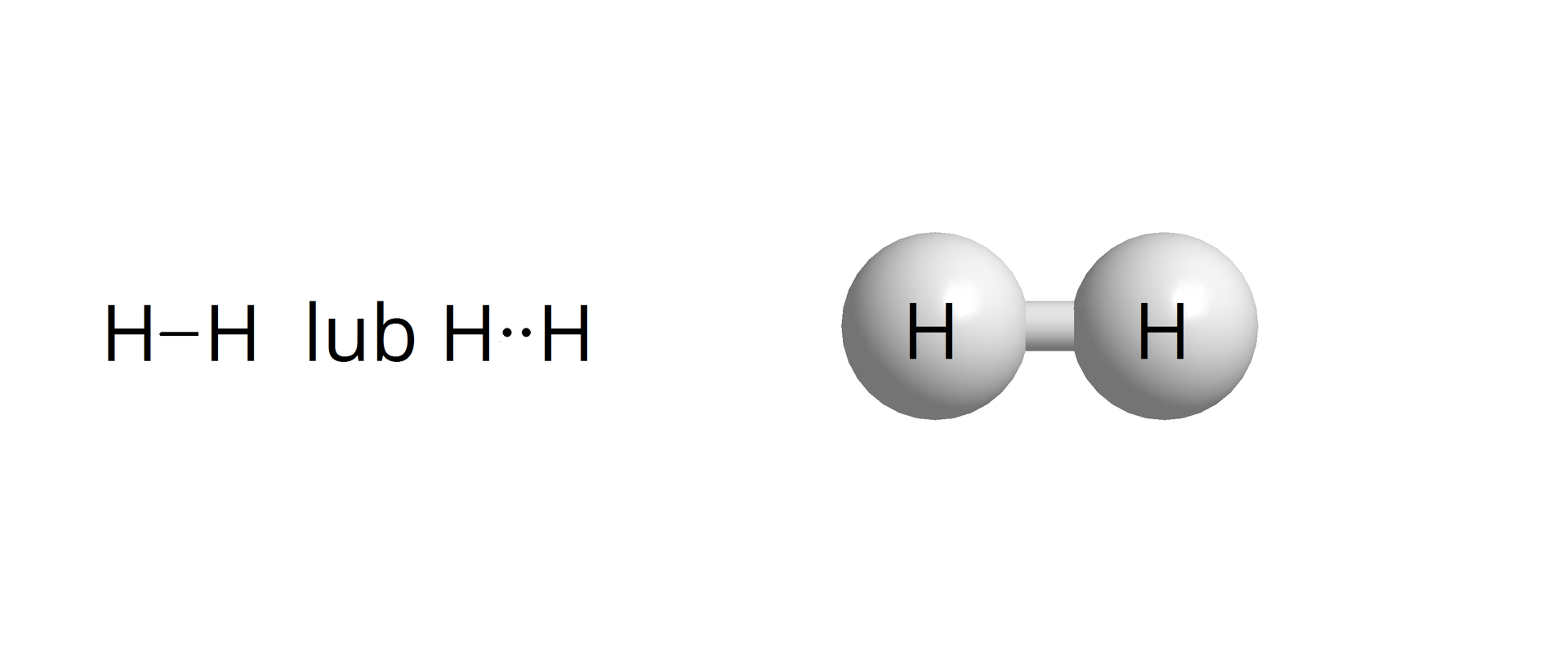
Tworzenie się wiązania kowalencyjnego niespolaryzowanego na przykładzie cząsteczki wodoru
Cząsteczka wodoru jest najprostszym przykładem cząsteczki zawierającej wiązanie kowalencyjnewiązanie kowalencyjne. Podczas tworzenia się wiązania orbitale 1s obydwu atomów nakładają się na siebie, tworząc część wspólną. Zgodnie z teorią wiązań walencyjnych Lewisa, strukturę cząsteczki przedstawia się następująco:
Na poniższej grafice przedstawiono wykres zmian energii w zależności od odległości między atomami .
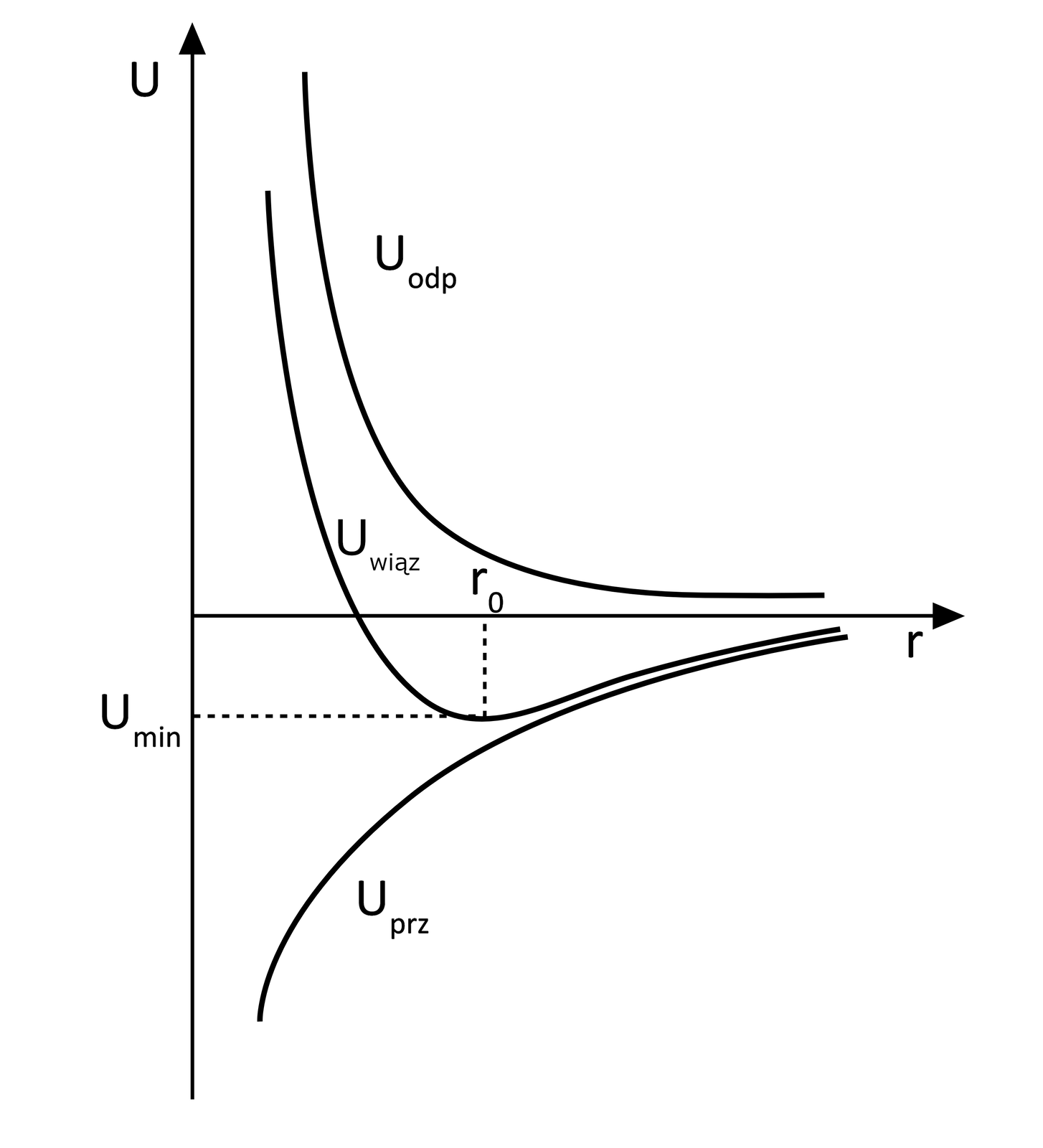
- Uprzy - energia przyciągania;
- Uodp - energia odpychnia;
- Uwiąz - energia wiązania.
Poniżej przedstawiono cząsteczkę z zaznaczoną odległością pomiędzy atomami.

Tworząc wiązanie, każdy atom wodoru, który ma jeden elektron, przez uwspólnianie elektronów z drugim atomem, osiąga pożądaną konfigurację wypełnionej powłoki – konfigurację gazu szlachetnego, w tym przypadku helu.
W opisie, który proponuje teoria orbitali molekularnych, powstawanie wiązania wiąże się z występowaniem w cząsteczce nowych orbitali. Dla cząsteczki wodoru z dwóch orbitali 1s powstają dwa orbitale molekularne sigma (sigma), czyli jeden orbital wiążący 1sigma i jeden niewiążący 1sigma. Para elektronowa tworząca wiązanie zajmuje orbital wiążący.
Diagram energetyczny cząsteczki
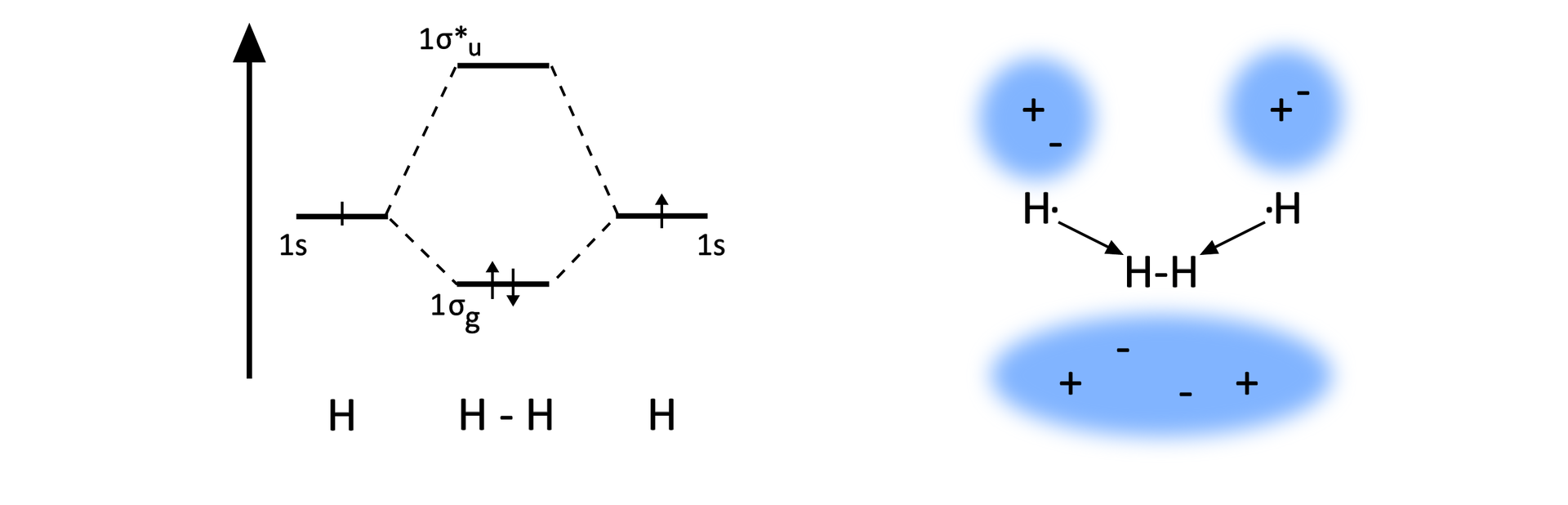
Przeanalizuj diagram energetyczny wodoru i zastanów się, jak teoria orbitali molekularnych uzasadnia powstawanie wiązania .
Wiązania jonowe
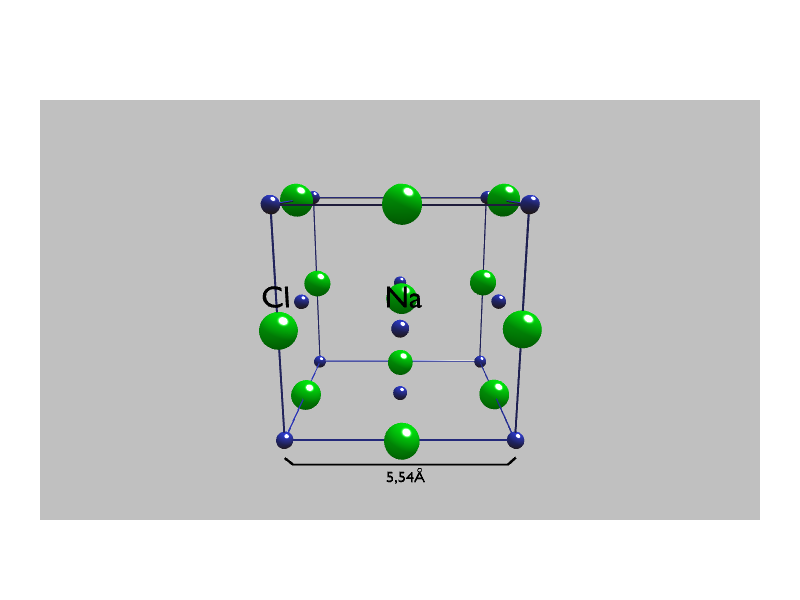
Tworzenie się wiązania jonowego na przykładzie chlorku sodu
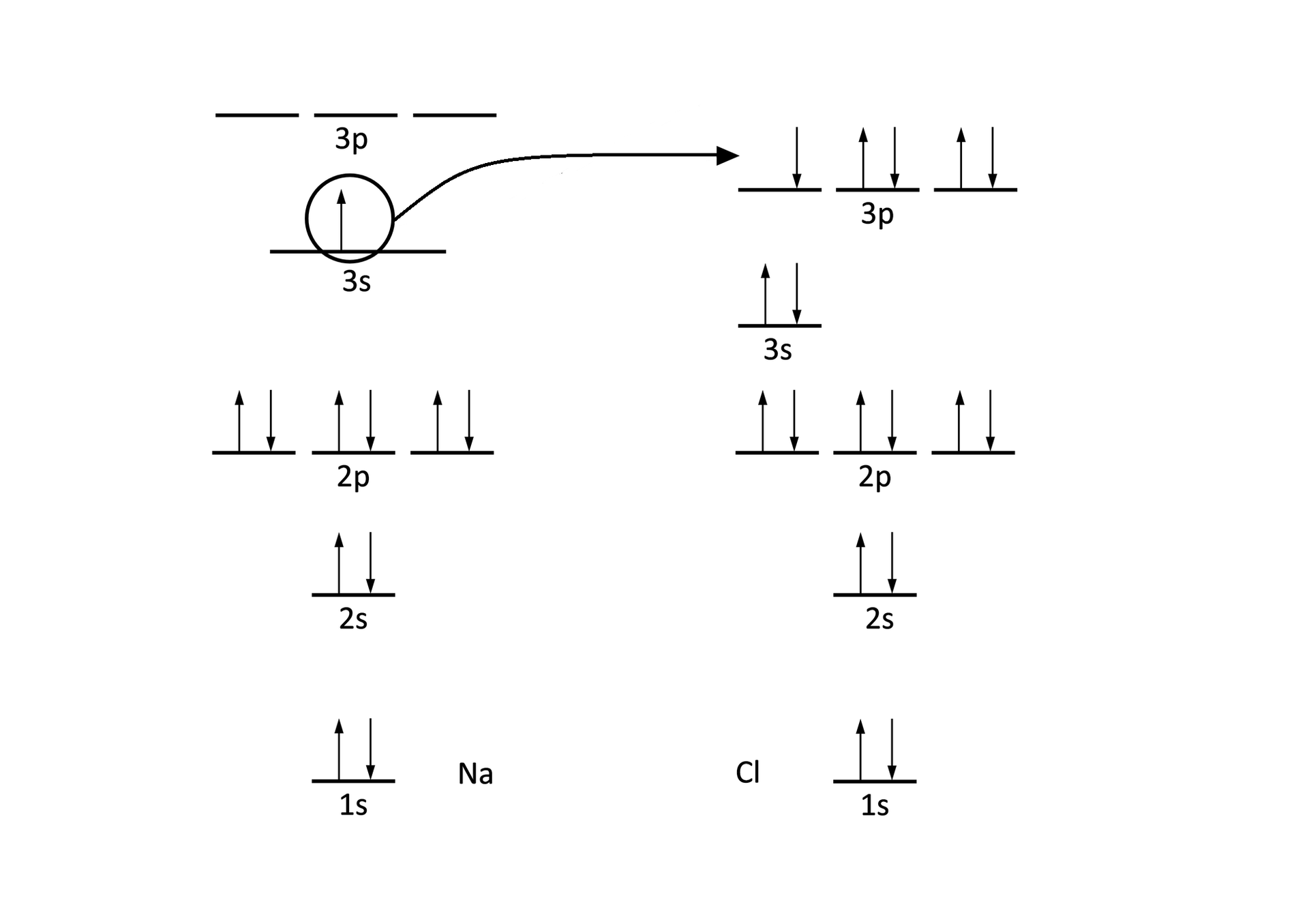
Jaką konfiguracje elektronową mają atomy sodu i chloru? Uzupełnij brakujące informacje na schemacie elektronowym.
1. 1, 2. 3, 3. 2, 4. 4, 5. 2, 6. 3, 7. 5, 8. 1, 9. 3, 10. 2, 11. 3, 12. 4, 13. 6, 14. 6, 15. 1, 16. 4, 17. 5, 18. 5, 19. 6, 20. 2, 21. 6, 22. 1, 23. 6, 24. 2, 25. 51. 1, 2. 3, 3. 2, 4. 4, 5. 2, 6. 3, 7. 5, 8. 1, 9. 3, 10. 2, 11. 3, 12. 4, 13. 6, 14. 6, 15. 1, 16. 4, 17. 5, 18. 5, 19. 6, 20. 2, 21. 6, 22. 1, 23. 6, 24. 2, 25. 51. 1, 2. 3, 3. 2, 4. 4, 5. 2, 6. 3, 7. 5, 8. 1, 9. 3, 10. 2, 11. 3, 12. 4, 13. 6, 14. 6, 15. 1, 16. 4, 17. 5, 18. 5, 19. 6, 20. 2, 21. 6, 22. 1, 23. 6, 24. 2, 25. 51. 1, 2. 3, 3. 2, 4. 4, 5. 2, 6. 3, 7. 5, 8. 1, 9. 3, 10. 2, 11. 3, 12. 4, 13. 6, 14. 6, 15. 1, 16. 4, 17. 5, 18. 5, 19. 6, 20. 2, 21. 6, 22. 1, 23. 6, 24. 2, 25. 51. 1, 2. 3, 3. 2, 4. 4, 5. 2, 6. 3, 7. 5, 8. 1, 9. 3, 10. 2, 11. 3, 12. 4, 13. 6, 14. 6, 15. 1, 16. 4, 17. 5, 18. 5, 19. 6, 20. 2, 21. 6, 22. 1, 23. 6, 24. 2, 25. 5
Zarówno atom chloru, jak i sodu dążą do uzyskania stabilnej energetycznie konfiguracji elektronowej, ale uzyskują ją na dwa odmienne sposoby: atom sodu oddaje elektron, natomiast atom chloru przyjmuje elektron. W przypadku sodu, kation ma konfigurację neonu, a anion – konfigurację argonu. Dzieje się tak, ponieważ posiadanie zapełnionej powłoki walencyjnej zapewnia stabilność i nieaktywność (tak jak w przypadku gazów szlachetnych).
Sód może osiągnąć stabilność, tracąc jeden elektron, chlor – osiąga pożądany stan oktetu, przechwytując elektron. Nie jest więc dziwne, że gdy te atomy znajdą się w pobliżu (umieścimy sód w atmosferze chloru), zajdzie gwałtowna reakcja.
Powstające kationy sodu i aniony chlorkowe przyciągają się wzajemnie (siłami elektrostatycznymi) – tworzy się wiązanie jonowewiązanie jonowe. Powstaje kryształ chlorku sodu, w którym każdy kation sodu otoczony jest przez 6 anionów chlorkowych, natomiast każdy anion przez 6 różnych kationów .
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DJBRUg3dD
Słownik
zdolność tworzących wiązanie atomów do przyciągania uwspólnionych elektronów
oddziaływanie elektrostatyczne pomiędzy jonami pierwiastków tworzących związek
wiązanie polegające na uwspólnianiu elektronów walencyjnych przez tworzące je atomy oraz na utworzeniu wiążących par elektronowych
Bibliografia
Atkins P., Jones L., Chemia ogólna, Warszawa 2004, s. 335‑441.
Czerwiński A., Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1. Podręcznik, Warszawa 2002, s. 134‑167.
Moore J. T., Chemia dla bystrzaków, Gliwice 2015, s. 195‑226.
Pauling L., Pauling P., Chemia, Warszawa 1989, s. 128‑170.
