Woda i roztwory wodne - stężenie procentowe, rozpuszczalność
Poniższy materiał stanowi uzupełnienie treści znajdujących się w materiale: https://zpe.gov.pl/a/woda-i-roztwory-wodne–podsumowanie/D18egiQxq
Czy wiesz, że woda płynąca z kranu jest tak naprawdę mieszaniną różnych cząsteczek i jonów? Dlatego w laboratorium używamy wyłącznie wody destylowanej, czyli poddanej procesowi destylacji. Dzięki temu otrzymujemy wodę będącą czystą substancją chemiczną, pozbawioną wszelkich innych związków chemicznych. Przeprowadzając następnie doświadczenia chemiczne w laboratorium, mamy pewność, że w mieszaninie reakcyjnej są wyłącznie te związki chemiczne, które wprowadziliśmy.
mechanizm tworzenia wiązania kowalencyjnego;
warunki i sposób polaryzacji wiązań;
przykłady atomów pierwiastków, pomiędzy którymi tworzy się wiązanie kowalencyjne spolaryzowane;
budowę tlenków;
różnice pomiędzy zjawiskiem fizycznym a reakcją chemiczną;
czynniki wpływające na szybkość rozpuszczania się różnych substancji w wodzie.
opisywać budowę cząsteczki wody
wskazywać, jakie właściwości wynikają z budowy cząsteczki wody;
podawać różnice między roztworem właściwymroztworem właściwym a zawiesinązawiesiną i koloidemkoloidem;
wymieniać różnice pomiędzy roztworem nasyconym a nienasyconymnienasyconym;
wykonywać obliczenia związane z pojęciami rozpuszczalności substancji oraz stężenia procentowego roztworu;
wymieniać zjawiska fizyczne charakteryzujące obieg wody na Ziemi.
1. Mapa myśli
Na mapie myśli przedstawiono charakterystykę wody i roztworów wodnych. Od głównego węzła odchodzi pięć kolejnych węzłów. Pierwszy z nich, oznaczony kolorem pomarańczowym, opisuje proces rozpuszczania. Dalej dzieli się on na obliczenia związane z rozpuszczalnością i obliczenia związane ze stężeniem procentowym. Rozpuszczalnością nazywamy maksymalną ilość substancji, jaka może rozpuścić się w stu gramach rozpuszczalnika w danej temperaturze i pod stałym ciśnieniem. Wzór na obliczenie rozpuszczalności to:
Stężeniem procentowym nazywamy ilość substancji znajdującej się w stu gramach roztworu. Wzór na stężenie procentowe to:
gdzie to masa substancji rozpuszczonej, a to masa roztworu.
Należy pamiętać, że masa roztworu to suma masy substancji rozpuszczonej oraz masy rozpuszczalnika:
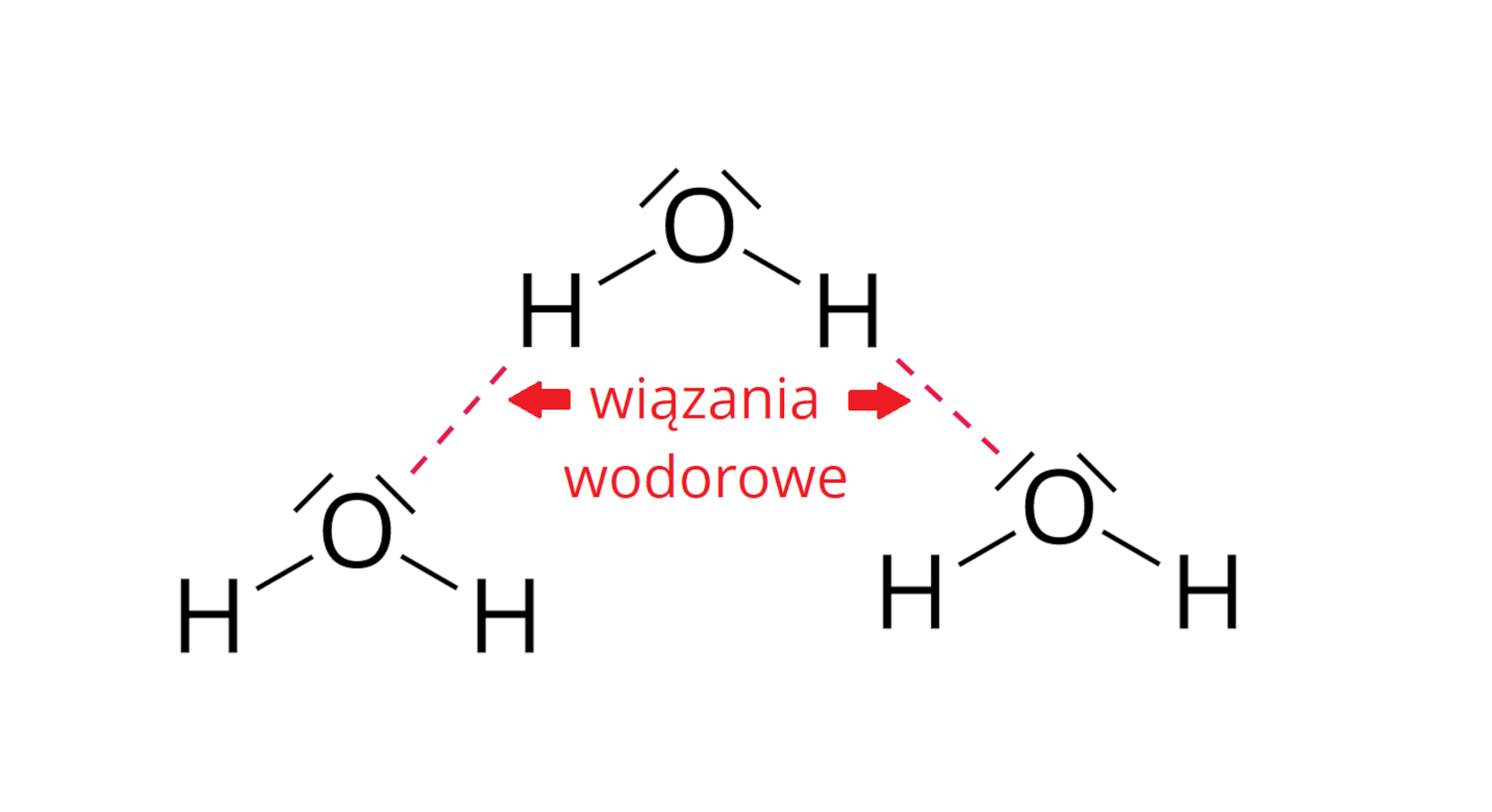
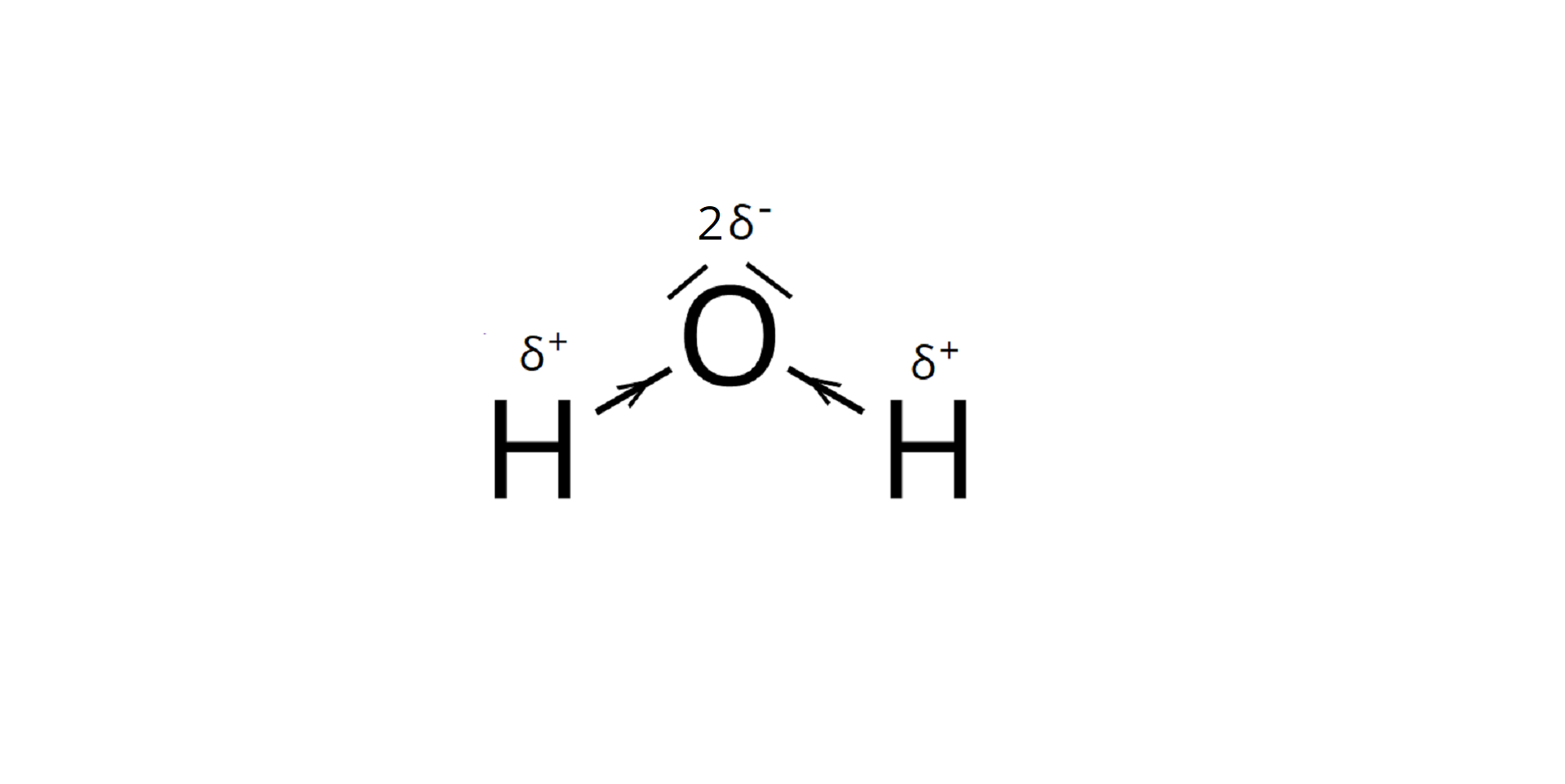
Kolejny węzeł, oznaczony kolorem kremowym, opisuje mieszaniny. Wyróżnia się podział ze względu na ilość substancji rozpuszczonej i podział ze względu na wielkość drobin substancji rozpuszczonej. W przypadku podziału ze względu na ilość substancji rozpuszczonej wyróżnia się roztwory nasycone i roztwory nienasycone. Roztwór nasycony zawiera maksymalną ilość substancji jaka może się rozpuścić w określonej masie rozpuszczalnika w danej temperaturze. Oznacza to, że w tej temperaturze nie jesteśmy w stanie rozpuścić więcej substancji. W przypadku gazów duże znaczenie ma również ciśnienie. Wraz ze wzrostem ciśnienia, rozpuszczalność gazów w cieczach rośnie. Roztwór nienasycony zawiera mniejszą niż maksymalna ilość substancji jaka może się rozpuścić w określonej masie rozpuszczalnika w danej temperaturze. W roztworze nienasyconym można zatem rozpuścić dodatkowe porcje substancji rozpuszczonej aż do uzyskania roztworu nasyconego. W przypadku podziału ze względu na wielkość drobin substancji rozpuszczonej wyróżnia się mieszaniny jednorodne i mieszaniny niejednorodne. Mieszanina jednorodna to roztwór właściwy. W roztworach właściwych wielkość zmieszanych ze sobą cząstek substancji chemicznych jest mniejsza niż jeden nanometr (jeden nanometr to dziesięć do potęgi minus dziewiątej metra). Roztwory właściwe stanowią mieszaniny jednorodne, czyli takie, których składników nie można rozróżnić gołym okiem lub za pomocą prostych przyrządów optycznych. Przykładami roztworów właściwych są: ocet (czyli dziesięcioprocentowy (w procentach masowych) roztwór kwasu octowego w wodzie), mieszanina wody z cukrem, z solą kuchenną czy z sokiem malinowym. Mieszaniny niejednorodne dzielą się na koloidy i zawiesiny. W roztworach koloidalnych wielkość zmieszanych ze sobą cząstek substancji chemicznych mieści się w przedziale od jednego do stu nanometrów (od dziesięciu do potęgi minus dziewiątej metra do dziesięciu do potęgi minus siódmej metra). Do roztworów koloidalnych zaliczamy między innymi roztwór białka jaja kurzego, mieszaninę wody z żelatyną, mleko, kleik skrobiowy czy mgłę. W zawiesinach wielkość zmieszanych ze sobą cząstek substancji chemicznych jest większa niż sto nanometrów (dziesięć do potęgi minus siódmej metra). Składniki zawiesin bardzo często jesteśmy w stanie rozróżnić za pomocą zmysłu wzroku lub prostych przyrządów optycznych. Do zawiesin zaliczamy np: mieszaninę wody z piaskiem czy kredą, ale również mieszaninę wody z benzyną czy oliwą. Kolejny węzeł, oznaczony kolorem czerwonym, opisuje obieg wody w przyrodzie. Woda na Ziemi jest w ciągłym ruchu i zmienia swoje formy, od stanu gazowego, poprzez ciekły do stanu stałego i odwrotnie. Obieg wody trwa od miliardów lat i wszystkie organizmy żywe są od niego zależne. Zamieszczono schemat opisujący obieg wody w przyrodzie: przemiana ciała stałego w gaz to sublimacja, przemiana gazu w ciało stałe to resublimacja. Przemiana ciała stałego w ciecz to topnienie, a przemiana cieczy w ciało stałe to krzepnięcie, Przemiana gazu w ciecz to skraplanie, a przemiana cieczy w gaz to wrzenie, parowanie. Następny węzeł, oznaczony kolorem zielonym, opisuje budowę cząsteczki wody. Cząsteczka wody składa się z jednego atomu tlenu oraz dwóch atomów wodoru. Pomiędzy atomami występują wiązania kowalencyjne spolaryzowane, a wspólne pary elektronowe przesunięte są w stronę atomu tlenu (co zaznacza się grotem zlokalizowanym na wiązaniu). Zamieszczono ilustrację, na której ukazano budowę cząsteczki wody: atom tlenu O połączony jest wiązaniami pojedynczymi z dwoma atomami wodoru. Na wiązaniach znajdują się groty strzałek zwrócone w stronę atomu tlenu, opisane jako: polaryzacja wiązania. Nad atomami wodoru znajdują się symbole delta z plusem w indeksie górnym, opisane jako cząstkowy ładunek dodatni. Nad atomem tlenu znajduja się dwie ukośne kreski opisane jako wolne pary elektronowe oraz zapis dwa symbol delta i plus w indeksie górnym opisane jako cząstkowy ładunek ujemny. Koniec opisu ilustracji. Wokół atomu tlenu gromadzi się cząstkowy ładunek ujemny (zatem ta część cząsteczki stanowi jej biegun ujemny), a wokół atomów wodoru gromadzi się cząstkowy ładunek dodatni (część cząsteczki wody od strony atomów wodoru stanowi zatem jej biegun dodatni). Cząsteczka wody ma budowę polarną. Mówimy, że woda jest dipolem (ma niezerowy moment dipolowy), czyli cząsteczką dwubiegunową. Zamieszczono grafikę ukazującą szary owal, wewnątrz którego z lewej strony znajduje się symbol plus, a z prawej strony – symbol minus. Pod spodem znajduje się podpis: symboliczny zapis dipola. Koniec opisu ilustracji. Z węzłem opisującym budowę cząsteczki wody łączy się kolejny węzeł opisujący asocjację.W przypadku cząsteczek wody – atom wodoru jednej cząsteczki może oddziaływać z atomem tlenu drugiej cząsteczki, ponieważ ładunki różnoimienne (dodatni i ujemny) wzajemnie się przyciągają. Są to oddziaływania typu dipol–dipol. Innym rodzajem oddziaływań pomiędzy cząsteczkami wody są wiązania wodorowe, polegające na przesunięciu gęstości elektronowej z silnie elektroujemnego atomu tlenu na atom wodoru, ubogi w elektrony (na skutek jego związania z atomem tlenu i silnej polaryzacji wiązania w kierunku atomu tlenu). Wiązania wodorowe zaznacza się przerywaną kreską (lub kropkami) od atomu wodoru jednej cząsteczki wody do wolnej pary elektronowej atomu tlenu drugiej cząsteczki wody. Zamieszczono ilustrację ukazującą trójwymiarowy model cząsteczki wody składający się z dużej czerwonej kulki z symbolem O i dwóch mniejszych przyłączonych do niej białych kulek z symbolami H. Przy atomach wodoru znajdują się symbole delta plus, od których odchodzą wiązania do symboli delta minus znajdujących się przy atomach tlenu innych cząsteczek. przy atomie tlenu znajdują się dwa symbole delta minus, od których odchodzą wiązania do symboli delta plus znajdujących się przy atomach wodoru innych cząsteczek. Pod spodem znajduje się podpis: wiązania wodorowe. Ostatni węzeł, również oznaczony kolorem zielonym, opisuje właściwości fizyczne wody. Od niego odchodzą dwa wiązania. Pierwsze prowadzi do pytania: Czy woda wrze zawsze w temperaturze stu stopni Celsjusza? Czy wiesz, że woda na szczytach najwyższych gór świata wrze w temperaturze niższej niż sto stopni Celsjusza? Na przykład na szczycie Mount Everest (osiem tysięcy osiemset czterdzieści osiem metrów nad poziomem morza) woda wrze w temperaturze około sześćdziesięciu ośmiu stopni Celsjusza. Wynika to ze spadku ciśnienia wraz ze wzrostem wysokości. Każde osiem metrów w górę wiąże się ze spadkiem ciśnienia o około jeden hektopaskal. Na szczycie Mount Everest ciśnienie wynosi zaledwie trzysta czternaście hektopaskali. Temperatura wrzenia substancji ściśle zależy od ciśnienia – im niższe ciśnienie, tym niższa temperatura wrzenia. Drugie pytanie to: Dlaczego lód pływa po wodzie? Właściwości fizyczne wody wynikają z jej polarnej budowy. W większości ciał stałych drobiny znajdują się bliżej siebie niż w ciekłym stanie skupienia. Wynika z tego, że substancje w stanie stałym skupienia charakteryzują się większą gęstością niż w stanie ciekłym. Jednak w przypadku wody jest odwrotnie. Cząsteczki oddziałują ze sobą za pomocą wiązań wodorowych i w fazie stałej tworzą struktury, które pozostawiają dużo wolnej przestrzeni, przez co odległości między cząsteczkami są większe w lodzie niż w wodzie ciekłej. Z tego powodu lód ma mniejszą gęstość niż woda ciekła. Woda charakteryzuje się największą gęstością w temperaturze równej cztery stopnie Celsjusza. Dzięki temu organizmy wodne mogą przetrwać w okresie zimowym, kiedy warstwy lodu pokrywają powierzchnie zbiorników wodnych. Skutkiem oddziaływań wodorowych pomiędzy cząsteczkami wody jest również wzrost jej objętości podczas zamarzania. Woda zwiększa wówczas swoją objętość aż o około dziesięć procent.
Wokół atomu tlenu gromadzi się cząstkowy ładunek 1. ujemny, 2. dodatnie, 3. ujemne, 4. dodatni.
Poniżej przedstawiono pewną definicję.
Jest to zjawisko łączenia się drobin (cząsteczek, jonów, atomów) w większe układy, złożone z dwóch lub większej liczby cząstek w wyniku oddziaływań międzycząsteczkowych.
Jednym z rodzajów oddziaływań pomiędzy cząsteczkami wody są wiązania wodorowewiązania wodorowe, które wpływają na jej wysoką temperaturę wrzenia. Należy bowiem dostarczyć więcej energii, aby zerwane zostały oddziaływania międzycząsteczkowe i doszło do zmiany stanu skupienia. Na poniższym schemacie przedstawiono wzory elektronowe kilku cząsteczek wody. Zaznacz wiązania wodorowe powstające pomiędzy nimi.
W przypadku roztworów wodnych, bardzo często mamy do czynienia z zadaniami, które bazują na obliczeniach związanych ze stężeniami procentowymistężeniami procentowymi oraz rozpuszczalnościąrozpuszczalnością. W jaki sposób, krok po kroku, rozwiązywać takie zadania?
2. Stężenie procentowe
W zadaniach dotyczących stężeń procentowych opieramy się na definicji stężenia procentowego. Jest to ilość substancji, która znajduje się w roztworu. Stężenie procentowe wyrażane jest w procentach masowych. Zatem wzór na stężenie procentowe zapisujemy w następujący sposób:
gdzie: – masa substancji rozpuszczonejsubstancji rozpuszczonej; – masa roztworu.
Poniżej przedstawiono opis przygotowania pewnego roztworu.
Na wadze technicznej odważono azotanu() potasu. Następnie w cylindrze miarowym odmierzono wody destylowanej (gęstość wody wynosi ). Do kolby stożkowej wprowadzono lejek i przesypano sól. W kolejnym kroku przelewano wodę z cylindra miarowego przez lejek tak, aby pozbyć się z lejka pozostałości soli. Wyjęto z kolby lejek i mieszano zawartość kolby do momentu całkowitego rozpuszczenia soli w wodzie.
W jaki sposób obliczyć stężenie procentowe tak przygotowanego roztworu
azotanu() potasu?
Krok
Wypisanie danych i szukanych z zadania – substancją rozpuszczoną jest azotan() potasu a rozpuszczalnikiemrozpuszczalnikiem jest woda.
Krok
Zapisanie wzoru na stężenie procentowe:
Krok
Zapisanie wzoru na masę roztworu:
Krok
Obliczenie masy rozpuszczalnika, korzystając ze wzoru na gęstość.
Krok
Podstawienie danych do wzoru na stężenie procentowe
Odpowiedź: Stężenie procentowe azotanu() potasu w otrzymanym roztworze wynosi .
3. Rozpuszczalność
W zadaniach dotyczących rozpuszczalności substancji opieramy się na definicji rozpuszczalności. Jest to maks. ilość substancji, jaką możemy rozpuścić się w rozpuszczalnika w danej temperaturze i pod stałym ciśnieniem. Zależność rozpuszczalności substancji od temperatury przedstawiana jest na wykresie, który nazywamy krzywą rozpuszczalnościkrzywą rozpuszczalności.
- 1. zestaw danych:
- temperatura (°C): 0°C
- azotan(V) potasu: 13.3; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 127.5; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 35.7; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 27.6; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 73; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 2. zestaw danych:
- temperatura (°C): 10°C
- azotan(V) potasu: 20.9; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 136; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 35.8; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 31; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 80; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 3. zestaw danych:
- temperatura (°C): 20°C
- azotan(V) potasu: 31.6; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 144; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 36.0; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 34; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 88; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 4. zestaw danych:
- temperatura (°C): 30°C
- azotan(V) potasu: 45.8; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 152; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 36.3; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 37; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 96; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 5. zestaw danych:
- temperatura (°C): 40°C
- azotan(V) potasu: 63.9; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 160; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 36.6; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 40; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 104; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 6. zestaw danych:
- temperatura (°C): 50°C
- azotan(V) potasu: 85.5; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 170; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 37; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 42.6; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 114; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 7. zestaw danych:
- temperatura (°C): 60°C
- azotan(V) potasu: 110; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 176; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 37.3; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 45.5; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 124; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 8. zestaw danych:
- temperatura (°C): 70°C
- azotan(V) potasu: 138; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 184; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 37.8; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 48.3; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 134; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 9. zestaw danych:
- temperatura (°C): 80°C
- azotan(V) potasu: 169; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 192; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 38.4; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 51.1; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 148; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 10. zestaw danych:
- temperatura (°C): 90°C
- azotan(V) potasu: 202; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 200; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 39; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 54; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 161; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 11. zestaw danych:
- temperatura (°C): 100°C
- azotan(V) potasu: 246; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 208; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 39.8; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 65.7; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 180; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
Na liniowym wykresie interaktywnym przedstawiono rozpuszczalność poniższych soli (w na wody). Krzywe rozpuszczalności dla każdej z soli zostały oznaczone innym kolorem.
azotan() potasu (linia pomarańczowa):
–
–
–
–
–
–
–
–
–
–
–
jodek potasu (linia jasnopomarańczowa):
–
–
–
–
–
–
–
–
–
–
–
chlorek sodu (sól kuchenna) (linia żółta):
–
–
–
–
–
–
–
–
–
–
–
chlorek potasu (linia jasnozielona):
–
–
–
–
–
–
–
–
–
–
–
azotan() sodu (linia zielona):
–
–
–
–
–
–
–
–
–
–
–
Na podstawie krzywej odczytujemy rozpuszczalność substancji w danej temperaturze. W zadaniach związanych z rozpuszczalnością substancji bardzo często wykorzystujemy również wzór na stężenie procentowe. Przyjrzyjmy się poniższemu zagadnieniu.
Pewien uczeń odczytał rozpuszczalność siarczanu() potasu z krzywej rozpuszczalności i przedstawił dane w formie tabeli.
Temperatura | |||||||
|---|---|---|---|---|---|---|---|
Rozpuszczalność |
Ile gramów siarczanu() potasu potrzeba do sporządzenia nasyconego roztworunasyconego roztworu o temperaturze ?
Krok : Wypisanie danych z zadania.
Krok : Interpretacja rozpuszczalności
substancji rozpuszcza się w .
Krok : Obliczenie masy roztworu na podstawie interpretacji rozpuszczalności.
Krok : Ułożenie proporcji.
Wiemy, że substancji rozpuszcza się w roztworu, tworząc roztwór nasycony. Zastanawiamy się więc, jaka masa substancji rozpuści się w roztworu.
Odpowiedź: W temperaturze równej znajduje się w roztworu, tworząc roztwór nasycony.
Słownik
wykres przedstawiający zależność rozpuszczalności danej substancji od temperatury
określa maksymalną ilość substancji, jaka może rozpuścić się w rozpuszczalnika w danej temperaturze i pod stałym ciśnieniem
ilość substancji znajdującej się w roztworu, stężenie procentowe wyrażane jest w procentach masowych
roztwór, który w danej temperaturze zawiera maksymalną ilość substancji rozpuszczonej, a dodana kolejna do niej porcja substancji nie ulega rozpuszczeniu
roztwór, który w danej temperaturze nie zawiera maksymalnej ilości substancji rozpuszczonej i w którym można rozpuścić dodatkową porcję tej substancji
układ dwóch różnoimiennych ładunków elektrycznych (dodatniego i ujemnego); cząsteczka o nierównomiernym rozłożeniu cząstkowych ładunków dodatnich i ujemnych powstałych na skutek przesunięcia wspólnych par elektronowych pomiędzy atomami tworzącymi cząsteczkę
składnik roztworu; najczęściej jest to substancja występująca w przewadze
substancja zbudowana z cząsteczek, które są dipolami
składnik roztworu, substancja rozpuszczona w rozpuszczalniku
roztwór, w którym średnica cząstek substancji rozproszonej w ośrodku rozpraszającym wynosi mniej niż
roztwór, w którym średnica cząstek substancji rozproszonej w ośrodku rozpraszającym mieści się w granicach od do
roztwór, w którym średnica cząstek substancji rozproszonej w ośrodku rozpraszającym wynosi więcej niż
oddziaływania pomiędzy atomem wodoru jednej cząsteczki a wolnymi parami elektronowymi atomu silnie elektroujemnego (np. atomu tlenu, fluoru lub azotu) drugiej cząsteczki; odpowiadają m.in. za wysokie temperatury wrzenia substancji
Ćwiczenia
Poniżej zamieszczono krzywą rozpuszczalności przykładowych substancji stałych.
- 1. zestaw danych:
- temperatura (°C): 0°C
- azotan(V) potasu: 13.3; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 127.5; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 35.7; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 27.6; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 73; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 2. zestaw danych:
- temperatura (°C): 10°C
- azotan(V) potasu: 20.9; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 136; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 35.8; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 31; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 80; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 3. zestaw danych:
- temperatura (°C): 20°C
- azotan(V) potasu: 31.6; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 144; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 36.0; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 34; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 88; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 4. zestaw danych:
- temperatura (°C): 30°C
- azotan(V) potasu: 45.8; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 152; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 36.3; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 37; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 96; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 5. zestaw danych:
- temperatura (°C): 40°C
- azotan(V) potasu: 63.9; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 160; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 36.6; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 40; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 104; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 6. zestaw danych:
- temperatura (°C): 50°C
- azotan(V) potasu: 85.5; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 170; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 37; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 42.6; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 114; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 7. zestaw danych:
- temperatura (°C): 60°C
- azotan(V) potasu: 110; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 176; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 37.3; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 45.5; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 124; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 8. zestaw danych:
- temperatura (°C): 70°C
- azotan(V) potasu: 138; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 184; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 37.8; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 48.3; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 134; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 9. zestaw danych:
- temperatura (°C): 80°C
- azotan(V) potasu: 169; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 192; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 38.4; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 51.1; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 148; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 10. zestaw danych:
- temperatura (°C): 90°C
- azotan(V) potasu: 202; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 200; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 39; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 54; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 161; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 11. zestaw danych:
- temperatura (°C): 100°C
- azotan(V) potasu: 246; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 208; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 39.8; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 65.7; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 180; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
Na liniowym wykresie interaktywnym przedstawiono rozpuszczalność poniższych soli (w na wody). Krzywe rozpuszczalności dla każdej z soli zostały oznaczone innym kolorem.
azotan() potasu (linia pomarańczowa):
–
–
–
–
–
–
–
–
–
–
–
jodek potasu (linia jasnopomarańczowa):
–
–
–
–
–
–
–
–
–
–
–
chlorek sodu (sól kuchenna) (linia żółta):
–
–
–
–
–
–
–
–
–
–
–
chlorek potasu (linia jasnozielona):
–
–
–
–
–
–
–
–
–
–
–
azotan() sodu (linia zielona):
–
–
–
–
–
–
–
–
–
–
–
Do zlewki pierwszej wprowadzono 90 g wody, a do zlewki drugiej 30 g wody. Ustal jaki roztwór (nasycony czy nienasycony) otrzymano w obu probówkach, jeżeli wiesz, że rozpuszczalność azotanu(V) potasu w temperaturze 60°C wynosi 110 g na 100 g wody. W zlewce pierwszej otrzymano roztwór Tu uzupełnij. W zlewce drugiej otrzymano roztwór Tu uzupełnij.
Poniżej przedstawiono krzywe rozpuszczalności wybranych soli.
- 1. zestaw danych:
- temperatura (°C): 0°C
- azotan(V) potasu: 13.3; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 127.5; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 35.7; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 27.6; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 73; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 2. zestaw danych:
- temperatura (°C): 10°C
- azotan(V) potasu: 20.9; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 136; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 35.8; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 31; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 80; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 3. zestaw danych:
- temperatura (°C): 20°C
- azotan(V) potasu: 31.6; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 144; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 36.0; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 34; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 88; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 4. zestaw danych:
- temperatura (°C): 30°C
- azotan(V) potasu: 45.8; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 152; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 36.3; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 37; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 96; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 5. zestaw danych:
- temperatura (°C): 40°C
- azotan(V) potasu: 63.9; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 160; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 36.6; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 40; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 104; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 6. zestaw danych:
- temperatura (°C): 50°C
- azotan(V) potasu: 85.5; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 170; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 37; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 42.6; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 114; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 7. zestaw danych:
- temperatura (°C): 60°C
- azotan(V) potasu: 110; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 176; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 37.3; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 45.5; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 124; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 8. zestaw danych:
- temperatura (°C): 70°C
- azotan(V) potasu: 138; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 184; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 37.8; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 48.3; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 134; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 9. zestaw danych:
- temperatura (°C): 80°C
- azotan(V) potasu: 169; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 192; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 38.4; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 51.1; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 148; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 10. zestaw danych:
- temperatura (°C): 90°C
- azotan(V) potasu: 202; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 200; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 39; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 54; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 161; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- 11. zestaw danych:
- temperatura (°C): 100°C
- azotan(V) potasu: 246; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- jodek potasu: 208; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek sodu (sól kuchenna): 39.8; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- chlorek potasu: 65.7; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
- azotan(V) sodu: 180; Podpis osi wartości: rozpuszczalność (w g na 100 g wody)
Na liniowym wykresie interaktywnym przedstawiono rozpuszczalność poniższych soli (w na wody). Krzywe rozpuszczalności dla każdej z soli zostały oznaczone innym kolorem.
azotan() potasu (linia pomarańczowa):
–
–
–
–
–
–
–
–
–
–
–
jodek potasu (linia jasnopomarańczowa):
–
–
–
–
–
–
–
–
–
–
–
chlorek sodu (sól kuchenna) (linia żółta):
–
–
–
–
–
–
–
–
–
–
–
chlorek potasu (linia jasnozielona):
–
–
–
–
–
–
–
–
–
–
–
azotan() sodu (linia zielona):
–
–
–
–
–
–
–
–
–
–
–
Zjawisko Tyndalla to zjawisko rozchodzenia się światła w postaci stożkowych smug. Można go zaobserwować w roztworze białka, kiedy skierujemy światło bezpośrednio na naczynia z mieszaniną. Światła reflektorów we mgle również tworzą charakterystyczny stożek. Odpowiedz na pytania.
Based on the knowledge of the solubility of substances in water, you can: Możliwe odpowiedzi: 1. determine the max. amount of the substance that can dissolve in of solution at the specified temperature., 2. assess whether a given amount of a substance can dissolve in a given mass of water and temperature., 3. determine the min. amount of a substance that can dissolve in of water at the specified temperature.
A water molecule is shown below as a dipole.
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, t. 1, Warszawa 2022.
Kulawik J., Kulawik T., Litwin M., Podręcznik do chemii dla klasy siódmej szkoły podstawowej, Warszawa 2020.
Łasiński D., Sporny Ł., Strutyńska D., Wróblewski P., Podręcznik dla klasy siódmej szkoły podstawowej, Kielce 2020.