Wycofanie i wstrzymanie produktu leczniczego
Kwestię wycofania produktu leczniczego z obrotu i wstrzymania produktu leczniczego w obrocie reguluje rozporządzenie Ministra Zdrowia z dnia 12 marca 2008 r. [4]. Zgodnie z obowiązującym prawem kierownik apteki lub punktu aptecznego po otrzymaniu decyzji o wstrzymaniu lub wycofaniu jest zobowiązany do zabezpieczenia posiadanego zapasu produktu leczniczego przed dalszym wprowadzeniem do obrotu. Ponadto drogą elektroniczną (poczta elektroniczna), telefoniczną lub telefaksem musi powiadomić wszystkich bezpośrednich odbiorców (z wyjątkiem pacjentów) tego produktu o jego wstrzymaniu bądź wycofaniu. Następnie, postępując zgodnie z procedurą wycofania z obrotu, należy przyjąć zwroty od bezpośrednich odbiorców. Trzeba przekazać do hurtowni odpowiednio do tego przygotowany wyrób wraz z raportem o podjętych działaniach zabezpieczających. Apteka ma sześćdziesiąt dni od momentu otrzymania decyzji na zwrot wycofanego produktu leczniczego (rycina 4).
Producent może wystąpić o ponowne przywrócenie obrotu produktem leczniczym. Wówczas musi złożyć drogą elektroniczną stosowny wniosek do Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych.
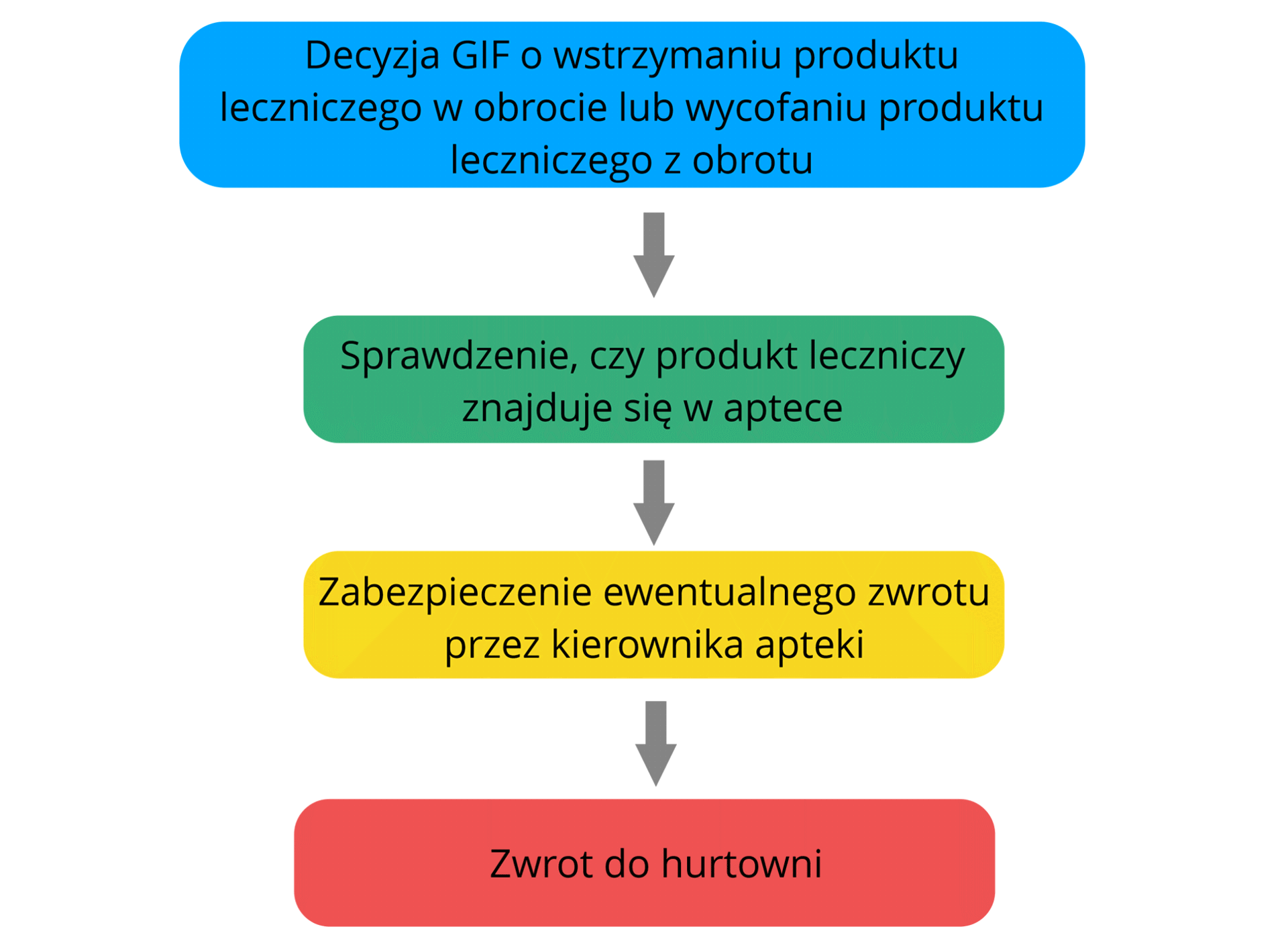
Rycina przedstawia schemat wycofania lub wstrzymania produktu leczniczego. Pomiędzy pojedynczymi planszami znajdują się strzałki przedstawiające kierunek odczytywania schematu.
Pojedyncze kolejne plansze są opisane jako:
Decyzja Głównego Inspektora Farmaceutycznego o wstrzymaniu produktu leczniczego w obrocie lub wycofaniu produktu leczniczego z obrotu.
Sprawdzenie, czy produkt leczniczy znajduje się w aptece.
Zabezpieczenie ewentualnego zwrotu przez kierownika apteki.
Zwrot do hurtowni.
Powrót do spisu treściPowrót do spisu treści