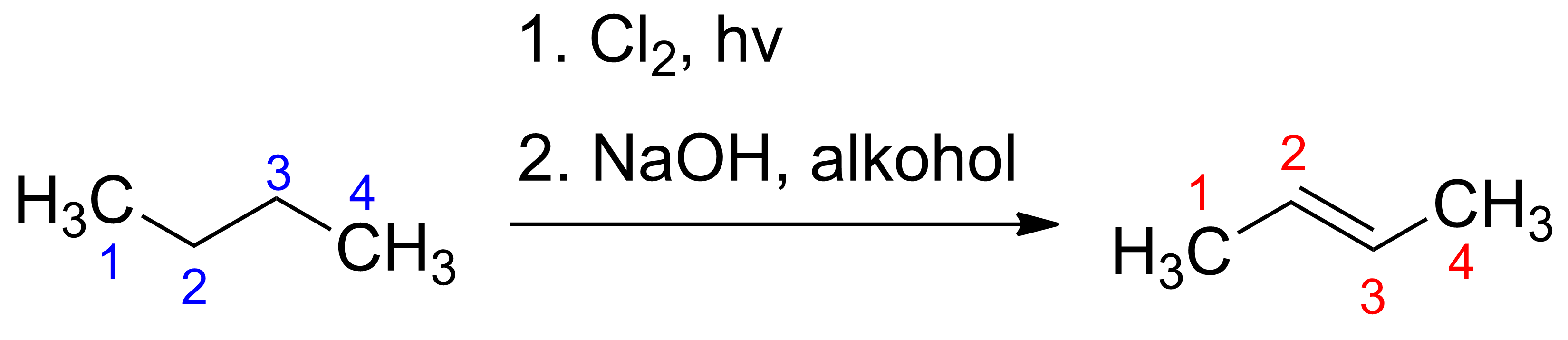Grafika interaktywna
Czy wiesz, jaki ciąg przemian pozwoli na otrzymanie z alkanu alkoholu, a następnie odpowiedniego alkenu? Czy można otrzymać alken, rezygnując z jednego etapu? Zapoznaj się z grafiką interaktywną, która przedstawia ciąg reakcji na przykładzie 2‑metylopentanu, a następnie przejdź do wykonania ćwiczenia 1.
Czy wiesz, jaki ciąg przemian pozwoli na otrzymanie z alkanu alkoholu, a następnie odpowiedniego alkenu? Czy można otrzymać alken, rezygnując z jednego etapu? Zapoznaj się z opisem grafiki interaktywnej, która przedstawia ciąg reakcji na przykładzie 2‑metylopentanu, a następnie przejdź do wykonania ćwiczenia 1.
Co to jest dehydrogenacja? Jakie katalizatory znajdują zastosowanie w tym procesie? Zapoznaj się z grafiką prezentującą dehydrogenację etylobenzenu, a następnie rozwiąż zadania nr 2 i 3.
Co to jest dehydrogenacja? Jakie katalizatory znajdują zastosowanie w tym procesie? Zapoznaj się z opisem grafiki prezentującej dehydrogenację etylobenzenu, a następnie rozwiąż zadania nr 2 i 3.
2-metylobutan można przekształcić w pent-1-en i 2-metylobut-1-en, stosując jako katalizator tlenek chromu(III) (Cr2O3). Reakcję prowadzi się w temperaturze 500°C. Na zdjęciu jest pewna ilość ciemnozielonego proszku. Cr2O3., 4. Odwodornienie oksydacyjne. Obecnie badania koncentrują się na opracowywaniu alternatyw odwodornienia alkanów, takich jak odwodornienie oksydacyjne (ODH) z dwóch powodów: niepożądane reakcje zachodzą w wysokiej temperaturze i prowadzą do koksowania i dezaktywacji katalizatora, co sprawia, że nieunikniona jest jego częsta regeneracja; podczas procesu zużywa się duża ilość ciepła, dlatego wymagane są wysokie temperatury reakcji. Synteza krótkołańcuchowych olefin poprzez egzotermiczne selektywne utlenianie etanu i propanu jest w rzeczywistości uważana za potencjalną alternatywę dla tradycyjnej, wysoce energochłonnej pirolizy surowców węglowodorowych. ..
Napisz ciąg przemian, za pomocą których otrzymasz but‑2-en. Jako substratu wyjściowego użyj butanu. Nazwij produkty reakcji i nie zapomnij o uwzględnieniu warunków reakcji chemicznych.
Podczas określania nazw użyj symboli E lub Z.
Uwaga!
Zastanów się, czy w tej reakcji nie ma więcej produktów.
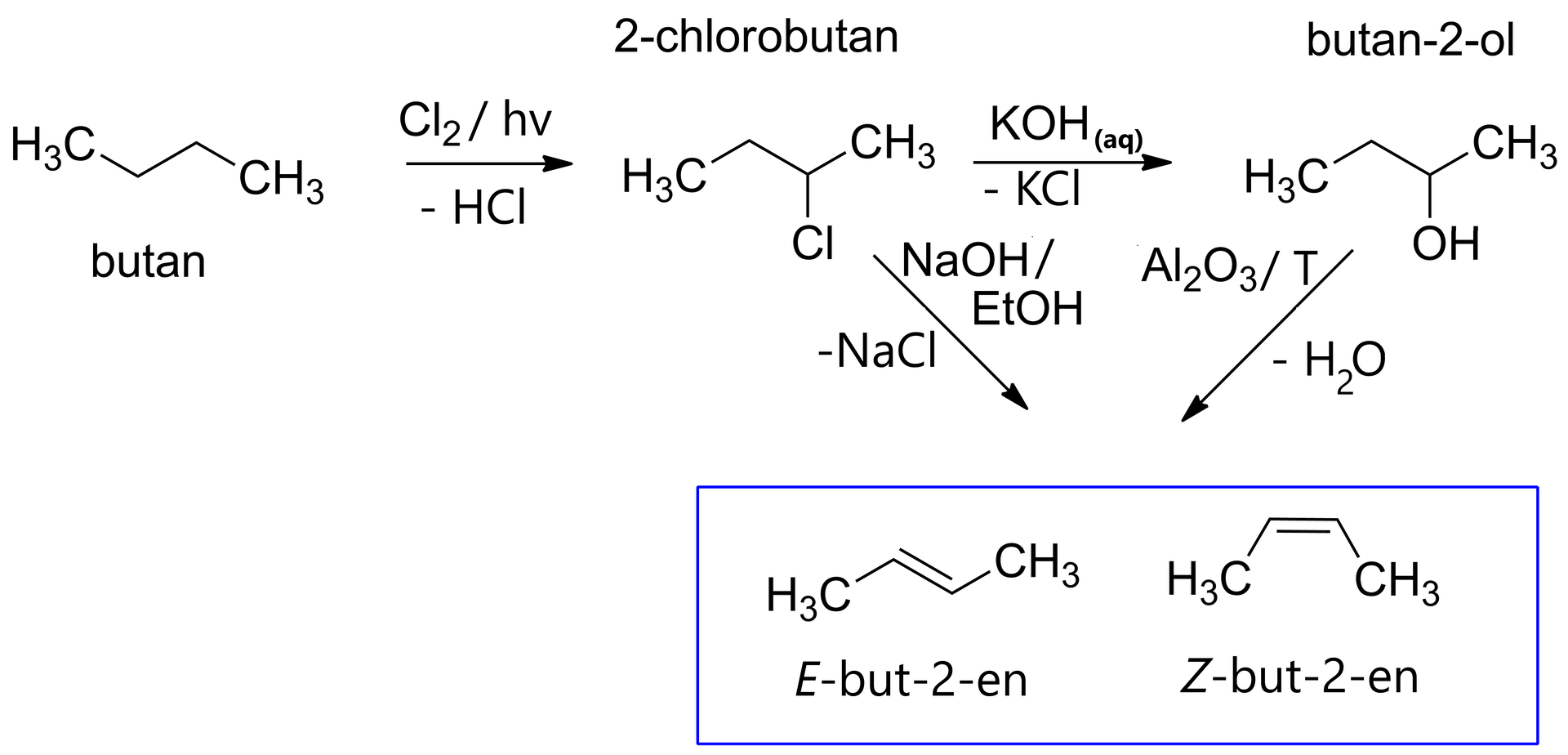
Wybierz, jaki związek powstanie z 2-chlorobutanu pod wpływem roztworu KOH.
- butan-2-ol
- buten-2-ol
- butan
Wybierz, co powstanie z butan-2-olu pod wpływem temperatury i tlenku glinu.
- Z-but-2-en.
- N-but-3-en.
- but-2-en.
Które związki chemiczne, wymienione poniżej, mogą służyć do wspomagania tlenku żelaza(III) wykorzystywanego do katalitycznego odwodornienia alkanów.
- tlenek potasu
- węglan potasu
- węglan chromu(III)
- tlenek chromu(III)
Określ typ hybrydyzacji orbitali walencyjnych atomów węgla w substracie i produkcie. Określ liczbę wszystkich wiązań sigma i wiązań pi w butanie i but-2-enie.