Przeczytaj
Budowa a właściwości

Cząsteczka alkoholu zawiera hydrofilowąhydrofilową grupę i hydrofobowąhydrofobową resztę węglowodorową –R.
Alkohole można też traktować jako pochodne wody. W tym ujęciu zakładamy, że jeden z atomów wodoru w cząsteczce wody został zastąpiony grupą węglowodorową R. Na poniższym rysunku przedstawiono porównanie budowy cząsteczki wody i metanolu.
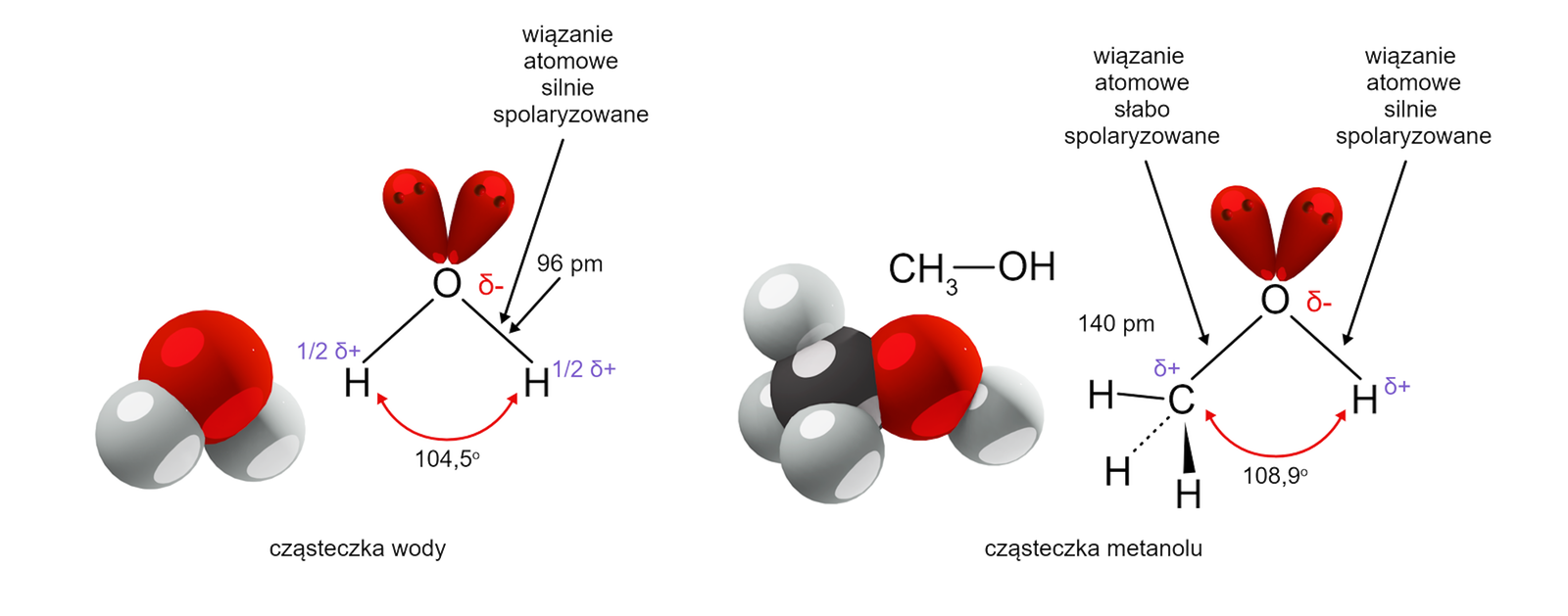
Czy budowa determinuje podstawowe właściwości fizyczne alkoholi?
Właściwości fizyczne
Poniżej przedstawiono właściwości fizyczne wybranych, nasyconych, alifatycznych alkoholi. Czy wszystkie alkohole mają te same cechy fizyczne?
Zapoznaj się z opisem grafiki dotyczącej właściwości fizycznych wybranych, nasyconych, alifatycznych alkoholi. Czy wszystkie alkohole mają te same cechy fizyczne?
Przeanalizuj poniższy wykres i wyjaśnij, jak zmienia się temperatura wrzenia i topnienia alkoholi w szeregu homologicznym.
- 1. zestaw danych:
- Alkohol: metanol
- Temperatura topnienia[°C]: -97.7; Podpis osi wartości: Temperatura (°C)
- Temperatura wrzenia[°C]: 64.65; Podpis osi wartości: Temperatura (°C)
- 2. zestaw danych:
- Alkohol: etanol
- Temperatura topnienia[°C]: -114.1; Podpis osi wartości: Temperatura (°C)
- Temperatura wrzenia[°C]: 78.30; Podpis osi wartości: Temperatura (°C)
- 3. zestaw danych:
- Alkohol: dekan-1-ol
- Temperatura topnienia[°C]: 6.9; Podpis osi wartości: Temperatura (°C)
- Temperatura wrzenia[°C]: 230; Podpis osi wartości: Temperatura (°C)
- 4. zestaw danych:
- Alkohol: dodekan-1-ol
- Temperatura topnienia[°C]: 23.5; Podpis osi wartości: Temperatura (°C)
- Temperatura wrzenia[°C]: 259; Podpis osi wartości: Temperatura (°C)
Rozpuszczalność
Obecność silnie spolaryzowanego wiązania determinuje właściwości fizyczne i chemiczne alkoholi. Silna polaryzacja wiązania sprawia, że cząsteczki alkoholi są dipolami.

Istnienie wolnych par elektronowych atomu tlenu w cząsteczce alkoholu oraz jego silna elektroujemność umożliwiają tworzenie wiązań wodorowych pomiędzy cząsteczkami alkoholi i wody, a także pomiędzy cząsteczkami alkoholi.
Im krótszy łańcuch węglowy cząsteczki alkoholu, tym bardziej polarny jest jej charakter. Wraz ze wzrostem liczby atomów węgla w łańcuchu, czyli wzrostem wpływu tego łańcucha na właściwości związku, maleje rozpuszczalność w wodzie i reaktywność alkoholi. Dzieje się tak dlatego, że długi łańcuch węglowodorowy staje się dominującą częścią cząsteczki alkoholu. Wyższe alkohole równie dobrze rozpuszczają się w rozpuszczalnikach organicznych, np. w heksanie i innych węglowodorach. Wraz ze wzrostem liczby grup w cząsteczce alkoholu, wzrasta ich rozpuszczalność w wodzie.
Zmiany właściwości alkoholi w szeregu homologicznymszeregu homologicznym przedstawiono na poniższych wykresach.
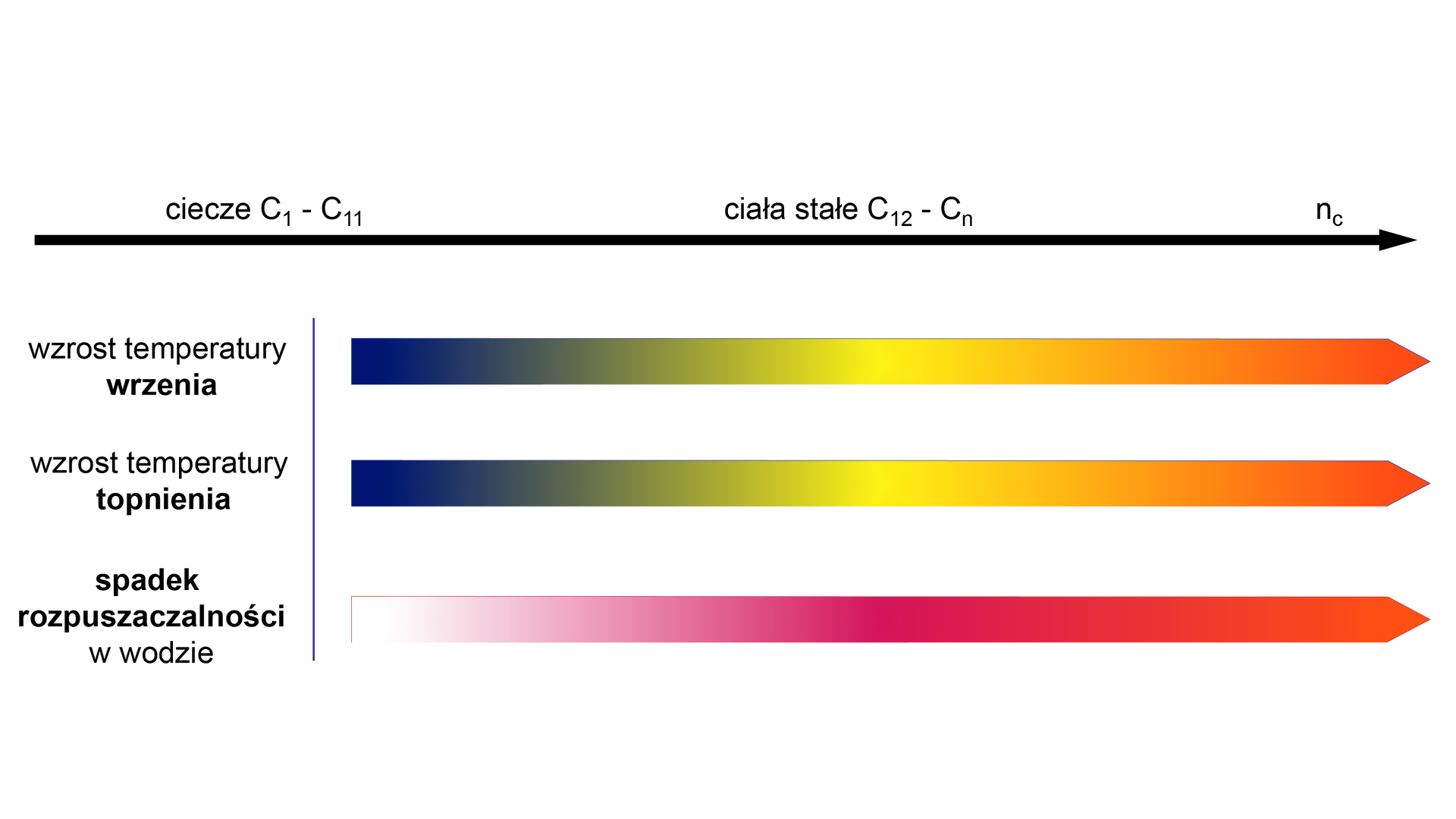
Pierwsze cztery, w szeregu homologicznym, nasycone alkohole monohydroksylowe mieszają się z wodą w każdym stosunku. Wynika to z ich zdolności do tworzenia z cząsteczkami wody wiązań wodorowych, z czym związane jest zjawisko kontrakcjizjawisko kontrakcji.
Kontrakcja
Mieszając etanol z wodą otrzymujemy mieszaninę, której objętość jest mniejsza od sumy objętości składników. Ta właściwość alkoholi wynika właśnie ze zjawiska kontrakcjikontrakcji.

Obecność grup prowadzi do asocjacji cząsteczek alkoholu, dzięki czemu nasycone alkohole monohydroksylowe mają temperatury wrzenia i topnienia odpowiednio wyższe od temperatur wrzenia i topnienia węglowodorów o tej samej liczbie atomów węgla w cząsteczce.
Dwa rodzaje oddziaływań, które wpływają na podwyższenie temperatur wrzenia i topnienia w cząsteczkach alifatycznych alkoholi w stosunku do odpowiednich alkanów, to wiązania wodorowe oraz oddziaływania dipol–diopl.

Słownik
ciąg związków org. o cząsteczkach, które zawierają jednakowe grupy funkcyjne i mają taką samą budowę chem., natomiast różnią się między sobą o taką samą jednostkę strukturalną
(łac. contractio „skurczenie”, „ściągnięcie”) zmiana objętości przy mieszaniu niektórych rozpuszczających się wzajemnie cieczy, np. wody i alkoholu
(gr. hydro „woda”, phobos „strach”) właściwość substancji, która polega na niezdolności jej cząsteczek (lub ich części) do oddziaływania z rozpuszczalnikami polarnymi, głównie z wodą bądź grupami polarnymi innych cząsteczek; cecha makroskopowa materiałów obrazuje brak zdolności do zwilżania przez wodę
(gr. hydro „woda”, philia „lubić”) właściwość substancji, która polega na zdolności jej cząsteczek (lub ich części) do oddziaływania z rozpuszczalnikami polarnymi, głównie z wodą bądź grupami polarnymi innych związków; cecha makroskopowa materiałów obrazuje zdolność do zwilżania wodą
Bibliografia
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.