Przeczytaj
Reakcje eliminacjieliminacji polegają na usuwaniu atomów lub grup atomów z cząsteczki, powodując zwiększenie nienasycenia cząsteczki lub jego cyklizację. Wyróżnia się dwa typy eliminacji: i , charakteryzujące się różnym przebiegiem oraz inną kinetyką.
Co oznacza litera oraz cyfra w danym typie reakcji eliminacji?
CząsteczkowośćCząsteczkowość reakcji oznacza ilość indywiduów chemicznych – (jonów lub atomów) substratów biorących udział w reakcji chemicznej. Natomiast rząd reakcjirząd reakcji odpowiada sumie wykładników potęg w danym równaniu kinetycznym. Oba typy mechanizmów – oraz , różnią się cząsteczkowością oraz rzędowością reakcji. O szybkości całego procesu decyduje zawsze najwolniejszy etap reakcji.
Reakcjom eliminacji najczęściej ulegają fluorowcopochodne węglowodorów oraz alkoholealkohole.
Od czego zależy szybkość eliminacji typu ?
Reakcja eliminacji typu zachodzi zgodnie z następującym mechanizmem:
Z pomiarów kinetyki wynika, że reakcje eliminacji typu zachodzą zgodnie z kinetyką rzędu i są opisane wzorem:
Dla eliminacji związków z fluorowcopochodnych węglowodorów:
Dla eliminacji cząsteczek z alkoholi (w środowisku silnego kwasu):
Gdzie oznacza szybkość reakcji chemicznejszybkość reakcji chemicznej i posiada jednostkę , , oznacza odpowiednio stężenie molowe halogenku alkilowego i alkoholu, a – stężenie molowe zasady Lewisa (donoru pary elektronowej) jako drugiego substratu w reakcji. Stała szybkości reakcji jest oznaczana literą i dla reakcji -rzędu posiada jednostkę .
Eliminacja typu jest zatem reakcją dwucząsteczkową, gdyż obie cząsteczki – (lub ) oraz są substratami reakcji. Ich stężenie wpływa na szybkość powstawania produktów, więc to od nich zależy szybkość reakcji.
Eliminacja typu zachodzi jednoetapowo z wytworzeniem stanu przejściowego, a moment jego powstawania jest najwolniejszym w całej reakcji, dlatego to szybkość jego utworzenia determinuje szybkość całej reakcji chemicznej.
Poniżej przedstawiono wykres energii dla jednoetapowego, dwucząsteczkowego mechanizmu typu :
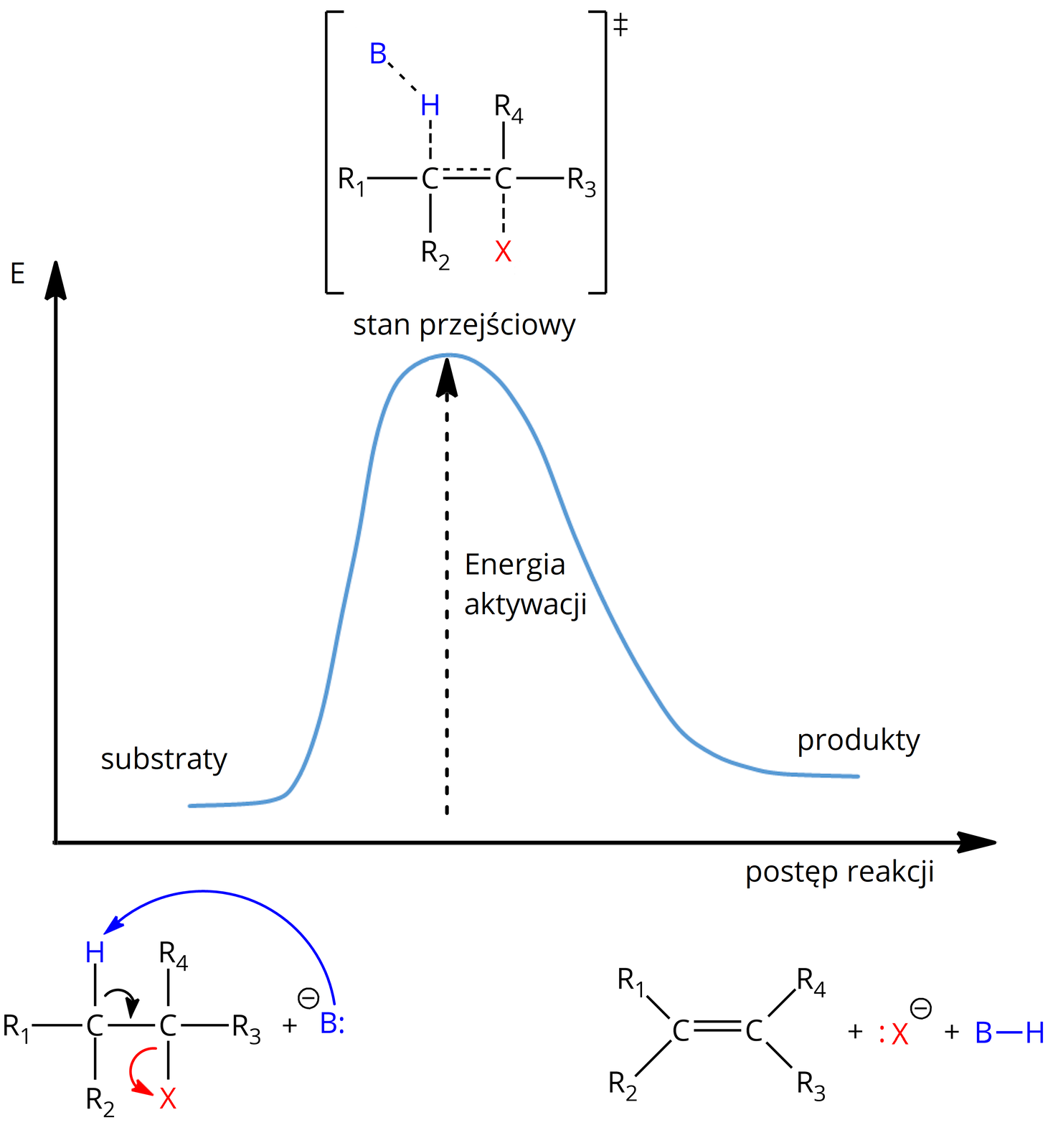
Aby substraty mogły przejść w produkty, konieczne jest pokonanie przez nie pewnej bariery energetycznej, czyli energii aktywacjienergii aktywacji. Jest to najmniejsza energia, którą muszą mieć cząsteczki, aby mogła zajść reakcja chemiczna. Moment osiągania przez indywidua chemiczne energii aktywacji to moment tworzenia stanu przejściowego. Jest to nietrwały układ, w którym następuje osłabienie istniejących wiązań i pojawienie się nowych oddziaływań, prowadzących do tworzenia nowych wiązań chemicznych. W przypadku reakcji eliminacji jest to tworzenie wiązań typu , zwiększających nienasycenie cząsteczki lub tworzenie wiązań powodujących zamknięcie łańcucha węglowego w pierścień.
Należy pamiętać, że im wyższa jest energia aktywacji, tym reakcja zachodzi wolniej. Im mocniejsza użyta zasada Lewisa , tym łatwiejsze oderwanie atomu wodoru, więc mniejsza jest energia aktywacji.
Od czego zależy szybkość eliminacji typu ?
Reakcja eliminacji typu zachodzi zgodnie z następującym mechanizmem:
Z pomiarów kinetyki wynika, że reakcje eliminacji typu zachodzą zgodnie z kinetyką rzędu i są opisane wzorem:
Gdzie oznacza szybkość reakcji chemicznej w jednostce , oznacza stężenie molowe fluorowcopochodnej węglowodoru, a to stała szybkości reakcji, która dla reakcji -rzędu posiada jednostkę . Eliminacja typu jest reakcją jednocząsteczkową, gdyż w pierwszym etapie reakcji udział bierze tylko jedna cząsteczka.
Pierwszym etapem reakcji eliminacji typu jest dysocjacja substratu i powstanie karbokationu. Jest to najwolniejszy etap reakcji, determinujący jej szybkość.
Wykres energii dla dwuetapowego, jednocząsteczkowego mechanizmu typu przedstawiono poniżej:

Reakcje eliminacji typu charakteryzują się występowaniem dwóch etapów reakcji, a więc cząsteczki muszę pokonać dwukrotnie barierę energetyczną, jaką jest energia aktywacji. Po pierwszym, najwolniejszym etapie następuje powstanie produktu przejściowego, który razem z atakującą go zasadą Lewisa są substratami w etapie drugim. Po pokonaniu przez nie energii aktywacji, następuje utworzenie produktów reakcji.
Pamiętaj, że na szybkość reakcji eliminacji ma wpływ stężenie substratów, przy czym relacja szybkość – stężenie to cecha indywidualna każdej reakcji i zależy od jej mechanizmu.
Na szybkość reakcji eliminacji mają duży wpływ również inne czynniki występujące w danym układzie. Tak jak dla wszystkich pozostałych reakcji chemicznych są to: temperatura, ciśnienie, rodzaj reagentów oraz stopień ich rozdrobnienia, katalizatory oraz inne czynniki, takie jak np. pH. Dla reakcji eliminacji szczególnym czynnikiem jest również rodzaj rozpuszczalnika.
Słownik
(łac. eliminare „usuwać”) reakcja chemiczna związków organicznych polegająca na odszczepieniu z ich cząsteczek grup atomów lub jonów
związki chemiczne fluorowców z wodorem, o ogólnym wzorze (gdzie – fluorowiec): fluorowodór , chlorowodór , bromowodór i jodowodór
(arab. al‑kuhl „delikatny proszek”) związki organiczne, pochodne węglowodorów, których cząsteczki zawierają grupę hydroksylową zamiast atomu wodoru związanego w związku macierzystym z atomem węgla grupy alkilowej lub cykloalkilowej, grupa musi być przyłączona do atomu węgla o hybrydyzacji
zmiana stężenia reagentów (substratów lub produktów) w jednostce czasu; opisywana równaniem , gdzie – stała szybkości reakcji chemicznej, , – stężenia molowe substratów, i – wykładniki potęgowe wyznaczane doświadczalnie
suma liczby cząsteczek biorących udział w reakcji chemicznej
rzędowość reakcji chemicznej; suma wykładników potęg, w których występują stężenia reagentów w równaniu kinetycznym
minimalna ilość energii, którą muszą mieć cząstki (cząsteczki, atomy, jony), aby mogła zajść między nimi reakcja chemiczna
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
McMurry J., Chemia organiczna, Warszawa 2000.