Przeczytaj
Czy pamiętasz, czym jest dysocjacja elektrolityczna i stała dysocjacji kwasowej?
Rozpuszczalne w wodzie kwasy nieorganiczne ulegają dysocjacji elektrolitycznej, co przedstawia poniższy schemat.
Rozpuszczalne w wodzie kwasy karboksylowe również ulegają dysocjacji elektrolitycznej, zgodnie ze schematycznym równaniem:
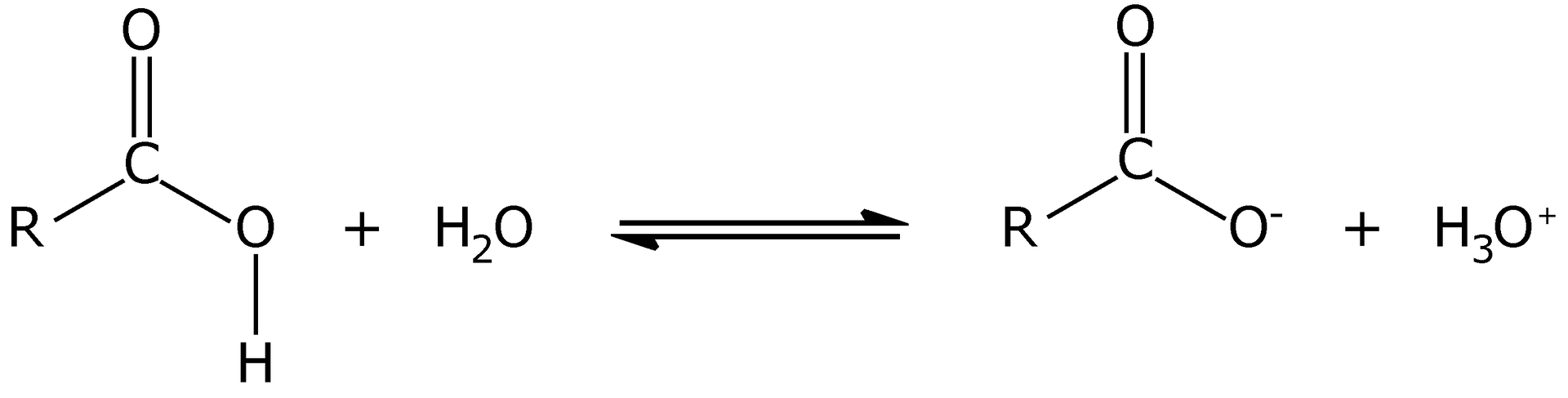
W roztworze wodnym kwasu nieorganicznego istnieje równowaga pomiędzy zdysocjowanymi jonami a niezdysocjowanymi cząsteczkami, których stężenia są powiązane zależnością, zwaną stałą dysocjacji kwasowej:
gdzie:
– stała dysocjacji kwasowej;
– stężenie anionu reszty kwasowej;
– stężenie kationu oksoniowego;
– stężenie niezdysocjowanego kwasu nieorganicznego.
Roztwór wodny kwasu karboksylowego również charakteryzuje się stałą dysocjacji kwasowej, która jest stosunkiem iloczynu stężeń anionów karboksylanowychanionów karboksylanowych i kationów oksoniowychkationów oksoniowych (hydroniowych) do stężenia niezdysocjowanego kwasu karboksylowego:
gdzie:
– stała dysocjacji kwasowej;
– stężenie anionu karboksylanowego;
– stężenie kationu oksoniowego;
– stężenie niezdysocjowanego kwasu karboksylowego.
Czym jest moc kwasu?
Każdy kwas charakteryzuje się swoją stałą dysocjacji kwasowej, która jest miarą jego mocymocy. Wyraża się ona stosunkiem stężenia substancji zdysocjowanej do niezdysocjowanej, dlatego im ma wyższą wartość, tym lepiej zachodzi dysocjacja, a więc kwas jest mocniejszy.
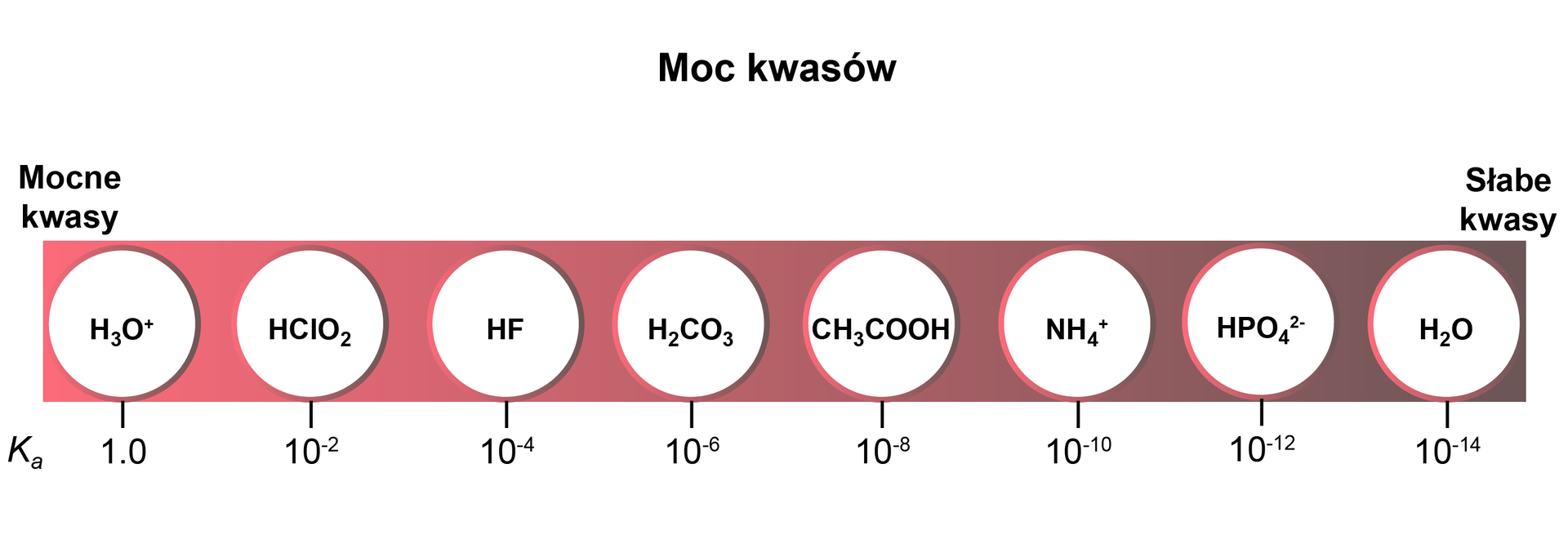
Na podstawie tabeli z wartościami stałych dysocjacji kwasowych zdecyduj, który z kwasów w podanych poniżej parach jest mocniejszy:
A. kwas siarkowodorowy czy kwas chlorowy(I);
B. kwas azotowy(III) czy kwas siarkowy(IV);
C. kwas węglowy czy kwas propanowy.
Porównanie mocy kwasów karboksylowych i nieorganicznych
Chcąc porównać moc dwóch kwasów między sobą, można również przeprowadzić reakcję chemiczną pomiędzy badanym kwasem a solą drugiego kwasu. Taka reakcja zajdzie, jeżeli kwas wchodzący w reakcję jest mocniejszy niż kwas, który powstaje. Potocznie mówi się, że mocniejszy kwas wypiera słabszy z roztworu jego soli.
Gdy substratem reakcji jest kwas słabszy od kwasu tworzącego sól, reakcja chemiczna nie zachodzi.
Porównanie mocy dwóch kwasów karboksylowych
Kwas mrówkowy (metanowy) charakteryzuje się stałą dysocjacji kwasowej, która wynosi , natomiast kwas octowy (etanowy) posiada niższą tę wartość: . Na podstawie porównania wartości stałych dysocjacji kwasowych można wnioskować, że kwas mrówkowy (metanowy) jest mocniejszy od kwasu octowego (etanowego). Zgodnie z powyższym, reakcja kwasu mrówkowego z solą kwasu octowego będzie przebiegać:
Obserwując przebieg reakcji, poczujesz charakterystyczny zapach octu, ze względu na powstający w reakcji kwas octowy. Reakcja odwrotna, tj. kwasu octowego z solą kwasu mrówkowego, nie zachodzi:
Porównanie mocy kwasu karboksylowego i kwasu nieorganicznego
Kwas octowy (etanowy) charakteryzuje się stałą dysocjacji kwasowej, która wynosi , natomiast kwas azotowy(V) posiada wyższą tę wartość: . Na podstawie porównania wartości stałych dysocjacji kwasowych można wnioskować, że kwas azotowy(V) jest mocniejszym kwasem od kwasu octowego, w związku z tym wypiera go z roztworów jego soli:
W trakcie przebiegu reakcji wyczuwalny jest charakterystyczny zapach octu. Reakcja kwasu słabszego z solą pochodną od kwasu mocniejszego nie zachodzi, w związku z tym kwas octowy nie reaguje z solą kwasu azotowego(V):
Słownik
anion powstały z kwasu karboksylowego po dysocjacji elektrolitycznej
kation powstający podczas dysocjacji elektrolitycznej kwasu
zdolność kwasu do dysocjacji elektrolitycznej
samorzutny proces rozpadu cząsteczek elektrolitów (kwasów, zasad, soli) w roztworach na dodatnio i ujemnie naładowane cząstki, tj. jony
stosunek iloczynu stężeń jonów powstających podczas dysocjacji elektrolitycznej do stężenia cząsteczek niezdysocjowanych, które pozostają w równowadze chemicznej z jonami
związki organiczne, których cząsteczki zawierają grupę karboksylową () połączoną z grupą alifatyczną, alicykliczną, aromatyczną lub heterocykliczną
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 2010.
Jelińska‑Kazimierczuk M., Megiel E., Teraz matura. Vademecum, Warszawa 2015.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 2, Warszawa 2016.
Mizerski W., Tablice chemiczne, Warszawa 2004.
McMurry J., Chemia organiczna. T. 4, tłum. H. Koroniak i inni, Warszawa 2018.
Morrison R. T., Boyd R. N., Chemia organiczna. T. 1, tłum. W. Antkowiak i inni, Warszawa 1985.
Sawicka J., Janich‑Kilian A., Cejner‑Maria W., Urbańczyk G., Tablice chemiczne, Gdańsk 2001.