Przeczytaj
Jaki charakter mogą wykazywać tlenki?
TlenkiTlenki mogą wykazywać charakter kwasowy, zasadowy, amfoteryczny lub obojętny. Takie tlenki nazywa się kolejno: kwasowymi, zasadowymi, amfoterycznymi lub obojętnymi. Aby określić, jaki charakter chemiczny wykazuje dany tlenek, należy sprawdzić czy dany tlenek reaguje z kwasem oraz czy reaguje z wodnym roztworem wodorotlenku.
Pamiętaj, że charakter chemiczny tlenku określa nam jego zachowanie wobec zasad i kwasów, nie zaś np. wody czy innych tlenków. Nie mniej jednak i tutaj znajdziemy pewną prawidłowość, np. tlenki kwasotwórcze, a więc reagujące z wodą z wytworzeniem kwasów, mają również charakter kwasowy, a więc reagują z zasadami a nie reagują z kwasami. Jednak nie zawsze działa to w drugą stronę, tzn. nie każdy tlenek kwasowy jest jednocześnie tlenkiem kwasotwórczym, np. . Podobnie ma się rzecz w przypadku tlenków zasadowych. Wszystkie tlenki zasadotwórcze, a więc te reagujące z wodą z wytworzeniem zasad, wykazują charakter zasadowy, ale nie wszystkie tlenki zasadowe są jednocześnie zasadotwórcze, np. i mimo zasadowego charakteru są obojętne wobec wody. Poniżej przedstawiono graf ilustrujący podział tlenków ze względu na charakter chemiczny.
- Nazwa kategorii: Charakter chemiczny tlenków
- Nazwa kategorii: Kwasowy
- Nazwa kategorii: Reagują z wodnymi roztworami wodorotlenków tworząc sole.
- Nazwa kategorii: W większości reagują z wodą tworząc odpowiednie kwasy.
- Nazwa kategorii: Tworzą sole z tlenkami zasadowymi. Koniec elementów należących do kategorii Kwasowy
- Nazwa kategorii: Zasadowy
- Nazwa kategorii: Reagują z kwasami tworząc sole.
- Nazwa kategorii: Tlenki litowców i berylowców reagują z wodą tworząc odpowiedni wodorotlenek. Koniec elementów należących do kategorii Zasadowy
- Nazwa kategorii: Amfoteryczny
- Nazwa kategorii: Reagują z kwasami i wodnymi roztworami wodorotlenków tworząc sole.
- Nazwa kategorii: Zazwyczaj nie reagują z wodą. Koniec elementów należących do kategorii Amfoteryczny
- Nazwa kategorii: Obojętny
- Nazwa kategorii: Nie reagują z kwasami, wodnymi roztworami wodorotlenków ani z wodą. Koniec elementów należących do kategorii Obojętny
- Elementy należące do kategorii Charakter chemiczny tlenków
- Elementy należące do kategorii Kwasowy
- Elementy należące do kategorii Zasadowy
- Elementy należące do kategorii Amfoteryczny
- Elementy należące do kategorii Obojętny
Tlenki kwasowe
Są to tlenki niemetali oraz tlenki niektórych metali, które reagują z wodnymi roztworami wodorotlenków, a nie reagują z kwasami.
Tlenki kwasowe pierwiastków | ||
bloku | bloku | bloku |
brak | - | - |
W reakcjach tlenków kwasowych z roztworami wodorotlenków powstaje sól i woda. Reakcję tą można zapisać w sposób ogólny jako:
Doświadczenie: Badanie charakteru chemicznego tlenku siarki().
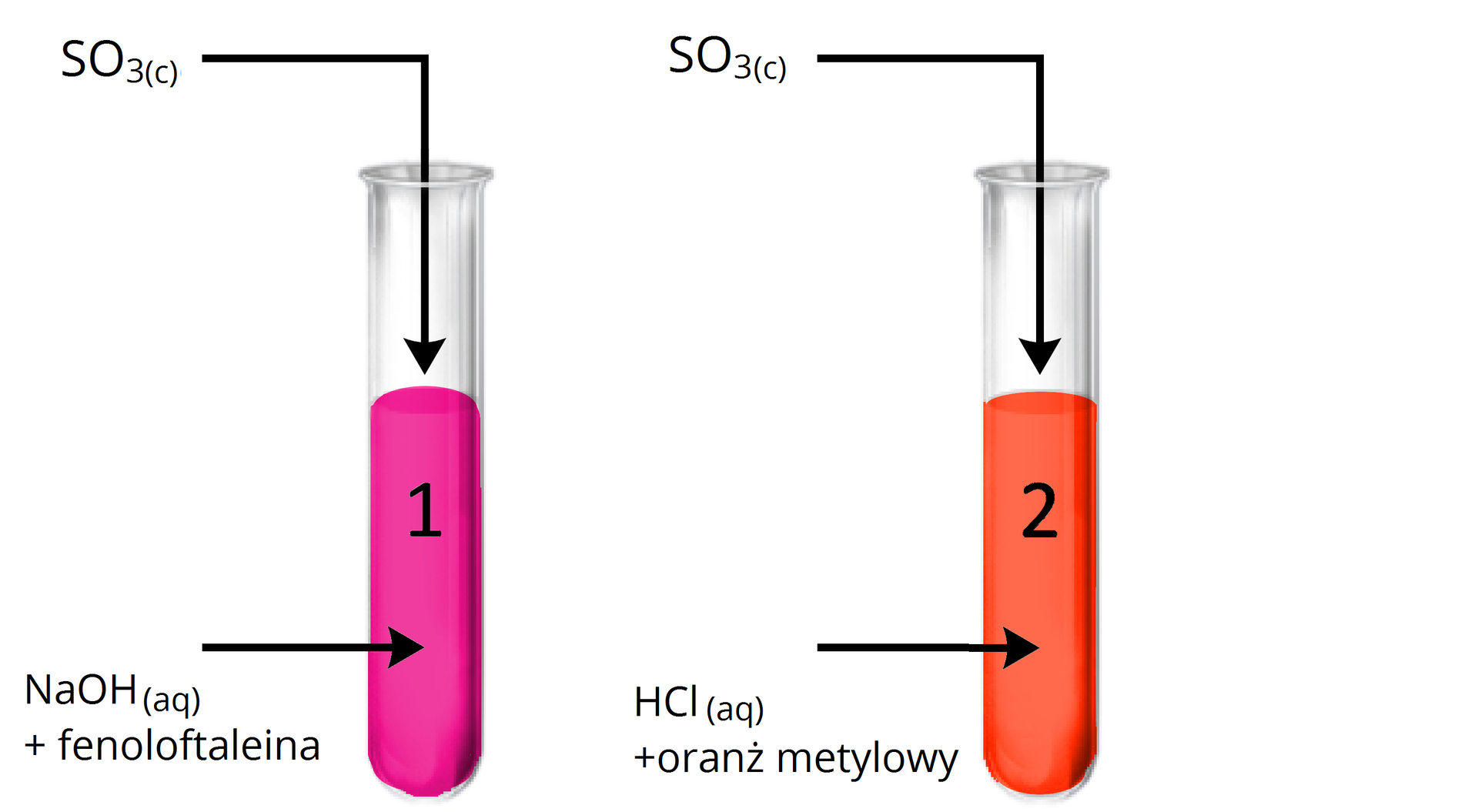
Obserwacje:
Probówka : Malinowy roztwór uległ odbarwieniu.
Probówka : Brak widocznych objawów reakcji.
Wniosek:
Tlenek siarki() jest tlenkiem kwasowym, ponieważ reaguje z zasadą (wodnym roztworem wodorotlenku), a nie reaguje z kwasem.
Równanie reakcji chemicznej z zasadą:
W formie cząsteczkowej:
W formie jonowej – skróconej:
Równanie reakcji chemicznej z kwasem:
Tlenki zasadowe
Są to tlenki metali, które reagują z kwasami, a nie reagują z wodorotlenkami.
Tlenki zasadowe metali | ||
bloku | bloku | bloku |
Wszystkie za wyjątkiem na przykład: | - | - |
W reakcjach tlenków zasadowych z kwasem powstaje sól i woda. Reakcję tą można zapisać w sposób ogólny jako:
Doświadczenie: Badanie charakteru chemicznego tlenku baru.
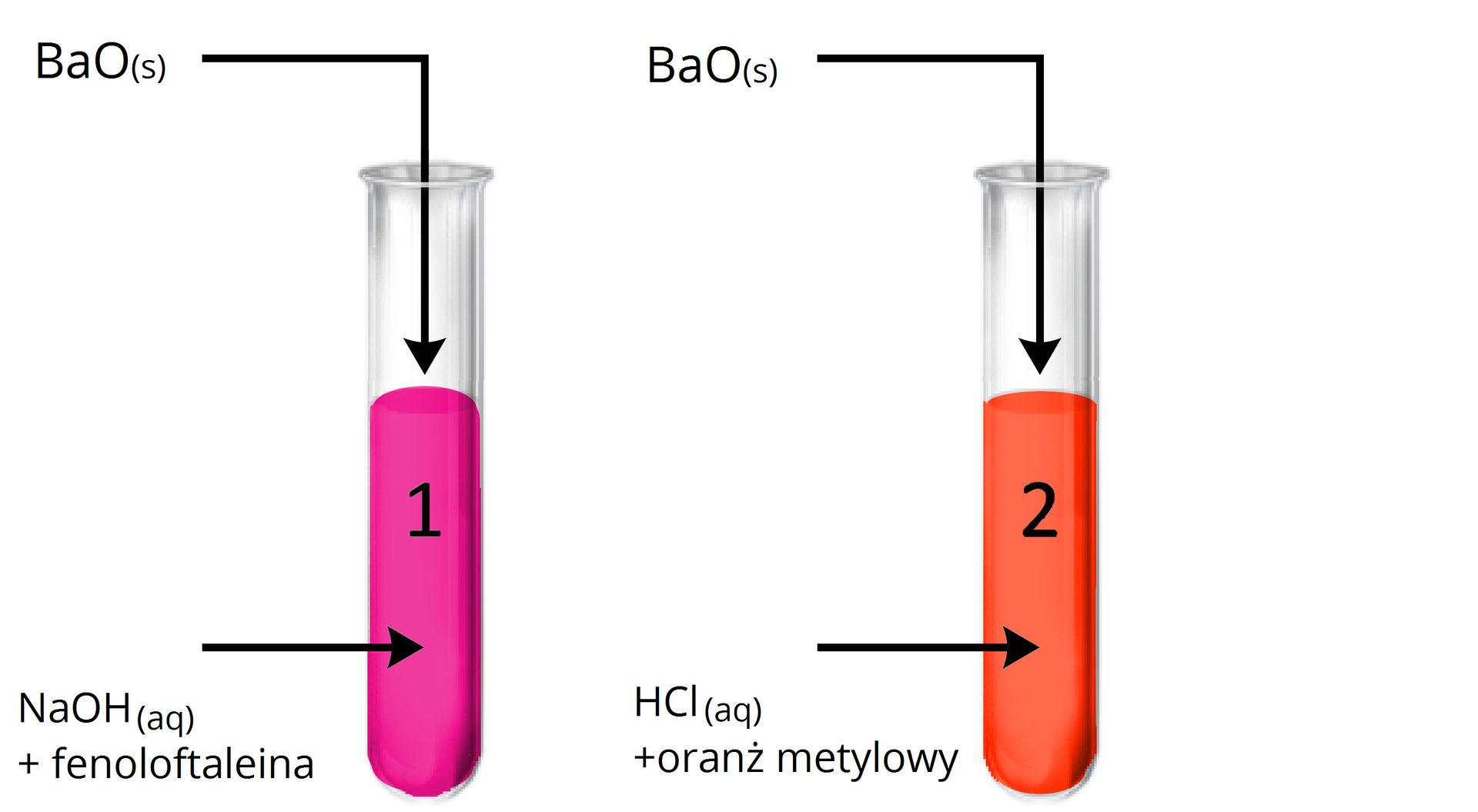
Obserwacje:
Probówka : Brak widocznych oznak reakcji z zasadą.
Probówka : Ciało stałe uległo roztworzeniu. Roztwór zmienił barwę z czerwonej na żółtopomarańczową.
Wniosek:
Tlenek baru jest tlenkiem zasadowym, ponieważ reaguje z kwasem, a nie reaguje z zasadą (wodnym roztworem wodorotlenku).
Równanie reakcji chemicznej z kwasem:
W formie cząsteczkowej:
W formie jonowej – skróconej:
Równanie reakcji chemicznej z wodorotlenkiem:
Tlenki amfoteryczne
Są to tlenki metali oraz niemetali, które reagują zarówno z mocnymi kwasami jak i mocnymi zasadami (wodnymi roztworami wodorotlenków). Tlenki amfoteryczne nie reagują z wodą.
Tlenki amfoteryczne pierwiastków | ||
bloku | bloku | bloku |
- | - | - |
W reakcji tlenków amfoterycznych z mocnym kwasem powstaje sól i woda zgodnie z poniższym ogólnym równaniem reakcji:
W reakcji tlenków amfoterycznych z mocną zasadą (na przykład wodny roztwór lub ) powstaje związek koordynacyjny, tzw. sól kompleksowa, w której kation metalu stanowi atom centralny, a aniony wodorotlenkowe pełnią funkcję ligandów. W reakcji jednym z substratów jest również woda. Schemat równania tej reakcji można zapisać w sposób ogólny:
Doświadczenie: Badanie charakteru chemicznego tlenku cynku.
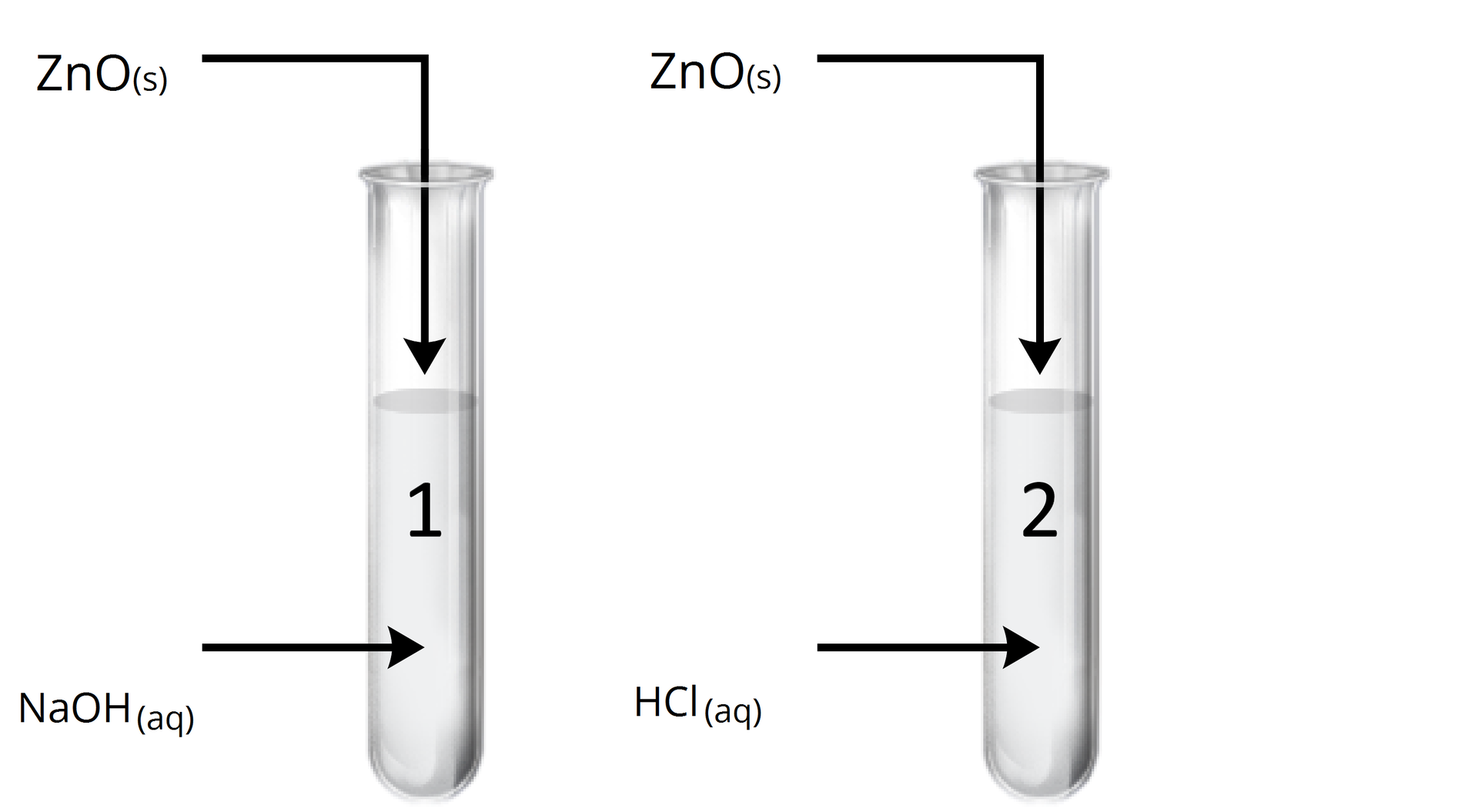
Obserwacje:
Probówka : Ciało stałe uległo roztworzeniu. Powstał klarowny bezbarwny roztwór.
Probówka : Ciało stałe uległo roztworzeniu. Powstał klarowny bezbarwny roztwór.
Wniosek:
Tlenek cynku jest tlenkiem amfoterycznym, ponieważ reaguje z kwasem oraz z zasadą (wodnym roztworem wodorotlenku).
Równania reakcji chemicznych:
Probówka
W formie cząsteczkowej:
W formie jonowej – skróconej:
Probówka
W formie cząsteczkowej:
W formie jonowej – skróconej:
Tlenki obojętnie
Są to tlenki, które nie reagują z kwasami, roztworami wodnymi wodorotlenków oraz z wodą. Tlenkami obojętnymi są np. tlenki pierwiastków bloku : , , , .
Podsumowanie
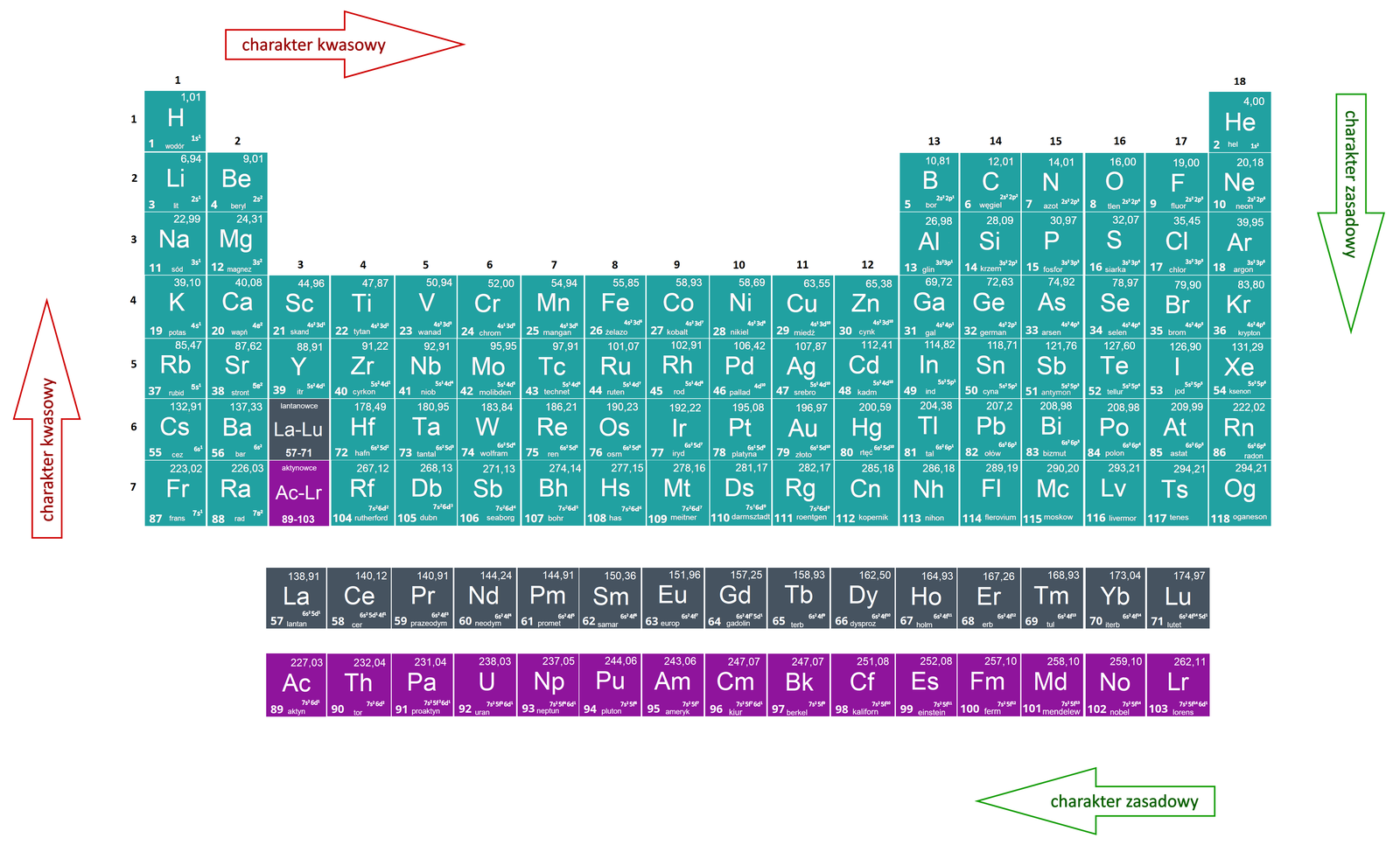
Pewne zależności dotyczące charakteru chemicznego tlenków można odczytać z układu okresowego. Strzałki czerwone oznaczają wzrost właściwości kwasowych tlenków, a strzałki zielone oznaczają wzrost właściwości zasadowych tlenków w grupie i okresie.
Słownik
dwupierwiastkowe związki chemiczne tlenu z innym pierwiastkiem, w których atomy tlenu występują na stopniu utlenienia
tlenki, które reagują z zasadami, a nie reagują z kwasami
tlenki, które reagują z kwasami, a nie reagują z zasadami
tlenki, które reagują z mocnymi kwasami oraz roztworami wodnymi mocnych wodorotlenków
tlenki, które nie reagują ani z kwasami, ani z roztworami wodnymi wodorotlenków; nie reagują również z wodą
Bibliografia
Bielański A., Podstawy chemii nieorganicznej , Warszawa .
Pazdro K. M,, CHEMIA Podręcznik do kształcenia rozszerzonego w liceach, Część . Chemia nieorganiczna, Warszawa .