Przeczytaj
Jak powstają peptydy?
Peptydy to organiczne związki chemiczne, które powstają przez połączenie dwóch lub więcej aminokwasów za pomocą wiązania peptydowego. Proces ten nazywany jest kondensacjąkondensacją, a w jego wyniku, oprócz peptydu, powstaje również cząsteczka wody. Ogólny schemat kondensacji został zaprezentowany na poniższym rysunku:
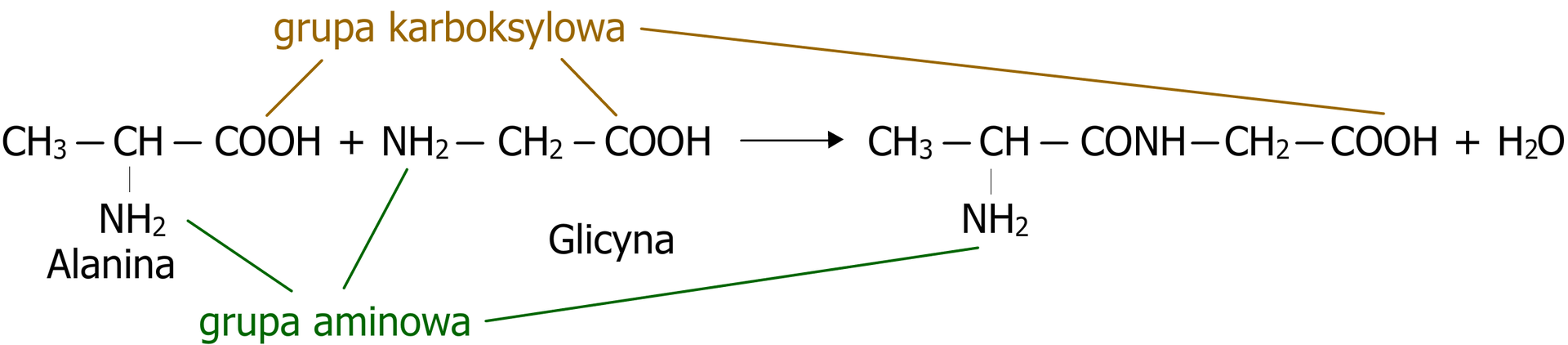
Zerwanie wiązania peptydowego
Reakcja odwrotna, w wyniku której dochodzi do zerwania wiązania peptydowego i odtworzenia poszczególnych aminokwasów, nazywana jest hydrolizą. Schemat reakcji został pokazany na poniższej ilustracji:
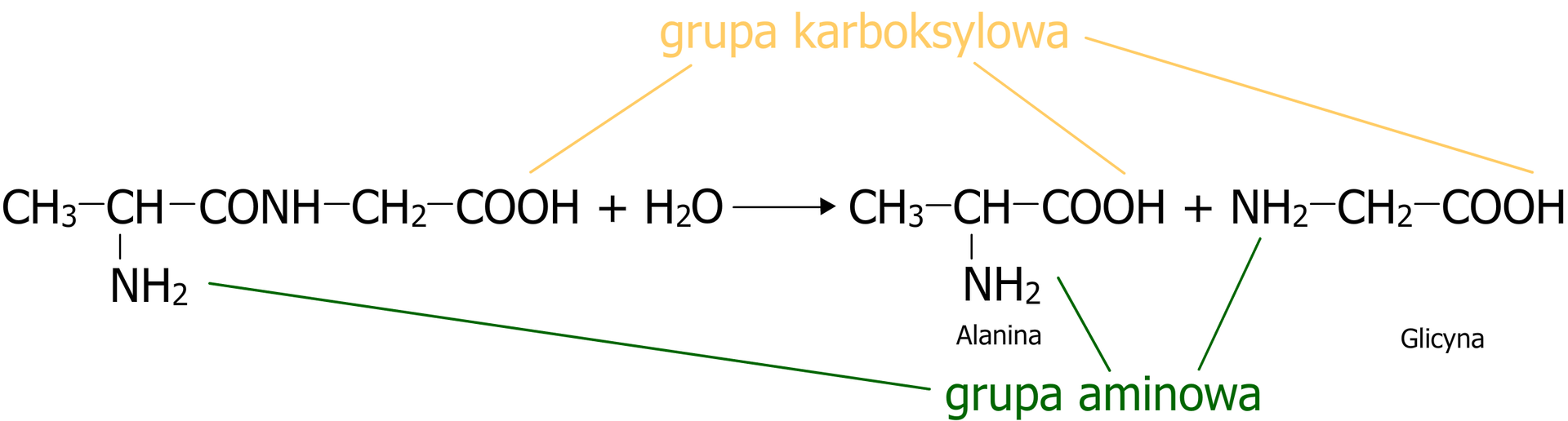
Jak łatwo zauważyć, przedstawione powyżej reakcje są reakcjami odwracalnymi, to znaczy, że mogą zachodzić w dwóch różnych kierunkach zgodnie z tym samym równaniem. Równanie reakcji odwracalnej zaznacza się strzałką w obie strony, co zostało przedstawione na poniższym równaniu:
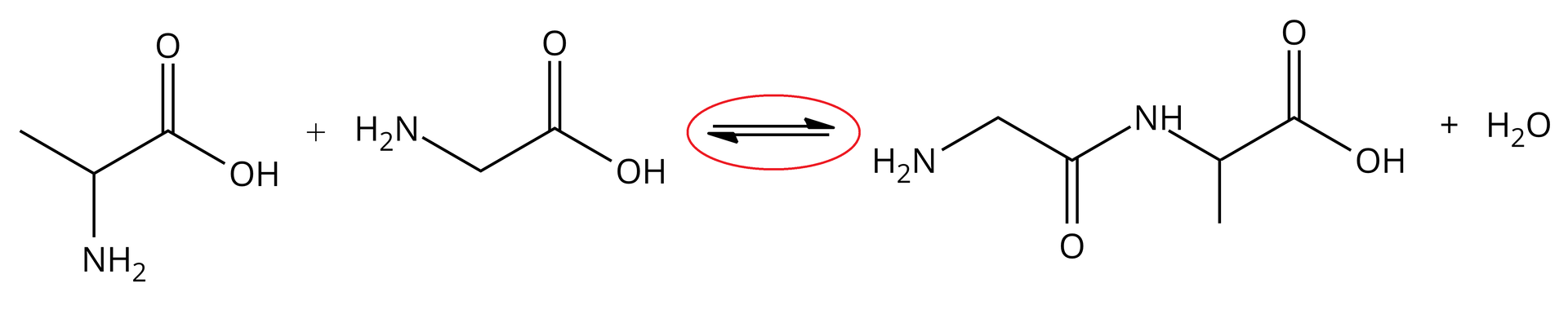
Wiązanie peptydowe
Istotnym wiązaniem, umożliwiającym powstawanie peptydów, jest wiązanie peptydowe. Występuje ono pomiędzy atomem azotu z grupy aminowej () a atomem węgla z grupy karboksylowej () i zostało zaprezentowane na poniższej ilustracji.

Peptydy można podzielić ze względu na ilość aminokwasów, które je budują:
oligopeptydy – od dwóch do dziesięciu reszt aminokwasowych;
polipeptydy – od jedenastu do stu reszt aminokwasowych,
białka – umownie przyjęło się mówić o białkach, gdy cząsteczka składa się z powyżej stu reszt aminokwasowych.
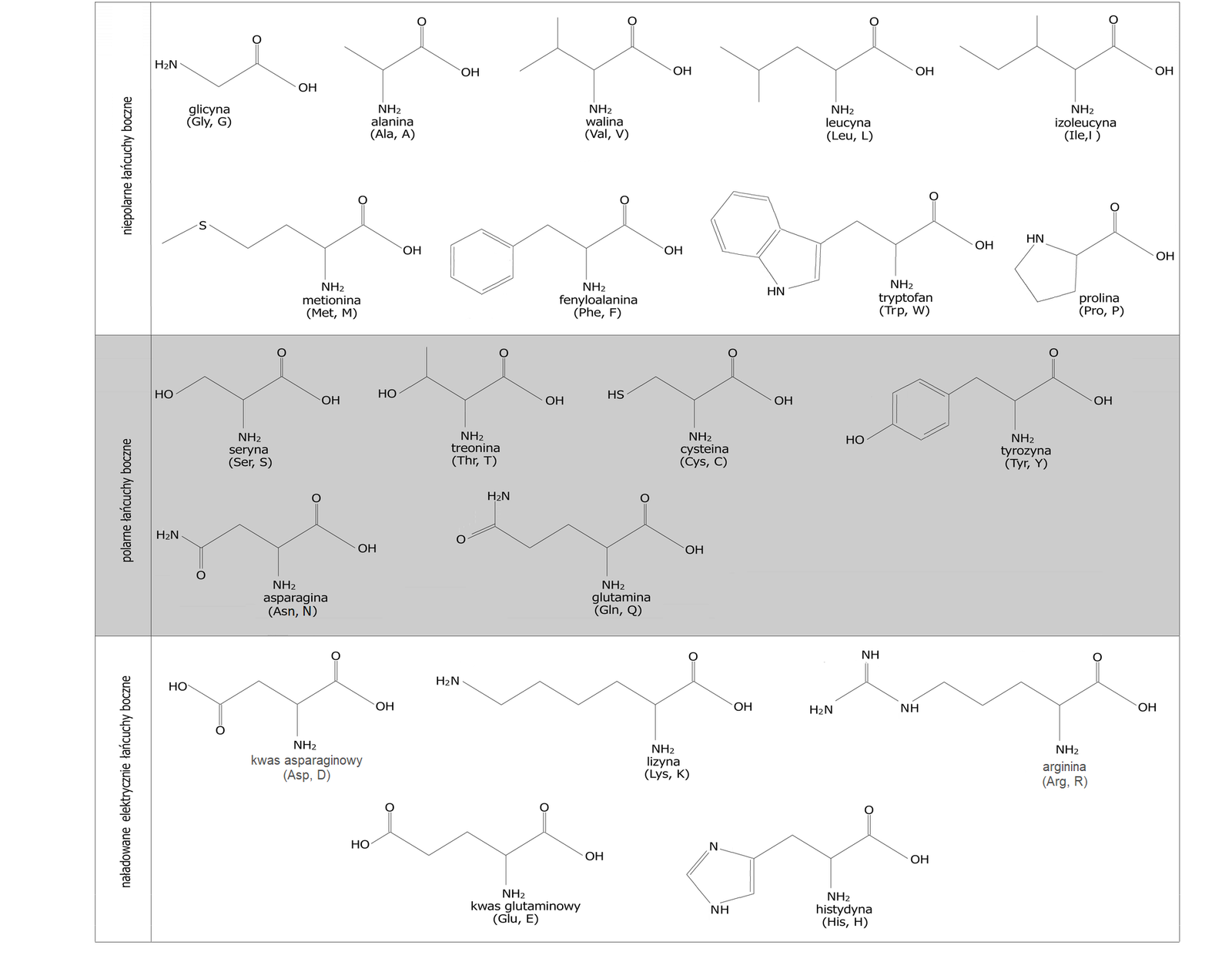
Wzory aminokwasów
Wzory peptydów, na pierwszy rzut oka, wydają się skomplikowanym tworem, ale kiedy poznamy zasady, wg których powstają, wszystko się wyjaśnia. Ważne jest, aby w trakcie tworzenia wzorów peptydów mieć przed oczami tabelę, w której zawarte są wzory aminokwasów białkowych oraz ich skróty. Taką tabelę możesz przeanalizować poniżej:
Dla pierwszego przykładu weźmy najprostszy aminokwas, glicynę, której wzór strukturalny wygląda tak:
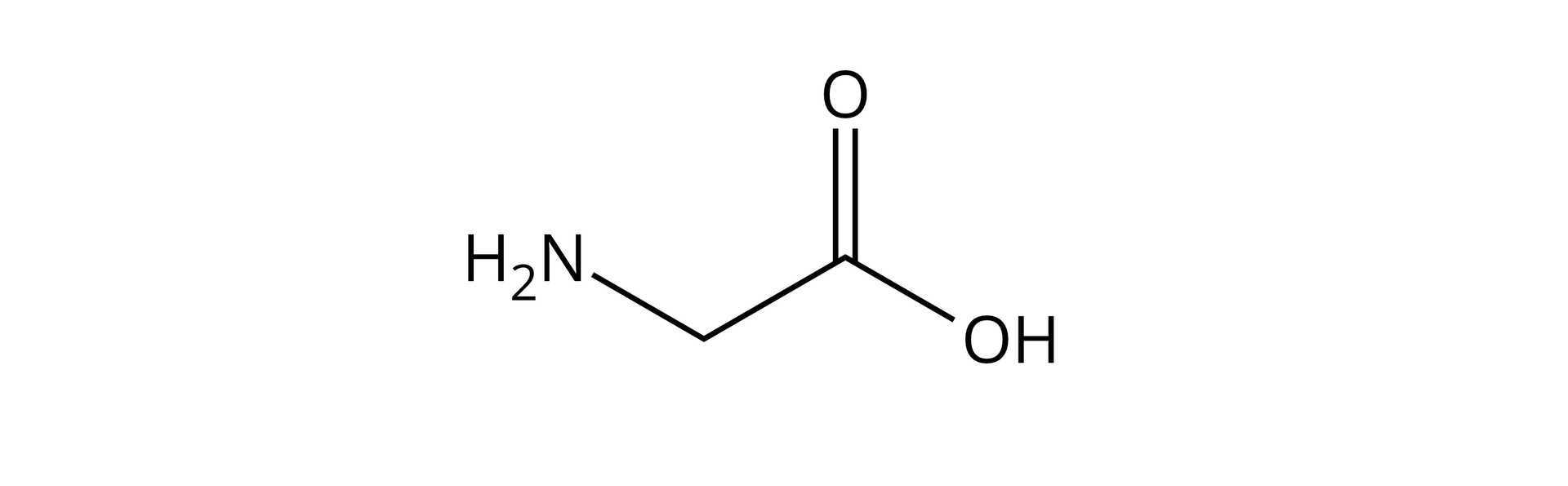
Teraz poddajemy dwie cząsteczki glicyny procesowi kondensacji, w wyniku której, jako produkt, powstaje nam dipeptyd, glicyloglicyna, oraz woda. Równanie tej reakcji zostało przedstawione poniżej:
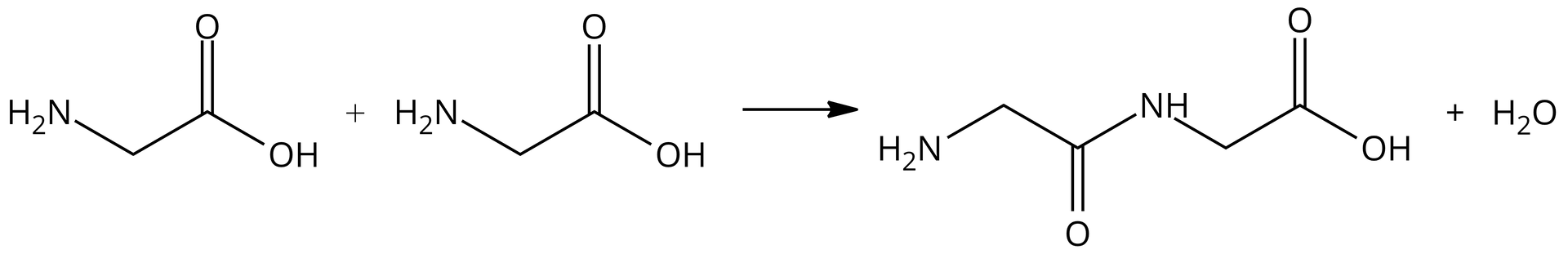
We wzorze „nowego” dipeptydu można dopatrzeć się części ze „starych” aminokwasów, które uległy kondensacji:

Z „żółtego” aminokwasu zabrano całą grupę hydroksylową , a z aminokwasu „niebieskiego” odebrano jedynie atom wodoru od grupy aminowej (). Wiązanie powstało między atomem węgla a atomem azotu:
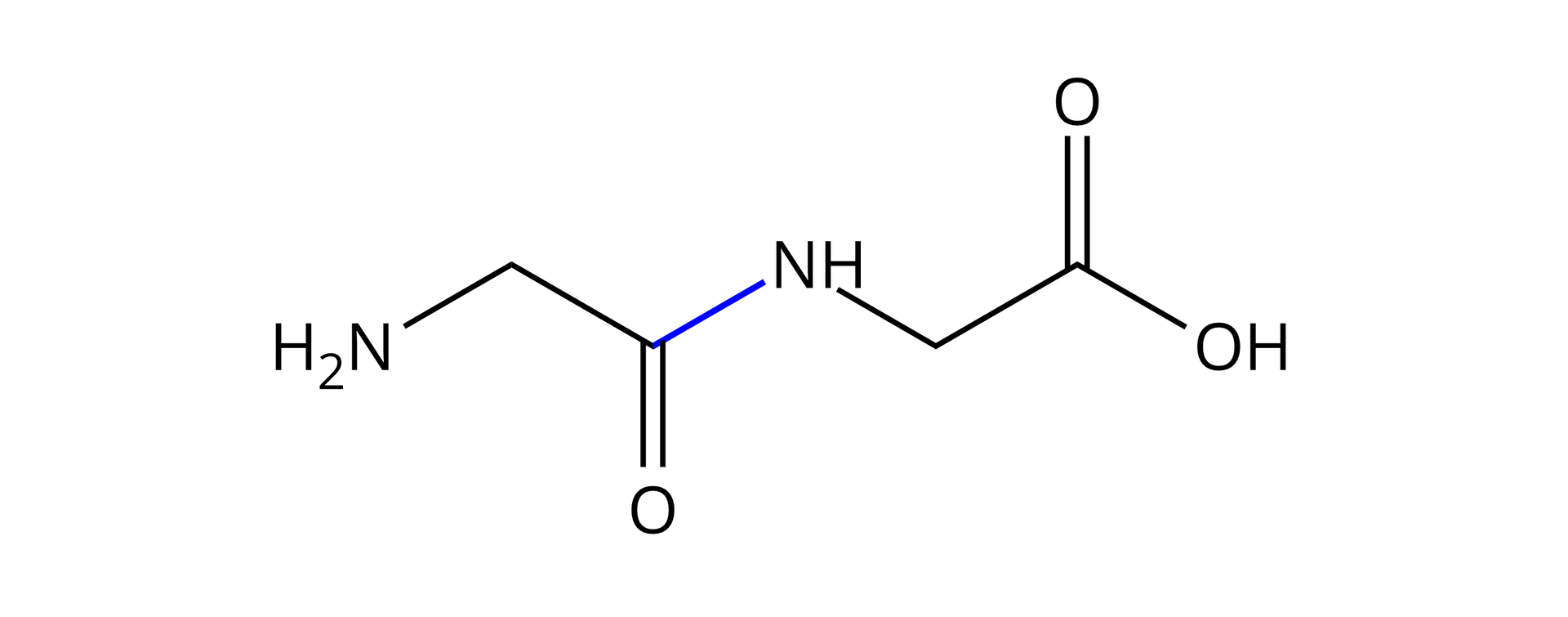
W ten sposób udało nam się uzbierać części na stworzenie cząsteczki wody, która również jest produktem w reakcji kondensacji, a często się o niej zapomina.
Jak zapisuje się wzory peptydów i jak tworzy się ich nazwy?
Przyjęło się, że wzory peptydów pisze się od N‑końcaN‑końca do C‑końcaC‑końca. N‑koniec to ten aminokwas, który ma wolną grupę i w wiązanie angażuje grupę , natomiast C‑koniec to aminokwas z wolną grupą i związaną grupą . Patrząc na nasz przykład, oba końce mają się następująco:

W nazewnictwie peptydów nazwę określa się od N‑końca do C‑końca. Przyjęło się, aby wzory rysować również w tym kierunku: od N‑końca do C‑końca. Temu aminokwasowi, który angażuje grupę karboksylową i jednocześnie ma wolną grupę (czyli innymi słowy pierwszy aminokwas od N‑końca), dodaje się końcówkę -ylo lub -ilo. Robi się tak z każdym kolejnym aminokwasem, aż do momentu, gdy zostaje aminokwas z C‑końca, którego nazwa nie zostaje zmieniona. Teraz, żeby móc to przyswoić, poniżej zostały zaprezentowane niektóre nazwy peptydów z wykorzystaniem oznaczeń jednoliterowych aminokwasów:
Wzór | Nazwa |
|---|---|
G – A | glicyloalanina |
F – W | fenyloalanylotryptofan |
N – K | asparagylolizyna |
P – S – G | prolinyloseryloglicyna |
K – H – R | lizynylohistydyloarginina |
Ważne jest, aby pamiętać o pisaniu nazw oraz rysowaniu wzorów zawsze w tej kolejności: N‑koniecN‑koniec C‑koniecC‑koniec. Jest to istotne, ponieważ z kondensacji dwóch różnych aminokwasów mogą powstać tak naprawdę cztery różne produkty. Dla przykładu: kiedy w probówce mamy glicynę i alaninę, mogą powstać cztery dipeptydy – glicyloalanina, alaniloglicyna, glicyloglicyna i alaniloalanina. Również we wzorach widać znaczącą różnicę:
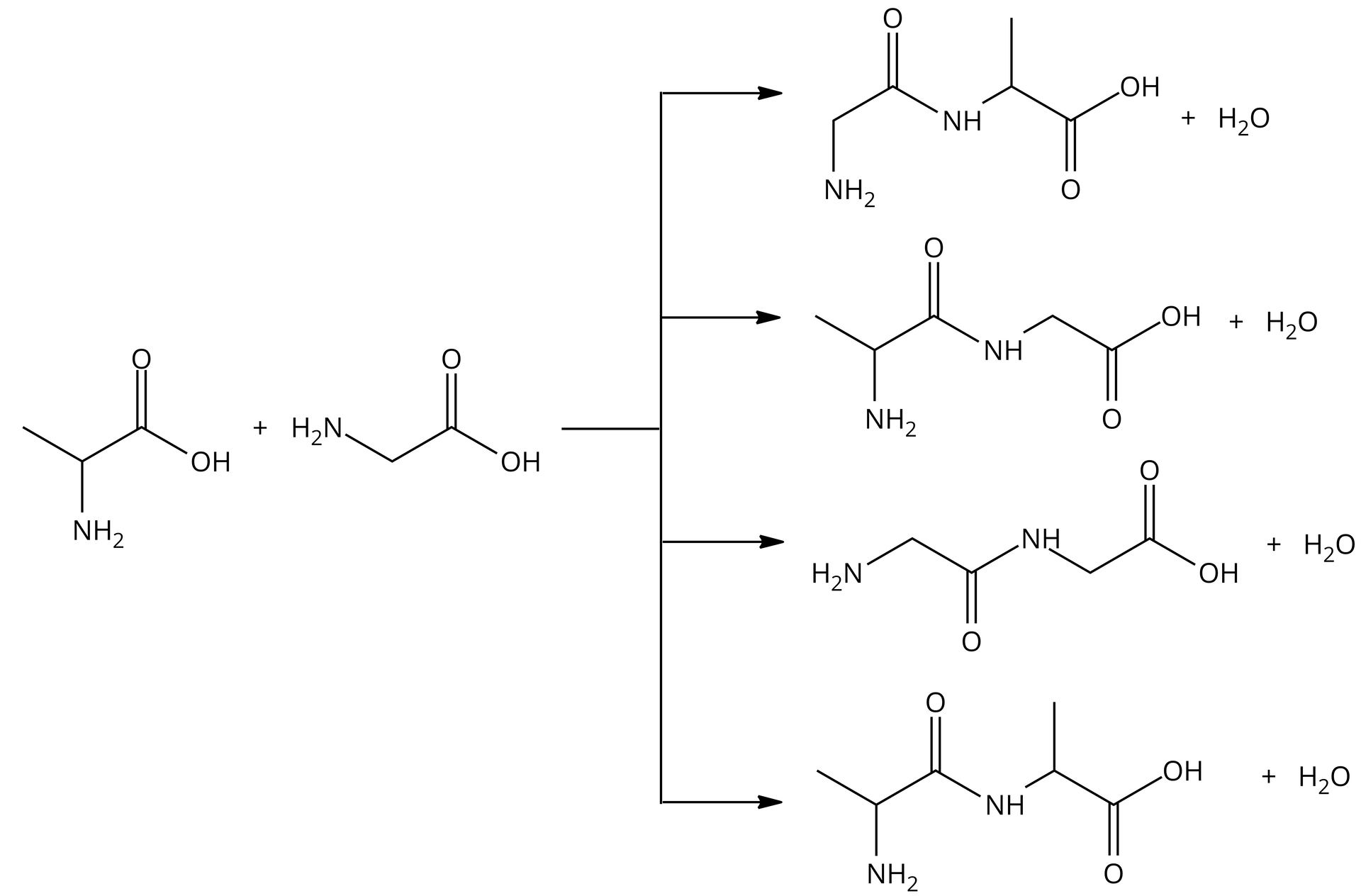
Zrozumienie, w jaki sposób zapisuje się wzory peptydów oraz ich nazwy, wymaga ćwiczeń. Należy pamiętać o kilku ważnych zasadach, które zostały zapisane poniżej:
Wzory peptydów rysuje się od N‑końca do C‑końca.
Nazwy peptydów pisze się od N‑końca do C‑końca.
Do nazw wszystkich aminokwasów, których grupa karboksylowa jest zaangażowana w wiązanie peptydowe, dodaje się końcówkę -ylo lub -ilo.
Nazwa aminokwasu na C‑końcu pozostaje bez zmian.
Słownik
koniec peptydu zawierający wolną grupę aminową ;
koniec peptydu zawierający wolną grupę karboksylową
reakcja polegająca na połączeniu dwóch lub więcej aminokwasów za pomocą wiązania peptydowego; w jej wyniku, oprócz peptydu, powstaje również cząsteczka wody
Bibliografia
Doonan S., Zawadzki Z., Białka i peptydy, Warszawa 2008.
Kłyszejko‑Stefanowicz L., Ćwiczenia z biochemii, Warszawa 2003.
Stryer L., Berg J. M., Tymoczko J. L., Biochemia. Część 1, Moleku;arny wzór zycia, Warszawa 2009, wyd 4.