Przeczytaj
Czym jest krystalizacja?
KrystalizacjaKrystalizacja to proces powstawania ciał stałych z fazy ciekłej lub gazowej. Najczęściej temu procesowi ulegają ciecze (w określonych warunkach ciśnienia i temperatury). Przykładem krystalizacji, który możesz znać z natury, jest tworzenie się kamieni szlachetnych i złóż minerałów, takich jak szmaragd, szafir, rubin itd. Przykłady te możesz zobaczyć poniżej.
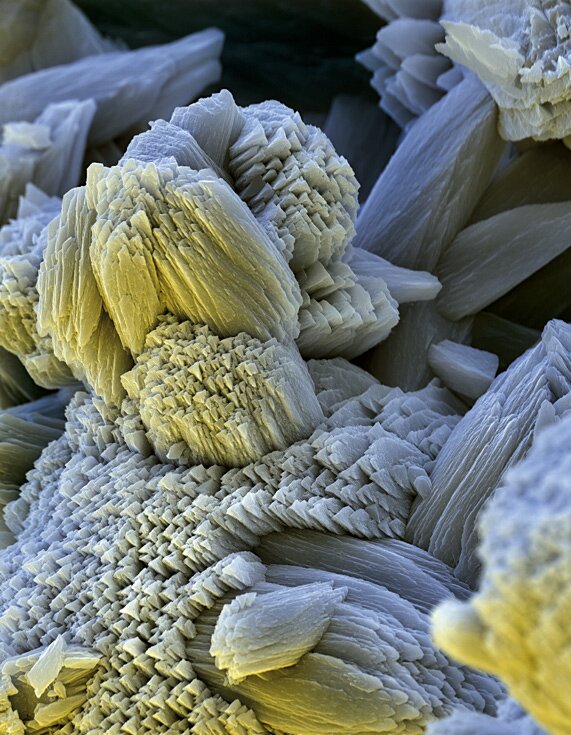
Krystalizacja to w wielu przypadkach pożądany i kontrolowany proces selektywnego rozdzielania, w którym tworzą się kryształy o ważnych ze względu zastosowania produktu cechach, takich jak np. rozmiar i kształt. Wśród przemysłowych zastosowań krystalizacji można wyróżnić np. produkcję cukru, soli kuchennej czy sody kalcynowanej. Spora część produktów farmaceutycznych jest oczyszczana za pomocą procesu krystalizacji. Krystalizacja nierzadko bywa również zjawiskiem niepożądanym. Przykładem jest powstawanie kamienia kotłowego, którego fotografię (wykonaną techniką mikroskopową) możesz zobaczyć poniżej.
Niezwykle wysoka selektywność procesu krystalizacji wynika z bardzo regularnej struktury kryształów, w których bloki budulcowe (cząsteczki, jony lub atomy) są ułożone w uporządkowanej strukturze mikroskopowej. Utworzona sieć krystaliczna rozciąga się we wszystkich kierunkach. Ponieważ zanieczyszczenia często mają inny rozmiar i kształt niż produkt docelowy, zazwyczaj nie pasują do sieci krystalicznej. Mają one tendencję do pozostawania w fazie ciekłej, podczas gdy kryształy składają się prawie całkowicie z fragmentów żądanej substancji.
Kryształy z dobrze kontrolowanego procesu krystalizacji mogą mieć nawet sto czy tysiąc razy mniejsze stężenie zanieczyszczeń niż ciecz, z której wyrosły. Nawet po jednym etapie procesu krystalizacji kryształy mogą osiągnąć czystość powyżej .
Przykłady naturalnych procesów krystalizacji
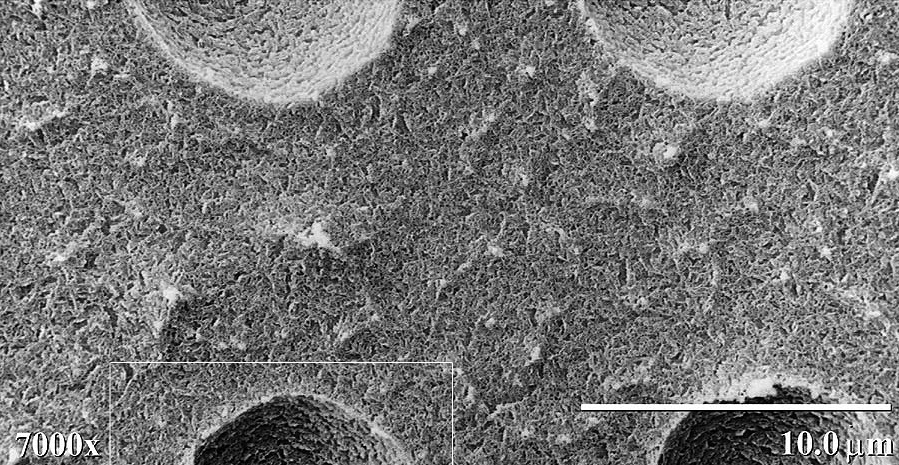
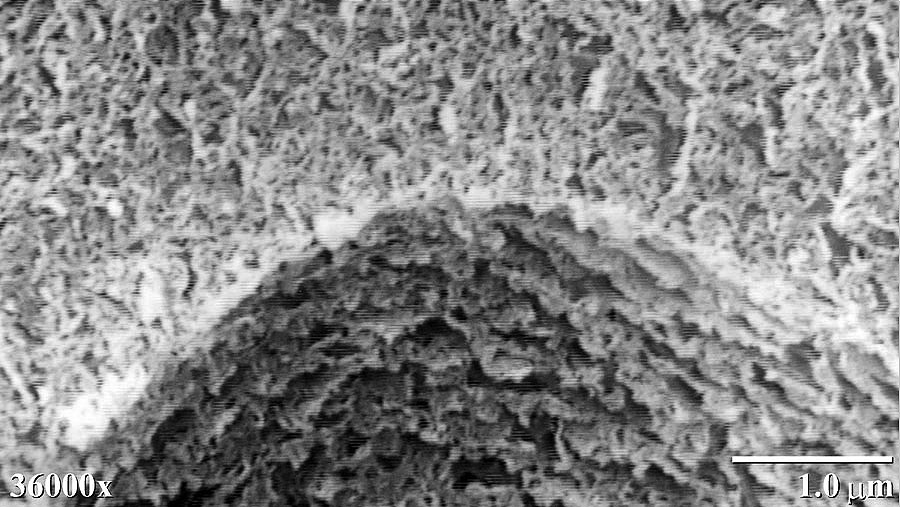
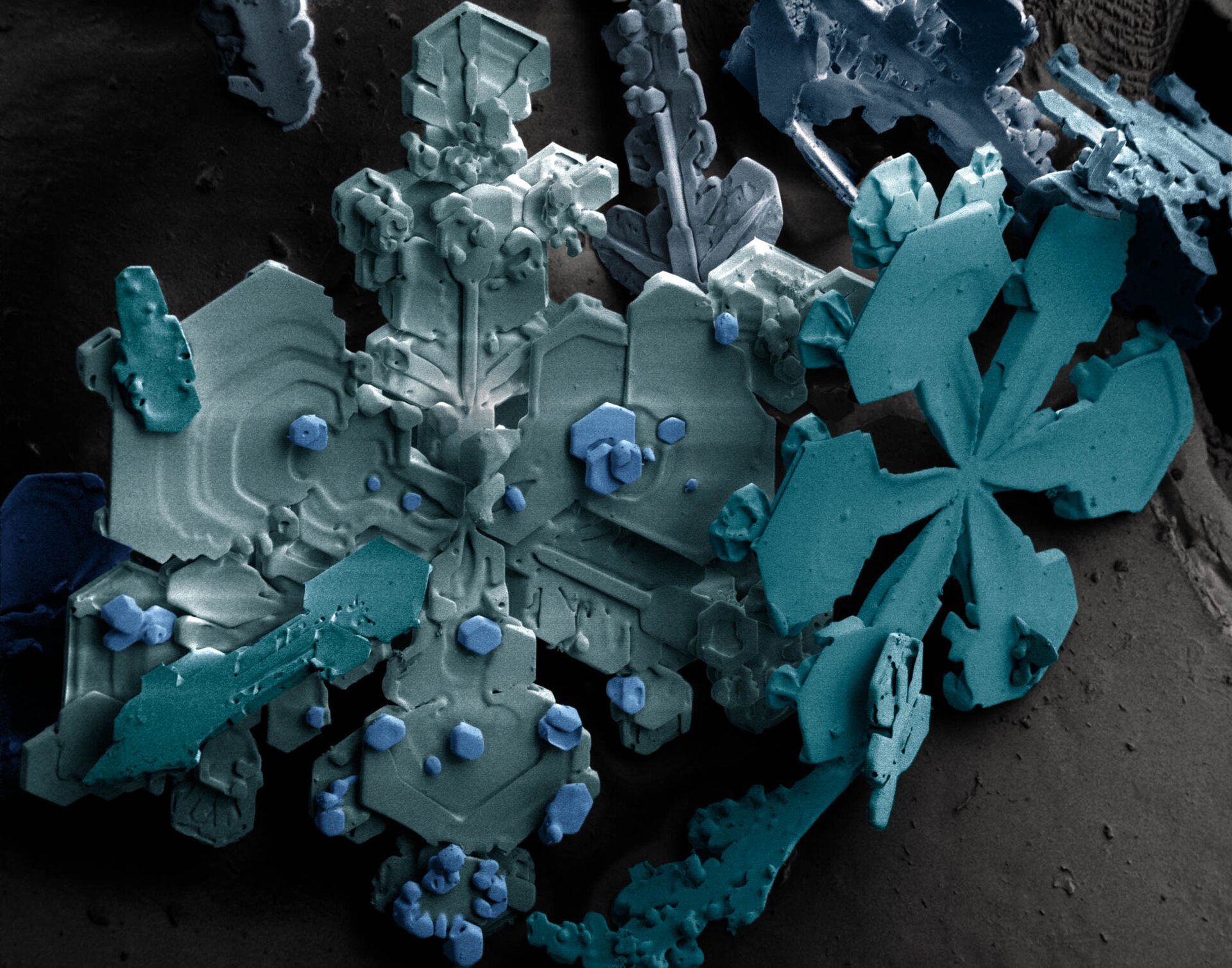
Zbliżenia kryształu śniegu widzianego pod mikroskopem SEM możesz zobaczyć poniżej.
Zbliżenia kryształu śniegu widzianego pod mikroskopem SEM. Zapoznaj się z opisem zdjęć.
Etapy procesu krystalizacji
W procesie krystalizacji możemy wyróżnić kilka etapów (faz), które prowadzą do powstania kryształu:
zarodkowanie (nukleacja)zarodkowanie (nukleacja) – wstępny etap tworzenia się nowej fazy z roztworu nasyconego. Czynnikiem rozpoczynającym proces zarodkowania może być obecność cząstek pyłów i innych substancji, bodziec mechaniczny (np. pocieranie szklanym pręcikiem ścian naczynia z roztworem) czy naświetlanie promieniowaniem jonizującym,
propagacja krystalizacji – swobodny wzrost pojedynczych kryształów na skutek ruchu pojedynczych cząstek,
powstawanie mikrostruktury krystalicznej – wzrost kryształu inicjowany przez kontakt z innymi istniejącymi kryształami,
wzrost kryształu – zlepianie się pojedynczych kryształów w większe struktury.
Poniższy schemat przedstawia opisane wyżej etapy krystalizacji.
Poniżej przedstawiono film przedstawiający tworzenie się kryształów kwasu cytrynowego.

Film dostępny pod adresem /preview/resource/RUymmWjnsxomQ
Animacja przedstawia powstawanie kryształów kwasu cytrynowego. Na początku w centrum ekranu widoczny jest kryształ kwasu cytrynowego, który w jednej z płaszczyzn przyjmuje czworościanu. Wraz z upływem czasu kryształ powiększa swoją wielkość, zachowując przy tym swój kształt w tej samej płaszczyźnie. W płaszczyźnie prostopadłej również widoczny jest przyrost masy kryształu. Ostatecznie kryształ kwasu cytrynowego przyjmuje strukturę trójwymiarową.
Metody krystalizacji
Powolne ochładzanie
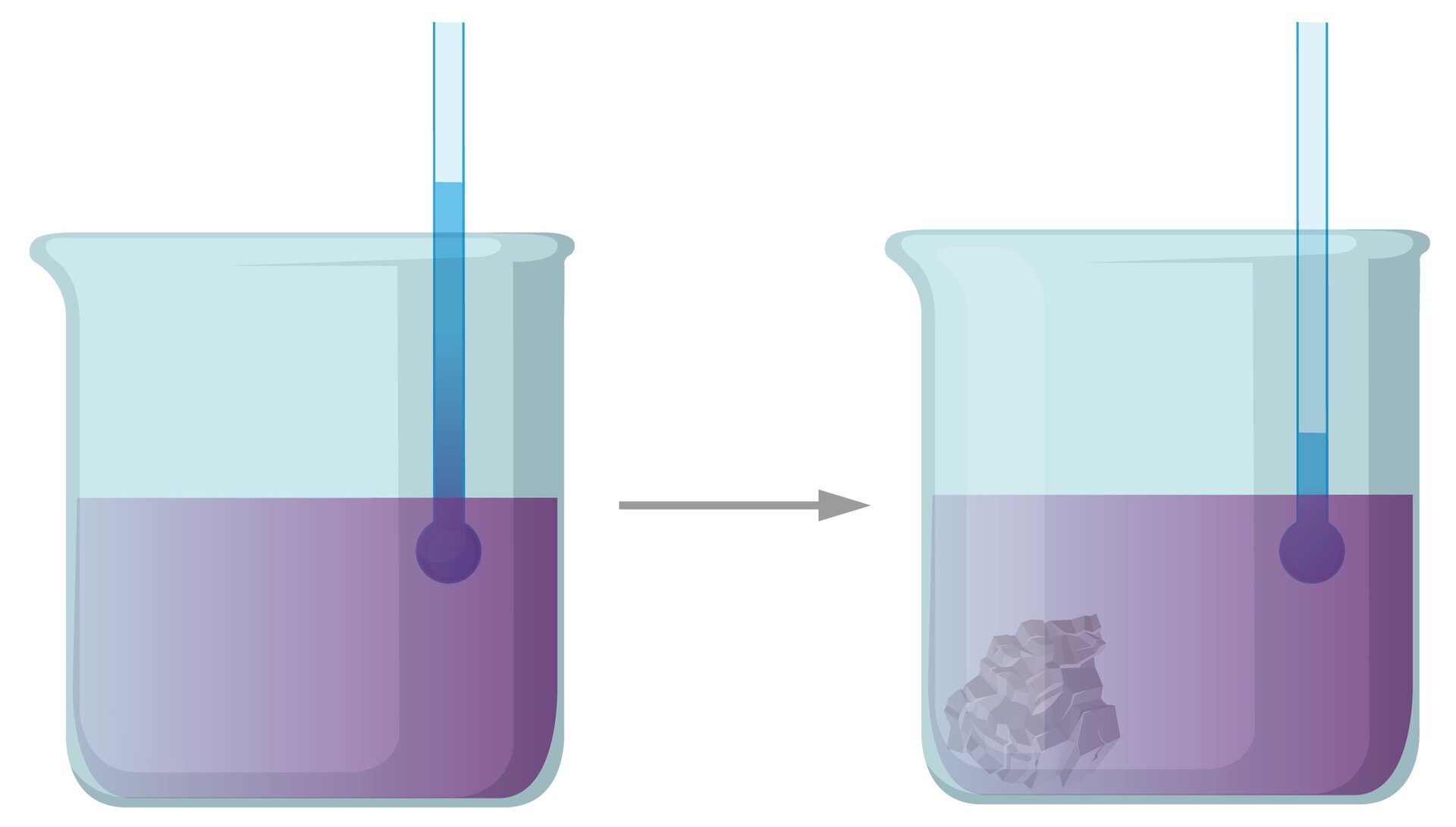
Technika laboratoryjna tworzenia kryształów, polegająca na rozpuszczeniu ciała stałego w wysokiej temperaturze do uzyskania roztworu nasyconego. Mieszanina jest następnie filtrowana w celu usunięcia wszelkich nierozpuszczalnych zanieczyszczeń. Powstały przesącz pozostawia się do powolnego ochłodzenia. Proces jest następnie powtarzany w celu zwiększenia czystości, w technice znanej jako rekrystalizacjarekrystalizacja.
Powolne odparowywanie rozpuszczalnika
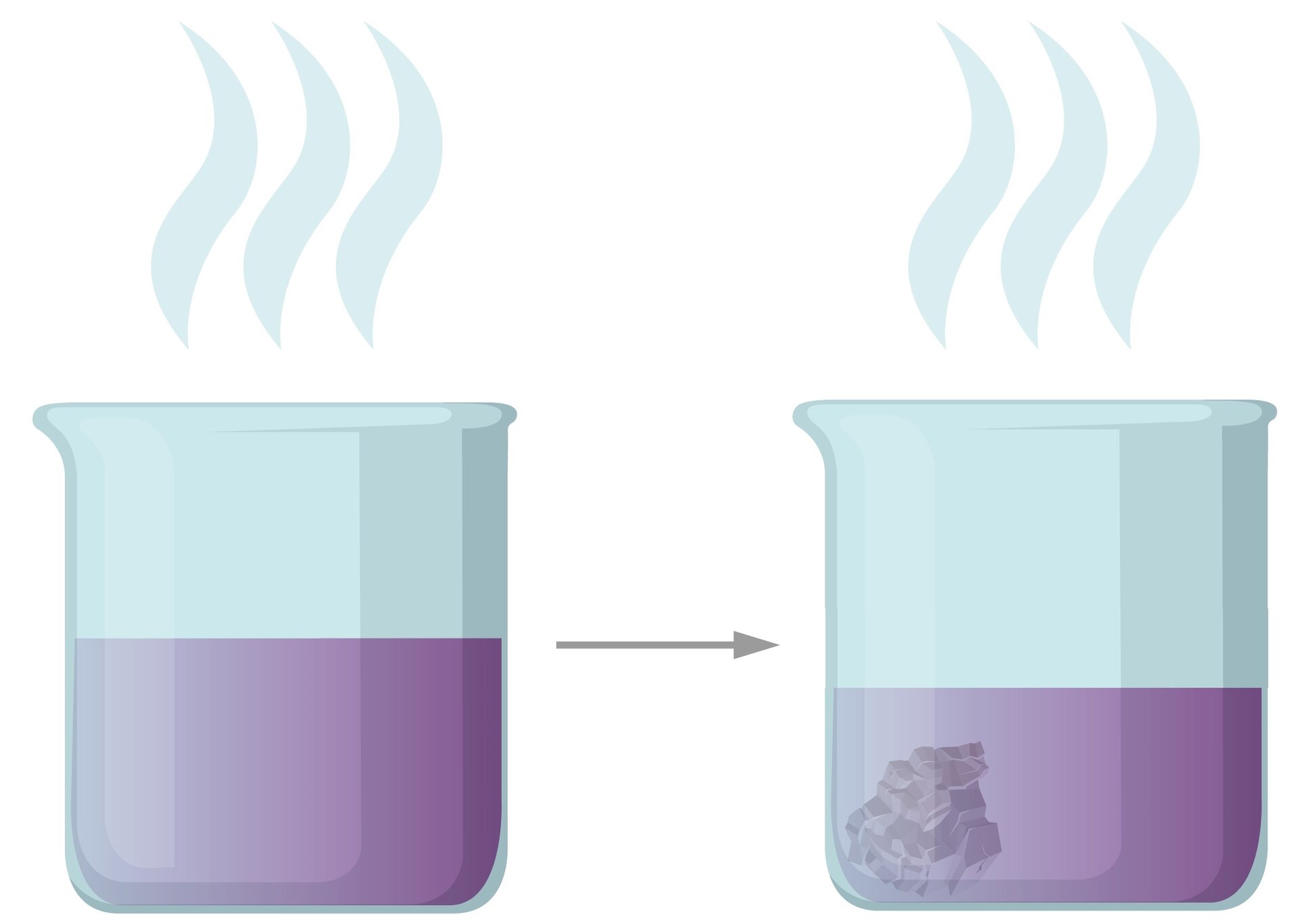
Najprostsza metoda hodowli kryształów z roztworu. W tej technice związek rozpuszcza się w niewielkiej ilości rozpuszczalnika aż do uzyskania prawie nasyconego roztworu. Następnie układ pozostawia się w otwartym naczyniu, aby rozpuszczalnik odparował w ciągu następnych dni. Jeżeli nie mamy do czynienia ze szczególnie wrażliwymi substancjami wystarczy niezbyt szczelne zamknięcie naczynia z roztworem.
Dodawanie drugiego rozpuszczalnika w celu zmniejszenia rozpuszczalności substancji rozpuszczonej
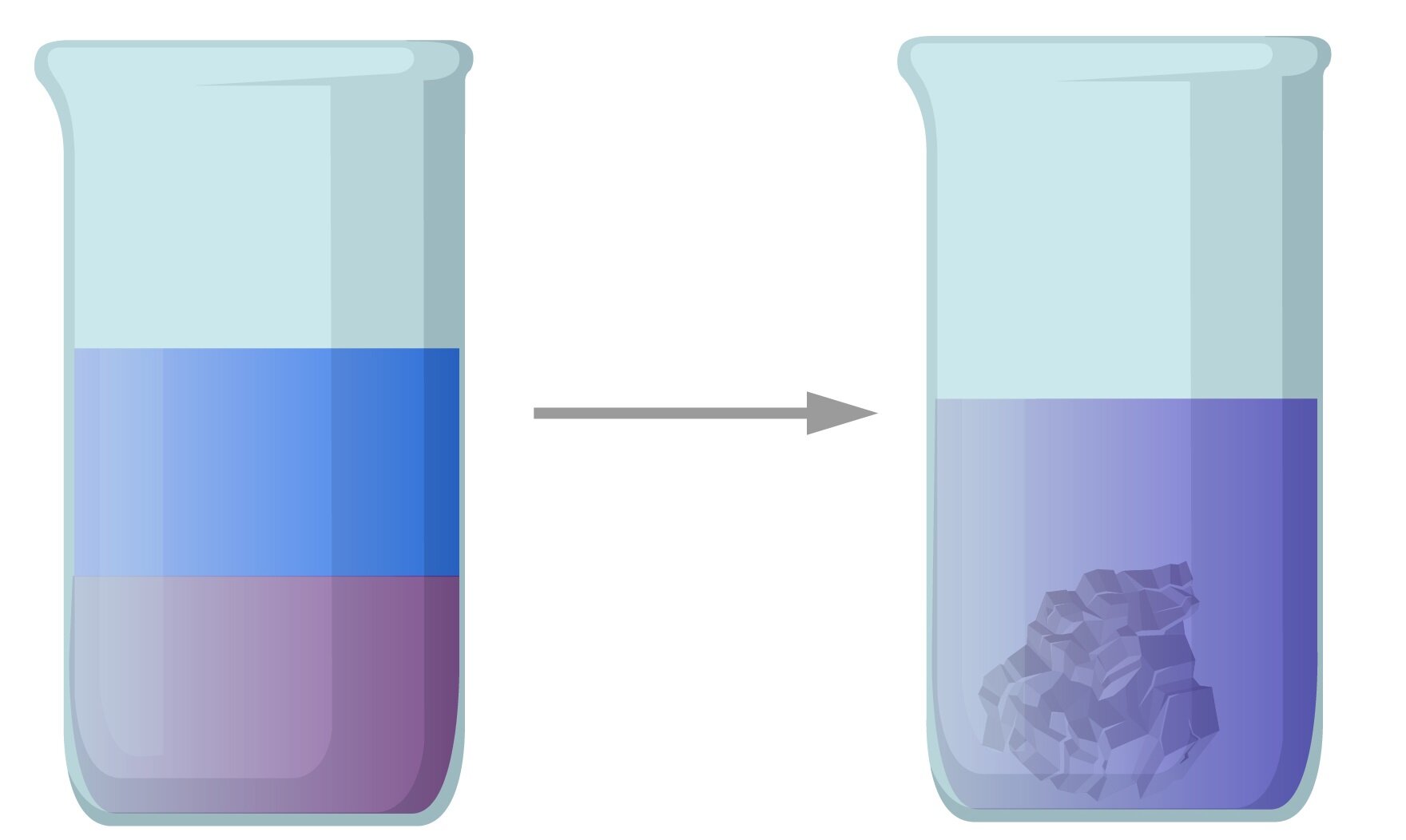
Podstawą tej metody jest różnica rozpuszczalności substancji w dwóch rozpuszczalnikach. Substancję rozpuszcza się w jednym z nich, a następnie dodaje się rozpuszczalnik o mniejszej gęstości, w którym ta substancja się nie rozpuszcza. Na skutek różnicy gęstości tworzą się dwie warstwy. Wraz z upływem czasu rozpuszczalniki mieszają się na zasadzie dyfuzjidyfuzji, co powoduje wytrącenie kryształów.
Dyfuzja par rozpuszczalników
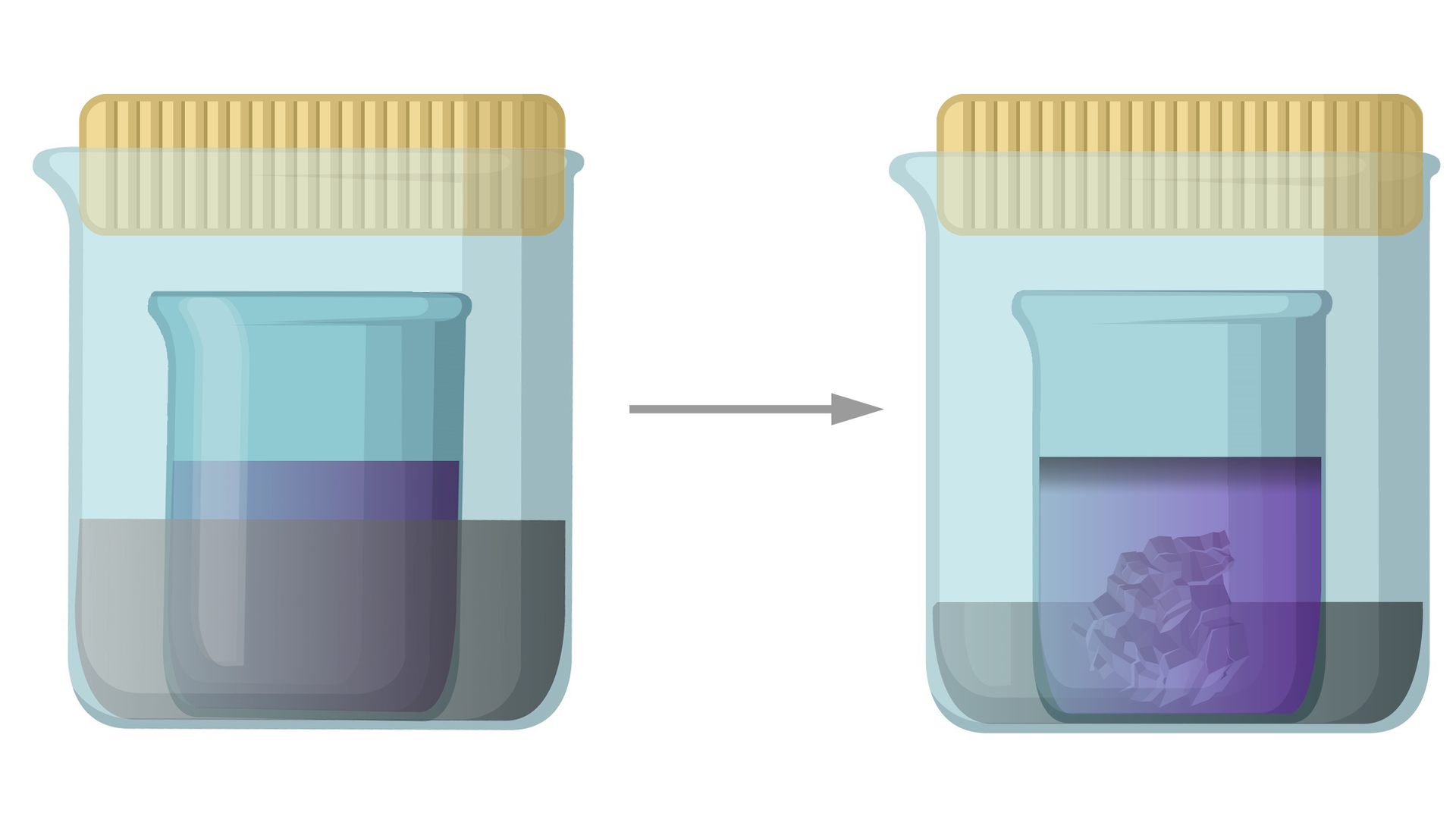
W tej metodzie wykorzystuje się różnicę lotności rozpuszczalników. Zlewkę z roztworem krystalizowanej substancji w mniej lotnym rozpuszczalniku, w którym jest ona dobrze rozpuszczalna, umieszcza się w szczelnie zamkniętym naczyniu wypełnionym rozpuszczalnikiem bardziej lotnym. Pary rozpuszczalnika zewnętrznego, w którym krystalizowana substancja jest słabo rozpuszczalna, przemieszczają się wewnątrz układu na zasadzie dyfuzji. Wówczas następuje zmiana rozpuszczalności, dzięki czemu możliwe jest formowanie się kryształów.
Krystalizacja jako metoda oczyszczania związków
Krystalizacja to podstawowa metoda, którą stosuje się do oczyszczania i rozdzielania substancji stałych.
Wykorzystuje się w niej różnicę rozpuszczalności substancji i zanieczyszczeń w rozpuszczalniku. W praktyce substancję rozpuszcza się w określonym rozpuszczalniku do osiągnięcia jego temperatury wrzenia. Zanieczyszczenia barwne można usuwać poprzez dodatek węgla aktywnego, który po zaadsorbowaniu zanieczyszczeń usuwa się na gorąco poprzez sączenie. Czystość substancji określa się na podstawie wartości temperatury topnienia, którą można zmierzyć za pomocą odpowiedniej aparatury. Mały przedział temperatur topnienia jest charakterystyczny dla substancji czystych. Obecność zanieczyszczeń prowadzi do obniżenia temperatury topnienia, czyli jej depresji.
Cechy rozpuszczalnika w procesie krystalizacji:
powinien wykazywać dużą zdolność rozpuszczania krystalizowanej substancji na gorąco i stosunkowo słabą w temperaturze pokojowej;
nie powinien reagować z substancją rozpuszczaną;
nie powinien być łatwopalny, toksyczny, drogi, powinien być łatwy do usunięcia z powierzchni kryształów (mieć stosunkowo niską temperaturę wrzenia).
Przykłady wykorzystywania procesu krystalizacji przez człowieka
Wstępna krystalizacja masła kakaowego
Choć może wydawać się, że obróbka wyrobów czekoladowych polega jedynie na stapianiu kawałków czekolady i ich ponownym zastyganiu, to jest to bardzo złożony proces. Jednym z ważniejszych etapów produkcji wyrobów czekoladowych jest wstępna krystalizacja zawartego w czekoladzie masła kakaowego. Polega ona na podgrzaniu czekolady do – temperatury gwarantującej rozpuszczenie wszystkich występujących w jej składzie form kryształów tłuszczu. Dzięki temu uzyskujemy homogeniczną strukturę rozpuszczonej czekolady. Następnie jest ona schładzana w kontrolowanych warunkach temperaturowych do . Później w celu wytworzenia jak największej ilości zalążków krystalizacji miesza się ją i podgrzewa do odpowiedniej dla rodzaju czekolady (mlecznej, białej lub deserowej) temperatury w celu usunięcia niepożądanych form kryształów.
Etap ten zapewnia jej piękny, satynowy połysk oraz odpowiednią łamliwość i stabilną krystaliczną strukturę. Jeżeli na sklepowej półce zauważymy czekoladę z szarym nalotem (tzw. wykwity dojrzewającego tłuszczu), oznacza to, że niewłaściwie przeprowadzono proces krystalizacji lub nie przeprowadzono go wcale. Idealnie przygotowana czekolada powinna również rozpuszczać się temperaturze około , czyli w ustach, a nie w dłoni.
Oczyszczanie farmaceutyków poprzez krystalizację
W przemyśle farmaceutycznym krystalizacja wykorzystywana jest do oczyszczania farmaceutyków. Pierwszym krokiem jest uzyskanie nasyconego roztworu oczyszczanej substancji w temperaturze wrzenia rozpuszczalnika. Z tak przygotowanego roztworu poprzez sączenie oddziela się nierozpuszczalne zanieczyszczenia. Następnie obniża się temperaturę uzyskanego przesączu. Jego ochłodzenie powoduje powstanie przesyconego roztworu, a nadmiar pożądanego związku chemicznego zostaje wydzielony w formie krystalicznej. Powstały osad odsącza się.
Dobrze dobrany rozpuszczalnik powinien wcale nie rozpuszczać zanieczyszczeń lub rozpuszczać je znacznie lepiej niż pożądaną substancję. W pierwszym przypadku proces oczyszczania wykonywany jest zgodnie z powyższym opisem. Natomiast w drugim przypadku po otrzymaniu nasyconego roztworu i sączeniu, przesącz zostaje odrzuconym, ponieważ to w nim znajdują się zanieczyszczenia.
Słownik
(łac. crystallus „kryształ”, z grec. krystallos „kryształ”) proces powstawania kryształów danej substancji z przesyconego roztworu lub przechłodzonego stopu; także: skupisko kryształów powstałe w wyniku tego procesu
powtórna krystalizacja przeprowadzana w celu dalszego oczyszczenia substancji
samorzutne przenikanie cząsteczek jednej substancji do drugiej, prowadzące do wyrównania stężenia
przemiana fazowa I rodzaju (przemiana fazowa) polegająca na przejściu substancji ze stanu ciekłego w krystaliczny stan stały
wstępny etap procesu tworzenia się nowej fazy
Bibliografia
Encyklopedia PWN
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1, Warszawa 2013.
Vogel A. I., Preparatyka organiczna, Warszawa 2006, wyd. 3 zmienione.