Przeczytaj
Prawo Hessa
Prawo Hessa to podstawowe prawo termochemii, wg którego ciepło reakcji chemicznej, przebiegającej w warunkach izochorycznych lub izobarycznych, gdy układ wykonuje tylko pracę objętościową, nie zależy od stanów pośrednich, tj. od drogi reakcji, a tylko od początkowego i końcowego stanu układu i jest równe sumie algebraicznej efektów cieplnych poszczególnych etapów reakcji.
Prawo Hessa pozwala zatem obliczać ciepło reakcji chemicznej, którego nie można zmierzyć bezpośrednio, gdy są znane takie wartości – jak entalpia tworzenia lub spalania poszczególnych reagentów – odnoszące się do stanu standardowego – temperatury , ciśnienia .
Energia wiązań a entalpia reakcji
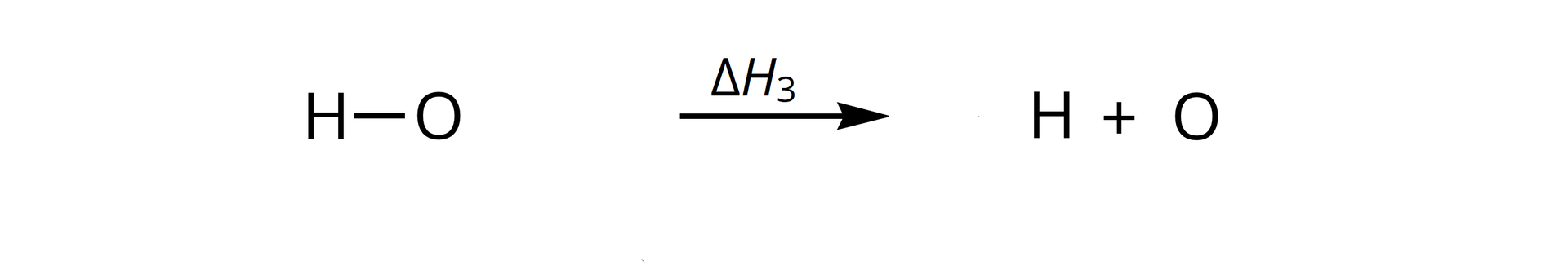
Energia wiązań to średnia energia potrzebna do zerwania wiązania i przekształcenia cząsteczki gazowego związku chemicznego w obojętne atomy. Energię wiązań wyznacza się w odniesieniu do mola wiązań.
Energia wiązania to taka, którą trzeba dostarczyć, aby zerwać wiązanie chemiczne, więc przyjmuje ona wartości dodatnie i wyrażana jest zazwyczaj w jednostkach .
Jednym ze sposobów na obliczenie entalpii reakcji jest wykorzystanie energii wiązań.
Chcąc rozdzielić cząsteczkę gazowego związku na atom i atom , musimy dostarczyć energii potrzebnej na rozerwanie wiązania – jest ona pochłaniana przez układ, a zmiana entalpii jest większa od zera. Wynika stąd, że jeżeli tworzymy cząsteczkę , to energia jest wydzielana (zmiana entalpii jest mniejsza od zera).
Obliczenia
Metodę tę wykorzystamy do obliczenia standardowej entalpii reakcji , zachodzącej pomiędzy wodorem a tlenem w tzw. mieszaninie piorunującej. Jej nazwa nawiązuje do posiadanych właściwości wybuchowych. Po jej zapaleniu następuje gwałtowne spalanie wodoru (wybuch), a produktem tej reakcji jest para wodna:
Entalpię można obliczyć korzystając z entalpii tworzenia lub spalania poszczególnych reagentów lub wykorzystując średnie energie poszczególnych wiązań chemicznych.
Zgodnie z prawem Hessa, które głosi, że zmiana entalpii reakcji nie zależy od drogi reakcji, lecz od stanu początkowego i stanu końcowego, energie tych dwóch sposobów otrzymywania wody są bardzo zbliżone. W takim razie jeśli będziemy znali entalpięentalpię wyliczoną na podstawie energii wiązań, to będzie ona równa entalpii reakcji wodoru z tlenem.
Poniżej podane są średnie energie wiązań, czyli porcje energii niezbędne do rozerwania mola danych wiązań, w przypadku ich występowania w cząsteczkach w gazowym stanie skupienia:
wiązanie | energia |
|---|---|
W przedstawionym poniżej schemacie powstawania wody dochodzi do rozerwania dwóch moli wiązań w cząsteczkach wodoru oraz jednego mola wiązań w cząsteczkach tlenu. W wyniku reakcji powstają cztery mole wiązań (w powstałych dwóch molach cząsteczek wody).
Zgodnie z prawem Hessa, entalpia reakcji pomiędzy wodorem a tlenem, wyliczona przy pomocy entalpii tworzenia czy entalpii spalania, powinna mieć zbliżoną wartość do zmiany entalpii, wynikającej z rozerwania i powstania nowych wiązań.
Nie będzie ona taka sama, ponieważ energia danego wiązania, którą możesz znaleźć w tabelach chemicznych, to energia będąca uśrednieniem energii tego wiązania w różnych cząsteczkach chemicznych – a więc w zależności od otoczenia, energie wiązań między tymi samymi atomami będą się nieco różnić.
Przykładowo wiązanie , występujące w cząsteczce wody, będzie miało tak naprawdę nieznacznie inną energię od wiązania w cząsteczce metanolu.
Pomimo tego zastrzeżenia, otrzymana wartość entalpii reakcji obliczona ze średnich energii wiązań powinna być bliska wartości oczekiwanej. Wzór, który pozwala na wyznaczenie entalpii reakcji przy użyciu stabelaryzowanych energii wiązań chemicznych, wygląda dla omawianego schematu reakcji tworzenia wody następująco:
Entalpia tej reakcji, wyznaczona w oparciu o energię wiązań, jest równa .
Teraz obliczmy entalpię tej reakcji, korzystając z molowej entalpii tworzenia poszczególnych reagentów (dla cząsteczek wodoru i tlenu będzie ona równa zero, ponieważ dokładnie tyle wynosi entalpia tworzenia dla pierwiastków w stanie najtrwalszym). Dla wody molowa entalpia tworzenia w stanie gazowym wynosi .
Jak widzisz, entalpia reakcji wyliczona przy pomocy energii wiązań nieznacznie różni się od tej wyliczonej przy użyciu entalpii tworzenia. Jest to jednak różnica znikoma, wynikająca z uśrednienia energii wiązań. Można więc powiedzieć, że prawo Hessa znajduje tutaj swoje zastosowanie.
Na podstawie entalpii poniższej reakcji oraz podanych energii wiązań, wyznacz energię wiązania w cząsteczce .
wiązanie | energia |
|---|---|
Słownik
warunki, w których panuje stała objętość
warunki, w których panuje stałe ciśnienie
ciepło, które wydziela się w trakcie całkowitego spalenia mola danego związku chemicznego w czystym tlenie w warunkach standardowych (ciśnienie , temperatura )
Bibliografia
Atkins P., Paula J., Chemia fizyczna, PWN, Warszawa, 2015.
Atkins P., Podstawy chemii fizycznej, PWN, Warszawa 1999.
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Wydawnictwo Szkolne PWN, Warszawa – Bielsko‑Biała 2010.