Przeczytaj
Rozpuszczalność
RozpuszczalnośćRozpuszczalność jest cechą danej pary substancji rozpuszczanej i rozpuszczalnika w określonej temperaturze. Na ogół ilość substancji, którą można rozpuścić w danej ilości rozpuszczalnika i w określonej temperaturze, jest ograniczona i prowadzi do uzyskania tzw. roztworu nasyconegoroztworu nasyconego. Ilość substancji niezbędnej do uzyskania roztworu nasyconego określa wielkość fizyczna zwana rozpuszczalnością.
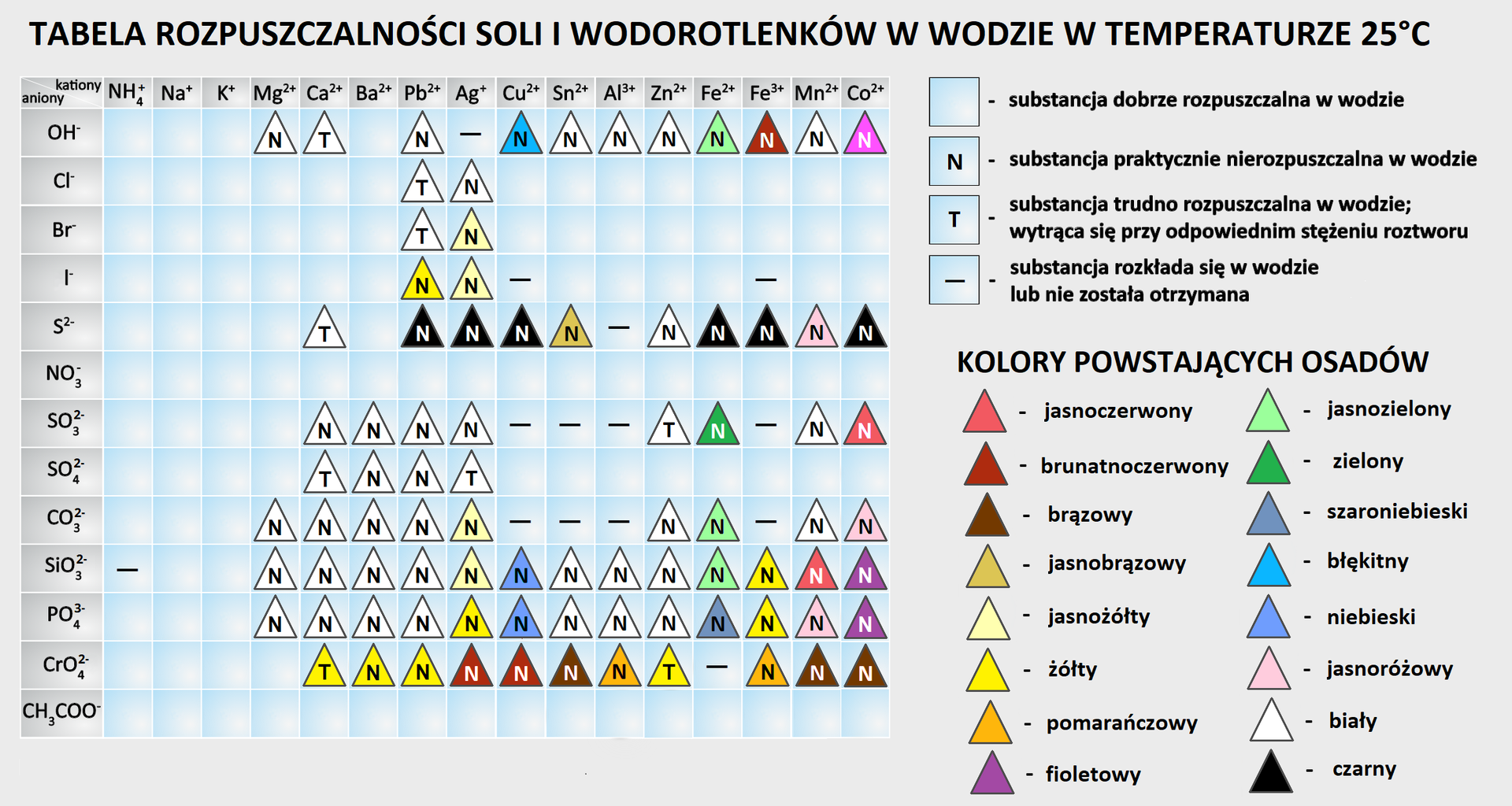
Za substancje dobrze rozpuszczalne w wodzie przyjmuje się te substancje, których rozpuszczalność wynosi ponad na rozpuszczalnika (wody). Substancje, których rozpuszczalność wynosi mniej niż w wody uznaje się za praktycznie nierozpuszczalne.
Rozpuszczalność soli zależy od:
rodzaju rozpuszczalnika,
temperatury (rozpuszczalność większości ciał stałych rośnie wraz ze wzrostem temperatury),
stanu rozdrobnienia soli,
bodźców mechanicznych, tj. mieszanie przy rozpuszczaniu.
Roztwór nasycony czy nienasycony?
Roztworem nasyconymRoztworem nasyconym nazywamy roztwór, w którym nie można już rozpuścić więcej substancji, a jej nadmiar znajduje się w stanie równowagi dynamicznej z roztworem. Analogicznie, roztworem nienasyconymroztworem nienasyconym nazywamy taki, w którym można rozpuścić dodatkową ilość danej substancji.

Krzywe rozpuszczalności
Wykres przedstawiający zależność rozpuszczalności danej substancji od temperatury nazywa się krzywą rozpuszczalności.
Wzrost rozpuszczalności soli w wodzie wraz ze wzrostem temperatury dotyczy soli dobrze rozpuszczalnych w wodzie. Wzrost ten jest różny dla różnych soli. Jedne mają duży wzrost (np. azotan() potasu), a inne mały (np. chlorek sodu).

Jednak niektóre sole o małej rozpuszczalności w wodzie wraz ze wzrostem temperatury rozpuszczają się coraz gorzej. Przykładem takiej soli jest węglan litu.

Czy wszystkie sole są rozpuszczalne w wodzie?
Pomocna w ocenie rozpuszczalnościrozpuszczalności soli w wodzie jest tabela rozpuszczalności. Znajdują się w niej informacje dotyczące tego, czy sól jest dobrzedobrze, trudnotrudno czy praktycznie nierozpuszczalnapraktycznie nierozpuszczalna w wodzie.
Na podstawie zgromadzonego sprzętu oraz materiału badawczego zaprojektuj i wykonaj doświadczenie w laboratorium chemicznym, w którym zbadasz rozpuszczalność różnych soli w wodzie oraz wpływ temperatury na ten proces. Zaproponuj problem/problemy badawcze oraz hipotezę/hipotezy. Następnie rozwiąż problem badawczy i zweryfikuj hipotezę. W formularzu zapisz swoje obserwacje i wyniki, a następnie sformułuj wnioski.
Eksperymenty wykonuj w okularach ochronnych. Przed przystąpieniem do doświadczenia zapoznaj się z kartami charakterystyk substancji wykorzystywanych w doświadczeniu.
Na podstawie zgromadzonego sprzętu oraz materiału badawczego zaprojektuj doświadczenie w laboratorium chemicznym, w którym można zbadać rozpuszczalność różnych soli w wodzie oraz wpływ temperatury na ten proces. Zaproponuj problem/problemy badawcze oraz hipotezę/hipotezy. Następnie, korzystając z tabeli rozpuszczalności, rozwiąż problem badawczy i zweryfikuj hipotezę. W formularzu zapisz swoje obserwacje i wyniki, a następnie sformułuj wnioski.
Odczynniki:
fosforan() magnezu –
fosforan() amonu –
fosforan() wapnia –
chlorek amonu –
azotan() wapnia –
azotan() potasu –
woda destylowana
Sprzęt laboratoryjny:
probówki;
statyw na probówki;
palnik;
zapałki;
łyżeczka;
łapa do probówek.
Słownik
roztwór, który w danej temperaturze zawiera maksymalną ilość substancji rozpuszczonej, a dodana do niej kolejna porcja substancji nie ulega rozpuszczeniu
roztwór, w którym można rozpuścić dodatkową ilość danej substancji
roztwór o większej zawartości substancji rozpuszczonej względem roztworu nasyconego
ilość substancji niezbędnej do uzyskania roztworu nasyconego (przy określonej ilości rozpuszczalnika), charakterystyczna dla danej substancji rozpuszczanej i rozpuszczalnika; zależy od temperatury prowadzenia procesu
jej rozpuszczalność w wodzie jest większa niż
jej rozpuszczalność w wodzie mieści się w granicach –
jej rozpuszczalność w wodzie leży powyżej
Bibliografia
Błażewicz A., Chemia analityczna: podręcznik dla studentów. 2, Analiza instrumentalna, pod red. Ryszarda Kocjana, Warszawa 2002.
Encyklopedia PWN
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia: Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.
Scherer H. W., Nawozy, w: Encyklopedia chemii przemysłowej Ullmanna, Weinheim 2000.