Przeczytaj
Istnieje wiele testów chemicznych pozwalających na wykrycie obecności białka w pożywieniu. Można je podzielić na dwa rodzaje: testy jakościowetesty jakościowe i ilościoweilościowe. Testy ilościowe określają ilość białka w badanej próbce – odpowiadają na pytanie „ile?”. Natomiast testy jakościowe określają występowanie lub brak białek w żywności. Omówimy teraz jedną z podstawowych metod wykrywania wiązań peptydowychwiązań peptydowych.
Metoda biuretowa
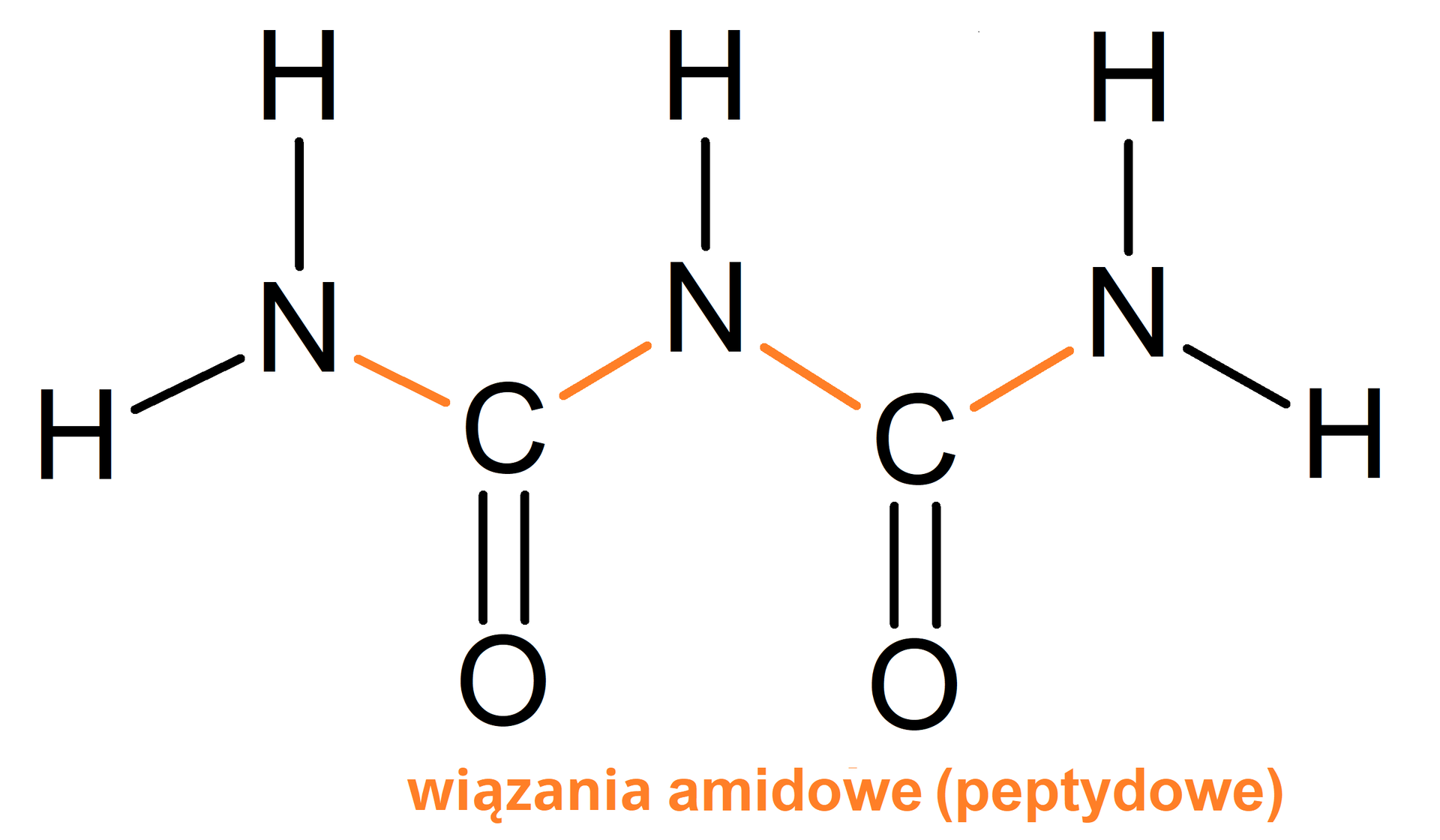
Ta metoda pozwala na wykrycie wiązania amidowego (peptydowego) w białkach. Warunkiem koniecznym do zajścia reakcji jest występowanie co najmniej dwóch wiązań peptydowych, czyli w reakcji tej nie możemy wykryć:
aminokwasów (które nie zawierają wiązania peptydowego),
dipeptydów (które zawierają jedno wiązanie peptydowe).
Metoda wzięła swoją nazwę od biuretu – dimeru mocznika, który jest najprostszym związkiem dającym pozytywny wynik.
Wiązania peptydowe reagują z jonami miedzi() w roztworze o odczynie zasadowym. W tym celu do roztworu białka można dodać siarczan() miedzi() () z wodorotlenkiem sodu () lub wodorotlenkiem potasu ().

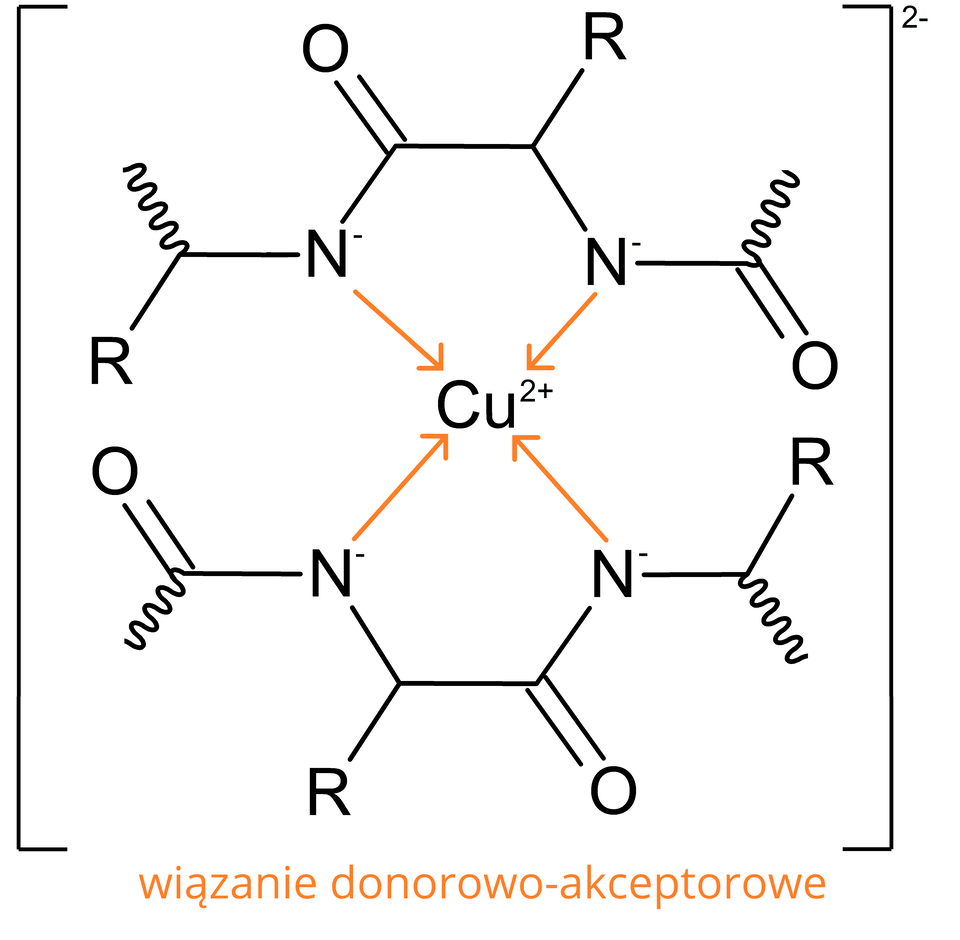
Wiązanie donorowo‑akceptoroweWiązanie donorowo‑akceptorowe to rodzaj wiązania chemicznego, w którym wiążąca para elektronowa pochodzi tylko od jednego atomu (w tym przypadku azotu ). Wyróżnia się:
donora – dawcę wolnej pary elektronowej – w tym przypadku jest to atom azotu z grupy ;
akceptora – jon metalu będący biorcą pary elektronowej – jon miedzi ().

Powstający związek kompleksowyzwiązek kompleksowy ma fioletową barwę, a jego intensywność jest wprost proporcjonalna do ilości wiązań peptydowych w badanej próbce. Jest to reakcja kolorymetryczna. To znaczy, że jeżeli w roztworze obecne są związki zawierające bliskie wiązania amidowe (peptydowe), to roztwór zmienia barwę z niebieskiej na fioletową. Jest to spowodowane powstawaniem anionowych związków kompleksowych, w których jon jest kompleksowany przez minimum dwie grupy peptydowe. W przypadku występowania dimerów aminokwasów, w których jest tylko jedno wiązanie peptydowe, układ zabarwia się na różowo. Wolne aminokwasy nie zmieniają barwy roztworu. Test może być stosowany zarówno w analizie jakościowej, jak i ilościowej. W tym drugim przypadku wykorzystuje się liniową zależność zmiany barwy od stężenia protein, a w rzeczywistości od liczby podwójnych wiązań peptydowych. W oznaczeniu przeszkadzają: sole amonowe (dają barwne kompleksy z jonami miedzi) oraz siarczan() magnezu (przechodzi w nierozpuszczalny wodorotlenek magnezu, który maskuje właściwą barwę).

W ten sposób można obliczyć stężenie białka w badanym roztworze. Zmianę zabarwienia określa się za pomocą spektrofotometru, który mierzy ilość światła pobieranego przez próbkę. Na ilustracji po lewej stronie jest przedstawiony spektrofotometr do pomiaru barwy.
Reakcję biuretową opisał w roku Gustaw Piotrowski, polski fizjolog i rektor Uniwersytetu Jagiellońskiego w Krakowie. Od jego nazwiska nazywana była odczynem Piotrowskiego.
Reakcja biuretowa jest powszechnie wykorzystywana w laboratoriach diagnostycznych. Za jej pomocą określa się obecność białek w płynach ustrojowych, np. krwi. Ponadto można również zbadać występowanie protein w moczu, dzięki czemu można się dowiedzieć o nieprawidłowym działaniu nerek.
Istnieją różne metody, które umożliwiają wykrycie konkretnych aminokwasów w danej próbce. Przykładowo: te, które w swojej budowie posiadają siarkę – dają pozytywny wynik reakcji cystynowej. Nie są to jednak reakcje charakterystyczne jedynie dla białek. Liczne testy chemiczne wykonywane w laboratoriach określają rodzaj oraz ilość białek w pożywieniu. Wykorzystuje się je przy produkcji żywności. Takie informacje między innymi ułatwiają planowanie zróżnicowanych posiłków.
Słownik
metody badawcze, które nie określają parametrów liczbowych, tylko sposób zachodzenia zjawisk, ich przyczyny lub skutki
metody badawcze określające parametry liczbowe badanych zjawisk
związek chemiczny, który składa się z atomu lub jonu centralnego oraz otaczających go ligandów, związanych ze sobą za pomocą wiązania koordynacyjnego
cykliczny węglowodór aromatyczny
wiązania występujące pomiędzy grupą aminową a grupą karbonylową w białkach
wiązanie chemiczne, w którym wolna para elektronowa pochodzi tylko od jednego atomu. Wyróżnia się dawcę pary elektronowej i jej biorcę
Bibliografia
Doonan S., Zawadzki Z., Białka i peptydy, Warszawa 2008.
Kłyszejko–Stefanowicz L., Ćwiczenia z biochemii, 2003.
Stryer L., Berg J. M., Tymoczko J. L., Molekularny wzór życia. Część 1. Biochemia, Warszawa 2009, wyd. 4.