Przeczytaj
Podstawniki aktywujące
Benzen jest związkiem, który należy do grupy związków aromatycznychzwiązków aromatycznych i stanowi zagrożenie dla naszego zdrowia i życia. Jego toksyczność wynika w dużej mierze z budowy cząsteczki. Benzen to związek niepolarny, płaski, co pozwala mu oddziaływać z cząsteczkami lipidów, a także z łatwością wnikać do komórek w organizmie. Kumuluje się bowiem w tkance tłuszczowej. Dodatkowo benzen ulega przemianom chemicznym w organizmie ludzkim, które mogą powodować uszkodzenie kwasu nukleinowego i prowadzić do choroby nowotworowej. Jest wchłaniany głównie przez układ oddechowy.
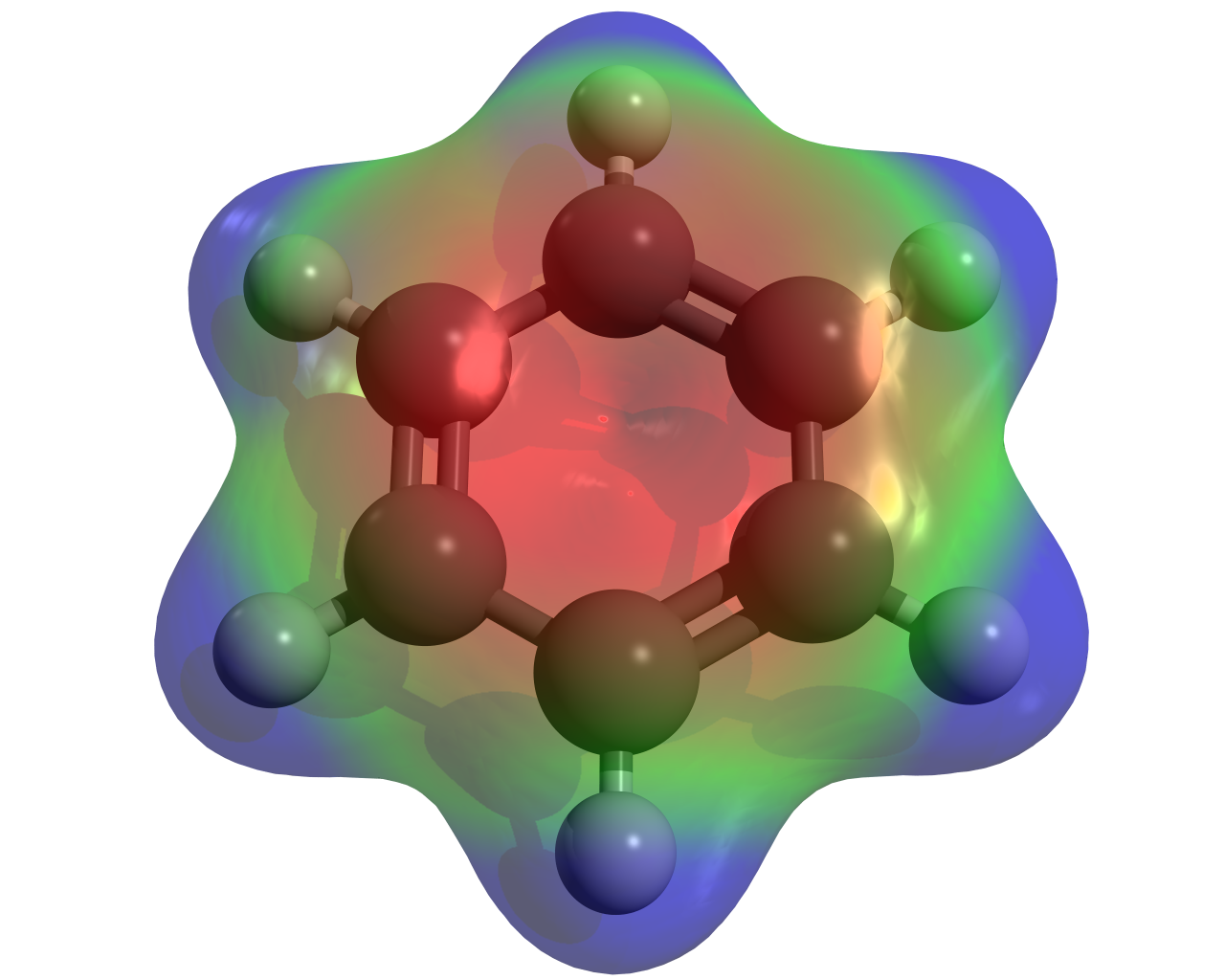
Jedną z charakterystycznych właściwości benzenu, jak i jego pochodnych, jest uleganie reakcji substytucjisubstytucji elektrofilowej.
Reakcja substytucji elektrofilowej polega na przyłączeniu się określonej grupy funkcyjnejgrupy funkcyjnej i odłączeniu atomu wodoru z pierścienia aromatycznego.
Ważnym czynnikiem w reakcji substytucji elektrofilowej jest występowanie podstawników w pierścieniu aromatycznym. Niektóre z podstawników zwiększają reaktywność pierścienia, a niektóre go zmniejszają.
Rozważmy następującą reakcję nitryfikacji:

Metylobenzen (toluen) powstaje poprzez podstawienie jednego atomu wodoru w pierścieniu benzenu grupą metylową ().
W wyniku reakcji metylobenzenu powstają głównie dwa produkty organiczne:
-metylo--nitrobenzen oraz -metylo--nitrobenzen. Trzeci produkt, jakim jest
-metylo--nitrobenzen, powstaje w ilościach śladowych. Na podstawie tej reakcji możemy wysnuć wniosek, że grupa metylowa w pierścieniu aromatycznym kieruje podstawnik nitrowy w pozycję oraz w pierścieniu aromatycznym. Podstawniki o numerze i możemy nazwać również podstawnikami orto i para.
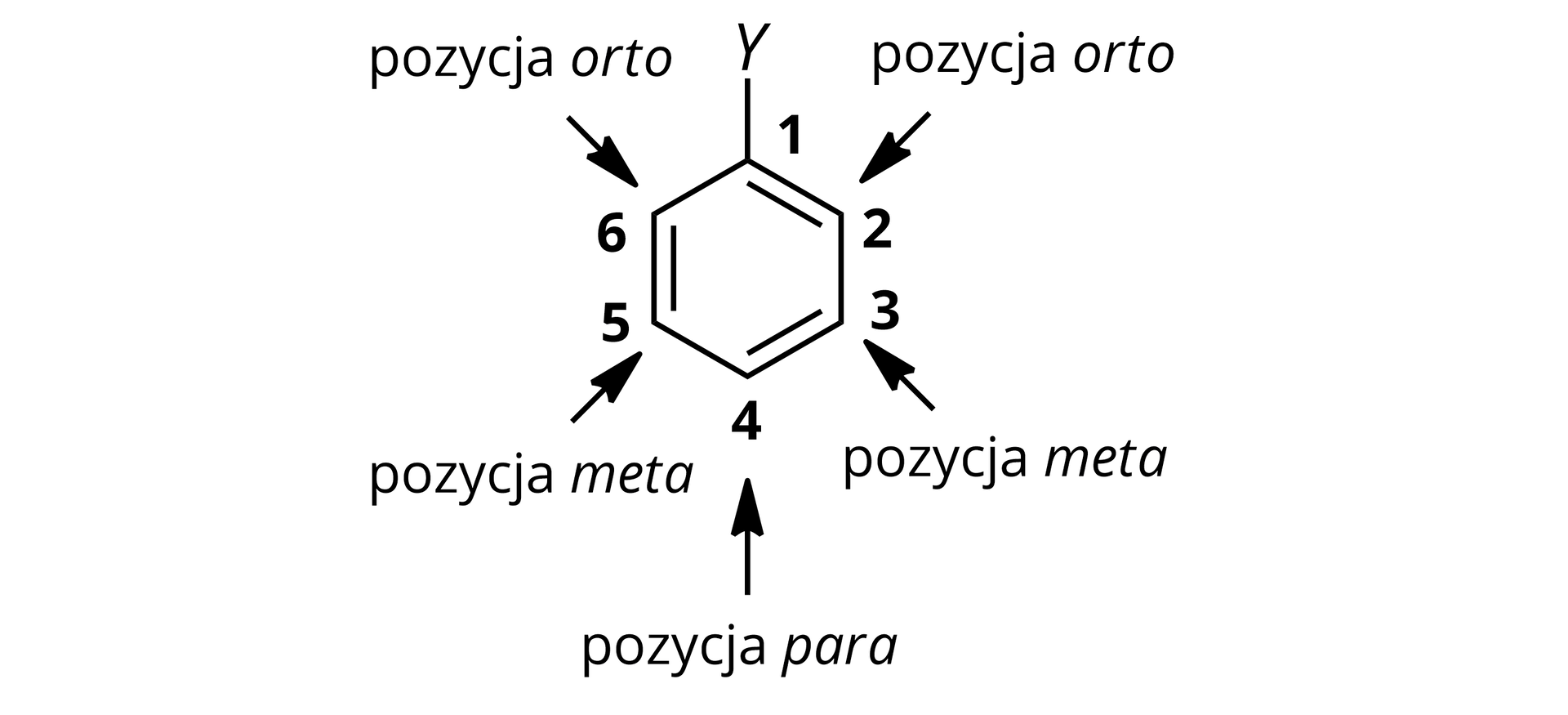
Atomy węgla oznaczone numerami i są względem siebie swoim odbiciami lustrzanymi. Oba podstawniki znajdują się w pozycji orto względem podstawnika . Jednak przy nazywaniu otrzymanego związku o poprawnej numeracji lokantów, trzeba pamiętać o tym, że powinny mieć one jak najmniejszy numer.
Nie wszystkie, np. halogeny kierują w orto i para, ale powodują słabą dezaktywizację. Trzeba to jakoś inaczej sformułować (aktywizujące kierują w orto para, a nie odwrotnie).
Podstawniki przyłączone do pierścienia aromatycznego mają wpływ na jego reaktywność.
Podstawnikami aktywującymi nazywamy podstawniki kierujące w położenie orto i para. Podstawniki takie aktywują pierścień, przez co staje się on bardziej reaktywny niż benzen.
Podstawniki decydują również o położeniu kolejnego podstawnika w pierścieniu, a zatem mają wpływ na kierunek reakcji. Reaktywność i położenie są związane z dwoma efektami: efektem indukcyjnym i efektem rezonansowym.
Ten pierwszy – efekt indukcyjny – powstaje, kiedy w grupach funkcyjnych cząsteczki znajdują się wiązania spolaryzowane. Powodują one oddawanie lub przyciąganie elektronów w relacji z pierścieniem aromatycznym.
Efekt rezonansowy opiera się na nakładaniu orbitalami p pierścienia aromatycznego z orbitalem podstawnika. Efekt jest taki sam, a nakładanie powoduje wyciąganie elektronów z pierścienia lub ich dostarczanie do pierścienia aromatycznego.
Niektóre podstawniki orto i para mogą mieć funkcję dezaktywującą pierścień.
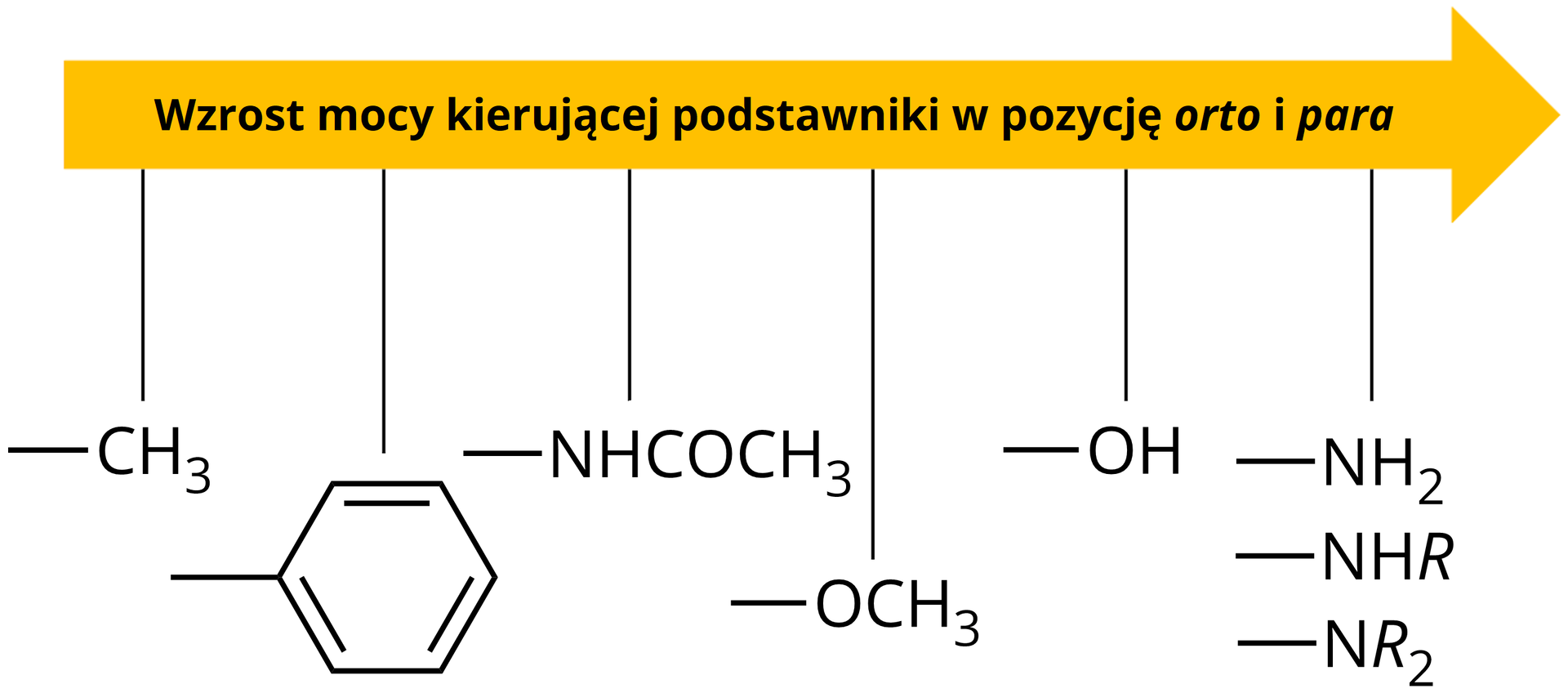
Jak możesz zauważyć, podstawnik metylowy (jak i inne podstawniki alkilowe) jest podstawnikiem słabo aktywującym pierścień aromatyczny w substytucji elektrofilowej. Z tego powodu, w przypadku reakcji nitrowania toluenu w mieszaninie poreakcyjnej, obserwujemy około -metylo--nitrobenzenu.
Zapisz równanie reakcji nitrowania metoksybenzenu.
Podpowiedź, jak krok po kroku zapisać to równanie reakcji, znajdziesz w harmonii poniżej.
Podsumowując, podstawniki aktywujące kierują przebieg reakcji w kierunku powstawania izomerówizomerów orto i para.
Słownik
(łac. substitutio „podstawianie”) reakcja podstawiania, podstawienie, reakcja chemiczna, w której atom lub grupa atomów w cząsteczce związku organicznego zostaje podstawiona innym atomem lub grupą atomów
cykliczne węglowodory (areny) i niektóre ich pochodne, mające płaskie pierścienie z układem sprzężonych wiązań podwójnych, w których występuje elektronów ( ...)
ugrupowanie kilku atomów (lub pojedynczy atom) charakterystyczne dla danej grupy związków organicznych, np. grupa karboksylowa dla kwasów karboksylowych, grupa nitrowa dla związków nitrowych
(gr. isos „równy”, meros „część”) związki chemiczne o cząsteczkach nieróżniących się od siebie ani masą, ani liczbą atomów, ani też ich rodzajem, a różniące się sposobem lub kolejnością powiązania tych atomów lub też rozmieszczeniem ich w przestrzeni
Bibliografia
Encyklopedia PWN
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
McMurry J., Chemia organiczna, cz. 3, Warszawa 2007.
Morrison R. T., Boyd R. N., Chemia organiczna, t. 1, Warszawa 2010, wyd 5.