Przeczytaj
Glukoza i fruktoza należą do węglowodanówwęglowodanów. Nazwa węglowodany powstała w czasach, gdy uważano, że są to wodziany węgla.
Heksozy
Cukry proste to takie, które nie ulegają hydroliziehydrolizie. Jeden ze sposobów klasyfikacji uwzględnia liczbę atomów węgla, budujących cząsteczkę danego cukru prostego. Cząsteczki heksozheksoz posiadają w swojej budowie sześć atomów węgla. Ich przykładem są glukoza i fruktoza.
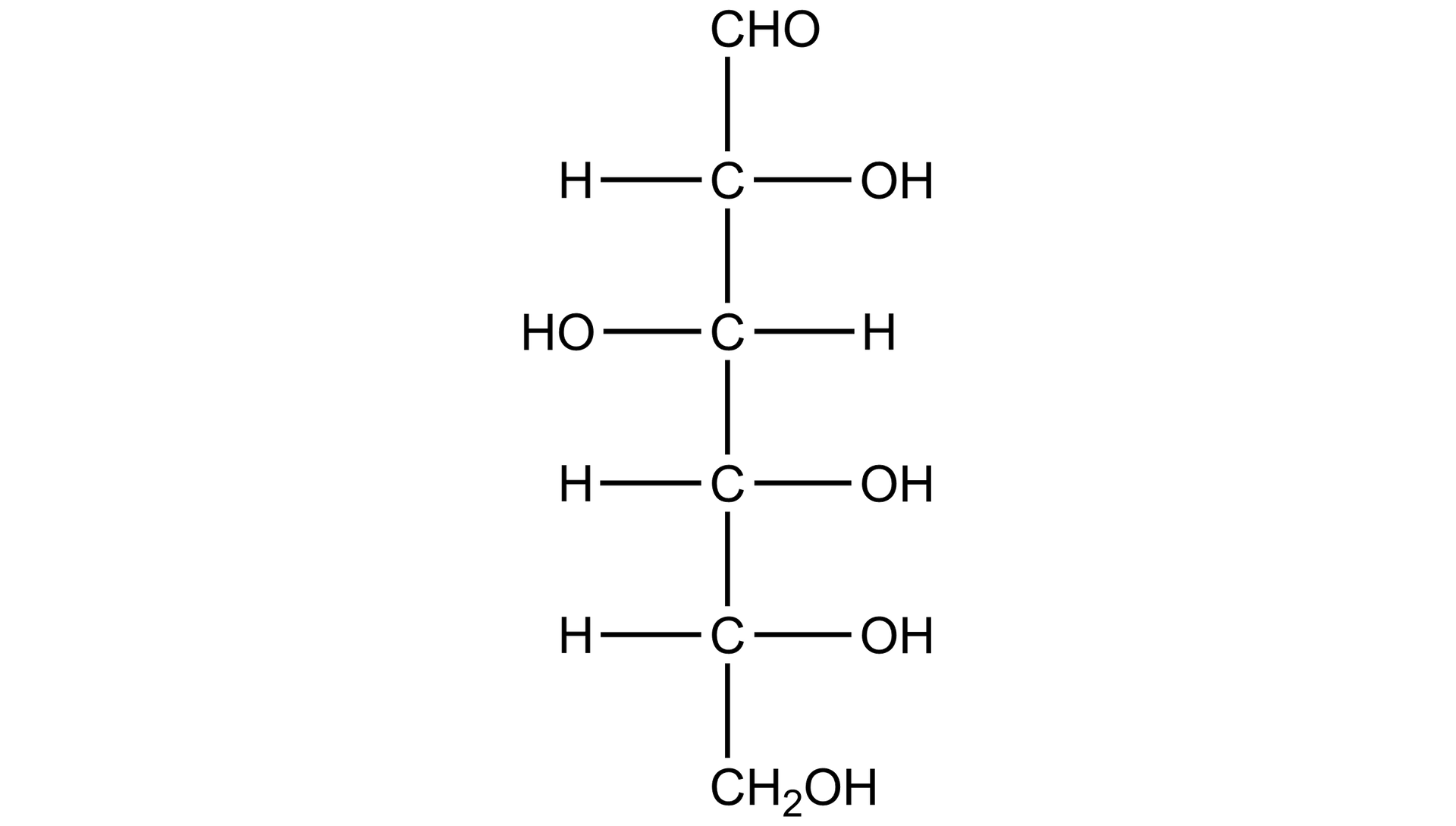
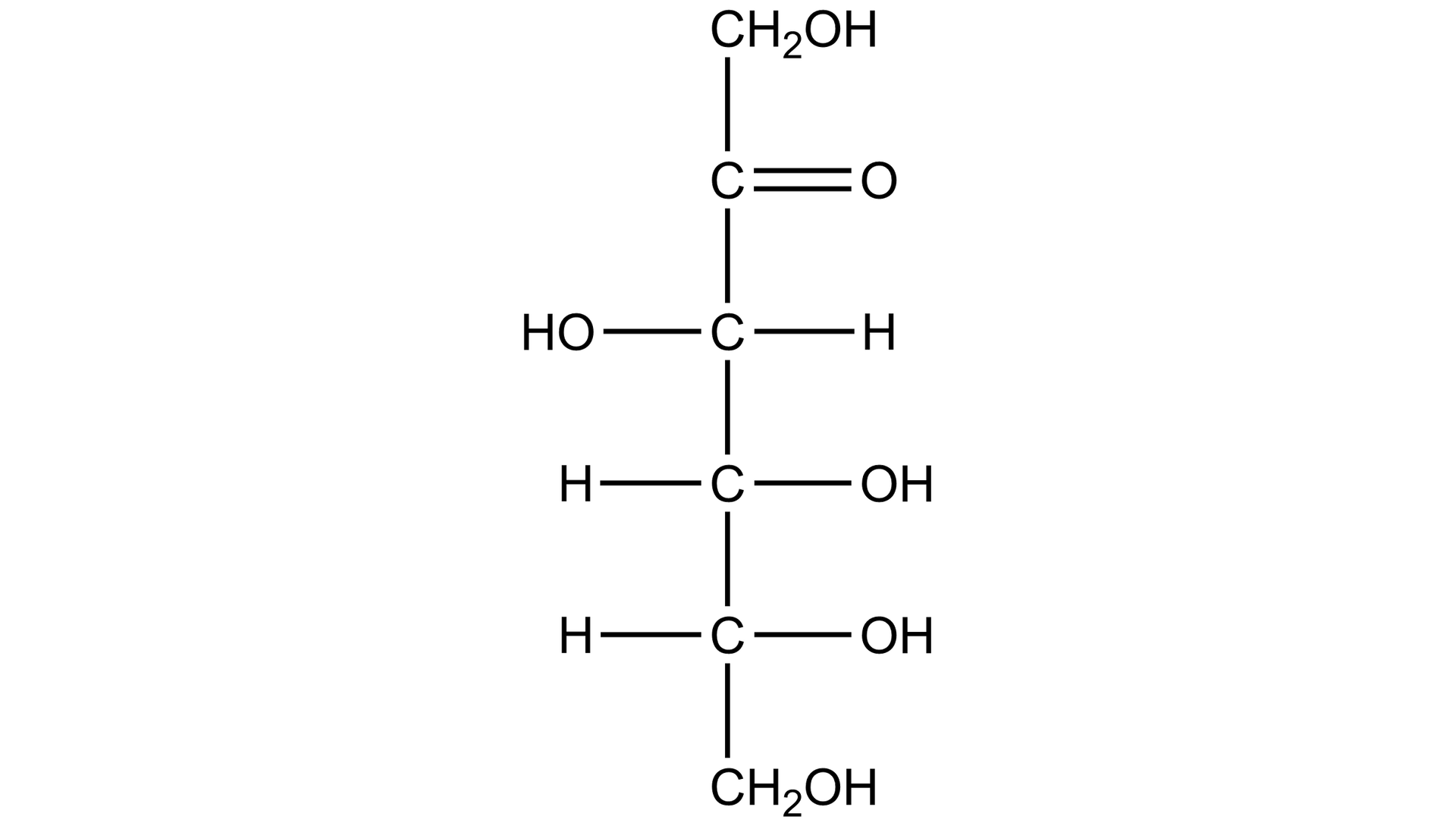
Przeanalizuj zaprezentowane powyżej wzory D‑glukozy i D‑fruktozy w projekcji Fischera. Wskaż podobieństwa i różnice w budowie tych związków.
Na podstawie opisanych powyżej wzorów D‑glukozy i D‑fruktozy w projekcji Fischera wskaż podobieństwa i różnice w budowie tych związków.
Podobieństwa i różnice
Nazwa zwyczajowa | Glukoza | Fruktoza |
|---|---|---|
Wzór sumaryczny | ||
Masa molowa [] | 180,16 | 180,16 |
Źródło cukru | powstaje w wyniku fotosyntezy, występuje w owocach | powstaje w wyniku fotosyntezy, występuje w owocach |
Znaczenie biologiczne | źródło energii | źródło energii |
Rodzaj grupy funkcyjnej | aldehydowa | ketonowa |
Gęstość [] | 1,56 | 1,69 |
Temperatura topnienia | 146°C | 103°C |
Budowa cząsteczek
Cząsteczki sacharydów, będących ciałami stałymi w temperaturze pokojowej, ulegają cyklizacji, a forma łańcuchowa, która występuje w roztworze, ulega zamknięciu.

W wyniku zamknięcia łańcucha, mogą powstać dwie odmiany cukru: alfa‑D-glukopiranoza oraz beta‑D-glukopiranoza. Różnią się położeniem grupy hydroksylowej względem wolnej pary elektronowej atomu tlenu pierścienia. Litera D przy nazwie cukru oznacza, że grupa hydroksylowa przy piątym atomie węgla we wzorze Fishera znajduje się po prawej stronie.

Przedstawione powyżej wzory alfa‑D-glukopiranozy i alfa‑D-glukopiranozy są względem siebie epimeramiepimerami. Epimery są to diastereoizomerydiastereoizomery, które różnią się tylko jednym asymetrycznym atomem węgla.
Tautomeria keto‑enolowa
W środowisku zasadowym fruktoza, podobnie jak glukoza, ulega utlenieniu przy użyciu odczynnika Tollensa, Trommera i Benedicta do kwasu karboksylowego. Cząsteczka fruktozy ulega tautomerii keto‑enolowej, stając się glukozą, dzięki czemu daje pozytywny wynik próby na cukry redukujące.

W środowisku zasadowym jon wodorotlenkowy () jest akceptorem protonu przyłączonego do atomu węgla C‑2. Proton ten przenoszony jest na atom tlenu grupy aldehydowej (), dzięki temu tworzy się grupa hydroksylowa (). W wyniku tego przeniesienia między atomem węgla C‑1 a atomem węgla C‑2 powstaje wiązanie podwójne (). W ten sposób otrzymujemy związek zwany enodiolem (en – wiązanie podwójne; di – dwa; ol – alkohol). W środowisku zasadowym zachodzi odszczepienie protonu od grupy hydroksylowej przyłączonej do atomu węgla C‑2, a następnie przeniesienie wiązania podwójnego do wiązania między atomem węgla C‑2 a atomem tlenu. Podczas tego przekształcenia otrzymujemy grupę ketonową (). Wszystkie przedstawione na rysunku wzory związku występują w równowadze termodynamicznej.
Reakcje charakterystyczne
Fruktoza i glukoza ulegają reakcjom z odczynnikami:
Tollensa – odczynnik zawierający jony diaminasrebra(I) ; reakcję tę przeprowadza się w środowisku zasadowym; w wyniku pozytywnej próby, na ściankach naczynia wytrąca się charakterystyczne „lustro srebrowe”;


Trommera – próbę tę przeprowadza się podczas ogrzewania ze świeżo wytrąconym wodorotlenkiem miedzi(II);
Benedicta – odczynnik ten jest związkiem kompleksowym jonów miedzi(II) z cytrynianem sodu oraz węglanem sodu;
Fehlinga – to kompleks jonów miedzi(II) z winianem sodowo‑potasowym w środowisku .
Reakcje powyższych trzech prób można zapisać następująco:


Przedstawione powyżej próby nie pozwolą odróżnić od siebie glukozy i fruktozy.
Odróżnienie glukozy od fruktozy
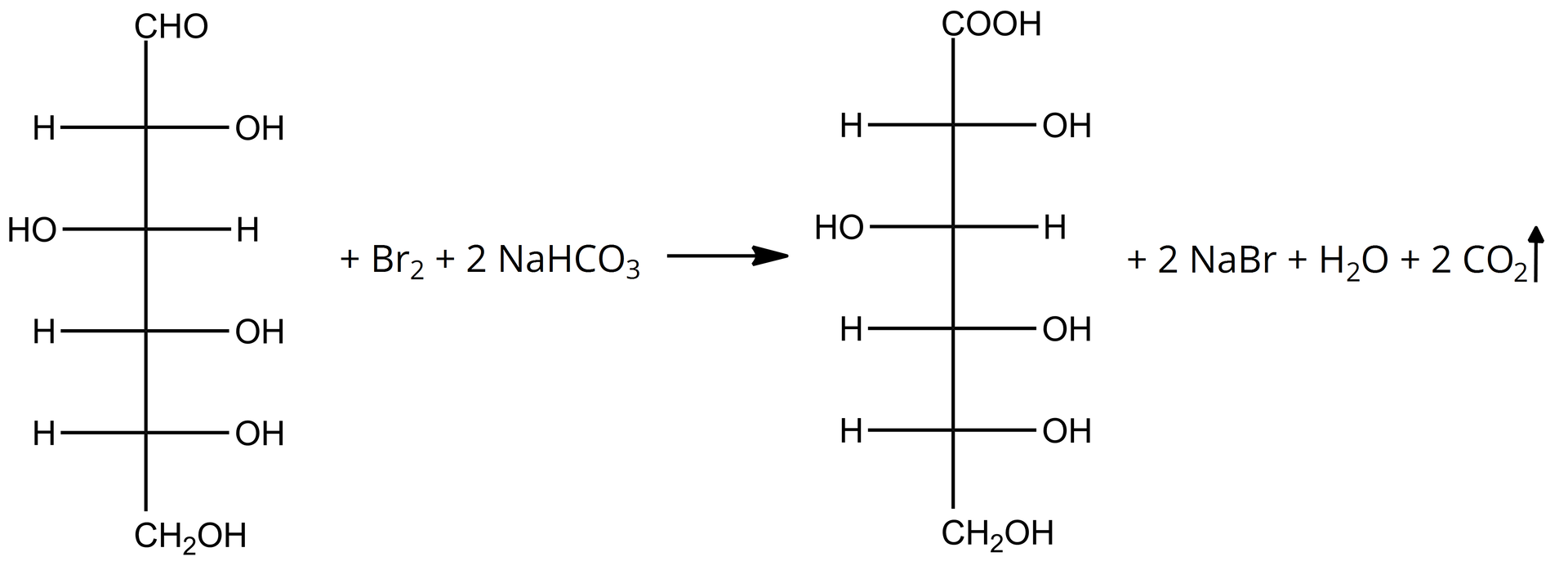
W odróżnianiu glukozy od fruktozy najlepiej przydaje się wykorzystanie utleniania wodą bromową z dodatkiem wodorowęglanu sodu. Zastosowanie podczas reakcji wodorowęglanu sodu jest niezbędne, ponieważ zakwasza on środowisko, dzięki czemu nie zachodzi enolizacja fruktozy, a co za tym idzie, fruktoza nie zmienia swojej postaci w glukozę. Rozróżnienie glukozy od fruktozy jest możliwe, ponieważ tylko grupa aldehydowa glukozy ulega utlenieniu, za sprawą czego powstaje kwas glukonowy. Podczas reakcji roztwór z barwy brunatnej staje się bezbarwny, a dodatkowo wydziela się bezbarwny gaz.
Słownik
sacharydy; cukry, cukrowce; polihydroksylowe aldehydy (aldozy) lub ketony (ketozy), o wzorze sumarycznym oraz ich pochodne
jakościowe i ilościowe oznaczanie składu pierwiastkowego w badanym materiale, z wykorzystaniem metod analizy chemicznych; oznaczanie składu związków organicznych, a przede wszystkim zawartości węgla, wodoru, azotu, tlenu, siarki i fluorowców
(gr. hýdōr „woda”; lýsis „rozłożenie”) rozkład substancji pod wpływem wody; reakcja podwójnej wymiany, która zachodzi między wodą a substancją w niej rozpuszczoną oraz prowadzi do powstania cząsteczek nowych związków chemicznych
, poszczególne cząsteczki heksoz to monosacharydy o sześciu atomach węgla w cząsteczce z grupą aldehydową (aldoheksozy), np. glukoza, galaktoza, mannoza, lub karbonylową (ketoheksozy), np. fruktoza; mając ten sam wzór sumaryczny, heksozy różnią się od siebie przestrzennym ułożeniem grup hydroksylowych i atomów wodoru (stereoizomery)
izomery konfiguracyjne, które nie są swoimi odbiciami lustrzanymi (nie są enancjomerami)
rodzaj izomeryzacji, która zachodzi w cząsteczkach związków organicznych, zwłaszcza sacharydów; polega na zmianie konfiguracji jednego z kilku centrów chiralności
przemiana formy karbonylowej ketonu lub aldehydu w enol
związki organiczne o cząsteczkach, w których grupa hydroksylowa () sąsiaduje z wiązaniem nienasyconym
Bibliografia
Encyklopedia PWN
Krzeczkowska M., Loch J., Mizera A., Chemia. Repetytorium. Liceum - poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.