Przeczytaj
Reaktywność tlenków wobec roztworów wodorotlenków
Do grupy tlenkówtlenków, które reagują z wodnymi roztworami wodorotlenków, należą tlenki kwasowe oraz tlenki amfoteryczne.
Tlenki kwasowe
Są to tlenki niemetali oraz niektóre tlenki metali, które reagują z wodnymi roztworami wodorotlenków, a nie reagują z kwasamikwasami. Większość tlenków kwasowychtlenków kwasowych należy do bloku . Są to następujące tlenki: , , , , , , , , , , , , , oraz tlenki chlorowców. Tlenki kwasowe tworzą również niektóre pierwiastki bloku , występujące na najwyższych stopniach utlenienia, jak na przykład chrom () i mangan ().
W reakcjach tlenków kwasowych z wodnymi roztworami wodorotlenków powstaje sól i woda. Reakcję tę można zapisać w sposób ogólny jako:
Poniżej przedstawiono równania wybranych reakcji roztwarzania tlenków kwasowych w wodnych roztworach wodorotlenków (zapis w formie cząsteczkowej oraz jonowej skróconej):
Tlenki amfoteryczne
Są to tlenki, które reagują z mocnymi kwasami oraz mocnymi zasadami. Dodatkowo, wiemy o nich, że nie reagują z wodą. Jedynym tlenkiem amfoterycznymtlenkiem amfoterycznym metalu z bloku jest . Tlenki amfoteryczne pierwiastków z bloku to: , , , ,, , , , , , . Tlenki amfoteryczne pierwiastków z bloku to np.: , , , , .
W reakcji tlenków amfoterycznych z wodnymi roztworami wodorotlenków o charakterze mocnych zasad (np. lub ) powstaje związek koordynacyjny, tzw. sól kompleksowa, w której kation metalu stanowi atom centralnyatom centralny, a aniony wodorotlenkowe pełnią funkcję ligandówligandów. W reakcji jednym z substratów jest również woda. Reakcję tę można przedstawić za pomocą równania:
Tlenki amfoteryczne można podzielić na trzy grupy, tworzące związki koordynacyjne o różnych liczbach koordynacji (liczbie wiązań kowalencyjnych jedno- lub wielokrotnych utworzonych z atomami ligandów przez atom centralny kompleksu), co pokazano na poniższym schemacie.
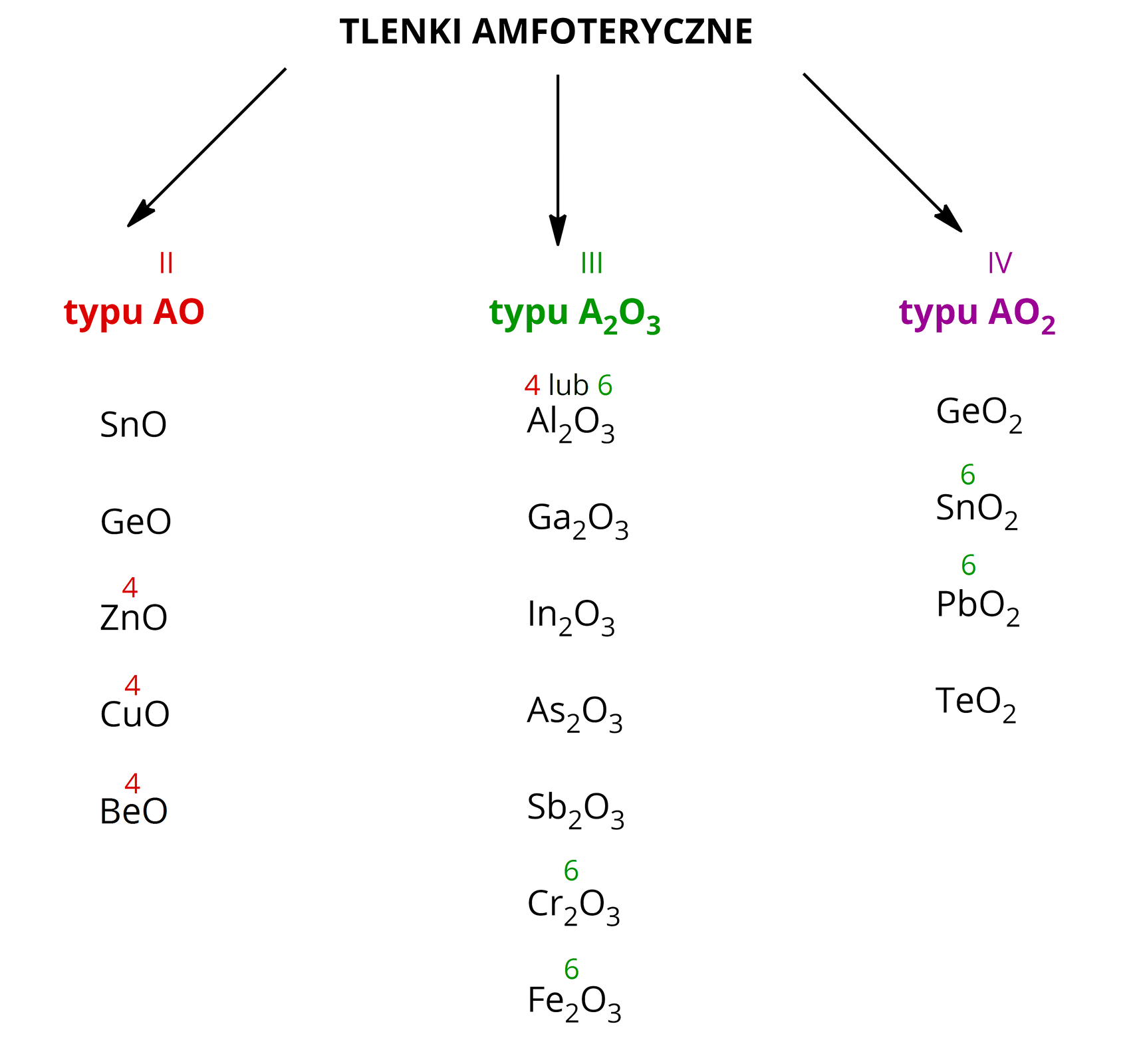
Poniżej przedstawiono równania wybranych reakcji roztwarzania tlenków amfoterycznych w wodnym roztworze wodorotlenku sodu (forma cząsteczkowa oraz jonowa skrócona):
Słownik
związki chemiczne tlenu z innymi pierwiastkami, w których atom tlenu występuje na stopniu utlenienia
tlenki, które reagują z zasadami, a nie reagują z kwasami
tlenki, które reagują z mocnymi kwasami oraz mocnymi zasadami
związki chemiczne, które dysocjują pod wpływem wody na kation oksoniowy oraz anion reszty kwasowej
związki kompleksowe, kompleksy; złożone cząsteczki lub jony (kationy, aniony), w których atom (lub jon), zwany atomem (jonem) centralnym, jest połączony za pomocą wiązania koordynacyjnego z ligandami – jonami lub cząsteczkami obojętnymi
(lub jon centralny); atom bądź jon stanowiący rdzeń związku koordynacyjnego i przyłączający (koordynujący) pewną liczbę jonów ujemnych lub cząsteczek obojętnych, zwanych ligandami
atom, cząsteczka lub anion w związkach kompleksowych, który jest przyłączony bezpośrednio do atomu centralnego lub kationu centralnego, zwanego centrum koordynacji albo rdzeniem kompleksu
Bibliografia
Bielański A., Podstawy Chemii nieorganicznej, t. 2, Warszawa 2013.
Pazdro K., Chemia. Podręcznik do kształcenia rozszerzonego w liceach, Część IV. Chemia nieorganiczna, Warszawa 2009.