Przeczytaj
Jak zinterpretować równanie reakcji chemicznej?
Równanie chemiczneRównanie chemiczne jest językiem, którym porozumiewają się chemicy w celu opisania jakościowego i ilościowego przebiegu reakcji chemicznej.

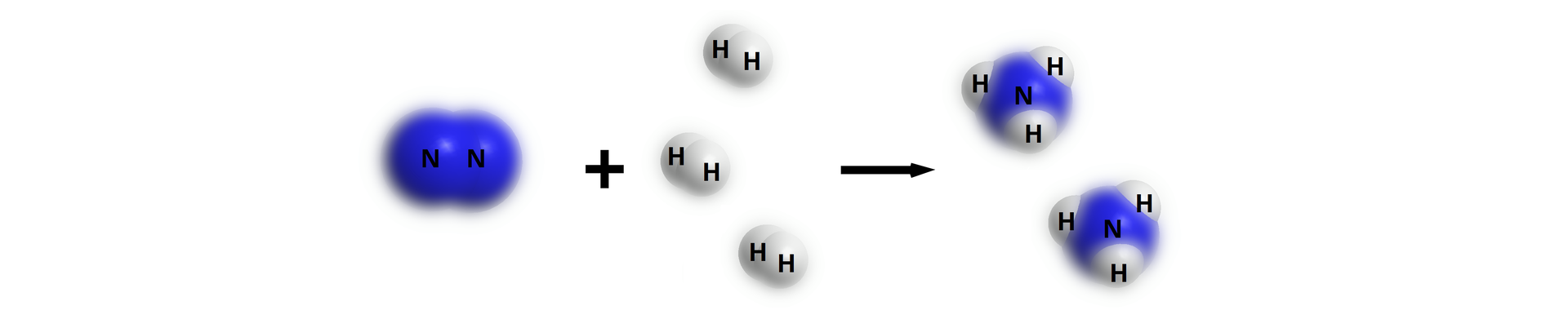
Fritz Haber [frɪts], niemiecki fizykochemik, który otrzymał w roku Nagrodę Nobla w dziedzinie chemii za opracowanie bezpośredniej metody syntezy amoniaku z wodoru i azotu, zgodnie z zapisem reakcji:
.
To równanie reakcji można zinterpretować w różny sposób, np.:
cząsteczka azotu reaguje z cząsteczkami wodoru, dając cząsteczki amoniaku.
mol cząsteczek azotu reaguje z molami cząsteczek wodoru, dając mole cząsteczek amoniaku.
Stosunek ilościowy substancji w reakcji chemicznej, nazywamy stosunkiem stechiometrycznym.
Liczba moli substratów użytych w reakcji chemicznej może być różna, ale zawsze reagują one ze sobą w stosunku stechiometrycznym. W powyższej reakcji azotu z wodorem wiemy, że mol cząsteczek azotu reaguje z molami cząsteczek wodoru. Kiedy weźmiemy do reakcji mole cząsteczek azotu i mole cząsteczek wodoru, przereaguje tylko mol cząsteczek azotu, a w mieszanie poreakcyjnej zostanie mol cząsteczek azotu.
Pierwszym krokiem w interpretacji równania reakcji chemicznej jest uzgodnienie współczynników stechiometrycznych. Czy wiesz, na czym ono polega?
Uzgodnienie współczynników stechiometrycznych opiera się na „wyrównaniu” ilości elementów po lewej i prawej strony równania reakcji chemicznej.
Dobierz współczynniki stechiometryczne w poniższym schemacie:
W obecnym zapisie po lewej stronie równania znajdują się atomy azotu (w jednej dwuatomowej cząsteczce) oraz atomy wodoru (również w jednej dwuatomowej cząsteczce), a po prawej stronie równania zapisano 1 atom azotu i atomy wodoru (w jednej cząsteczce amoniaku). Aby uzgodnić równanie reakcji, należy „wyrównać” liczby atomów po obu stronach równania reakcji chemicznej. Ponieważ po prawej stronie jest nieparzysta liczba atomów wodoru, a po prawej parzysta, przed produktem () należy wpisać cyfrę . Wtedy po prawej stronie równania mamy w dwóch cząsteczkach amoniaku atomy azotu i 6 atomów wodoru (). Po lewej stronie równania mamy też atomy azotu (w jednej dwuatomowej cząsteczce), ale dalej nie zgadza się liczba atomów wodoru – po lewej stronie i po prawej. Dlatego należy dopisać przed symbolem wodoru po lewej stronie. Uzgodnione równanie tej reakcji chemicznej wygląda następująco:
Jak można zinterpretować jakościowo i ilościowo równania reakcji chemicznych?
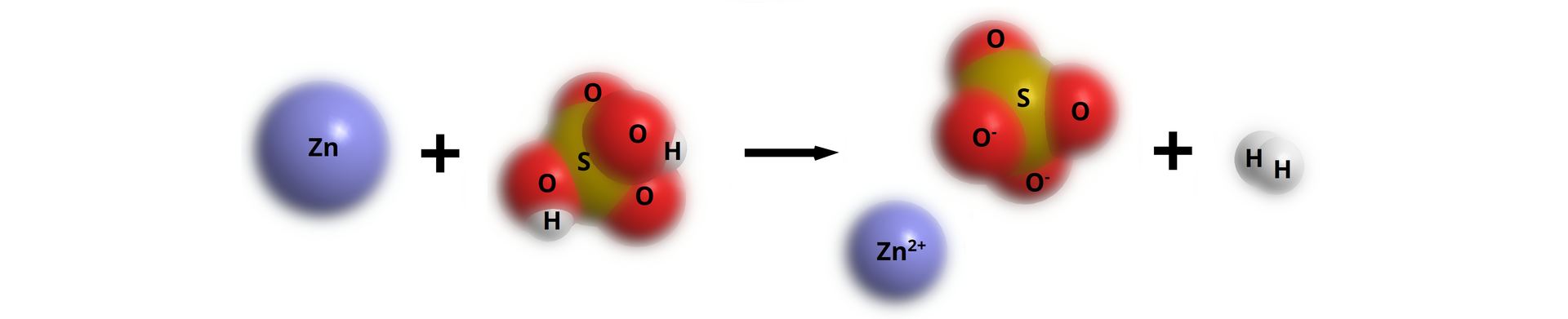
Zapisz równanie reakcji pomiędzy cynkiem a kwasem siarkowym(), uwzględniając stosunki stechiometryczne reagentów.
Interpretacja w makroświecie: mol atomów cynku reaguje z jednym molem cząsteczek kwasu siarkowego(), dając mol siarczanu() cynku i mol cząsteczkowego wodoru.
Interpretacja w mikroświecie nie jest możliwa w tym przypadku – bo choć możemy powiedzieć, że atom cynku reaguje z cząsteczką kwasu siarkowego(), dając cząsteczkę wodoru, to nie możemy użyć sformułowania cząsteczka siarczanu() cynku (jest to związek o wiązaniach jonowych, ma budowę krystaliczną i użycie terminu cząsteczka nie jest poprawne).
Interpretacja makroskopowa równania bardziej przystaje do pracy chemika, ponieważ chemicy syntetycy nie wprowadzają do naczynia reakcyjnego po jednym atomie czy jednej cząsteczce.
Stała AvogadraStała Avogadra to liczba, która jest równa liczbie atomów, cząsteczek, jonów itp., zawartych w molu substancji.
Jak dokonać interpretacji równań reakcji chemicznych z wykorzystaniem terminu „masa”?
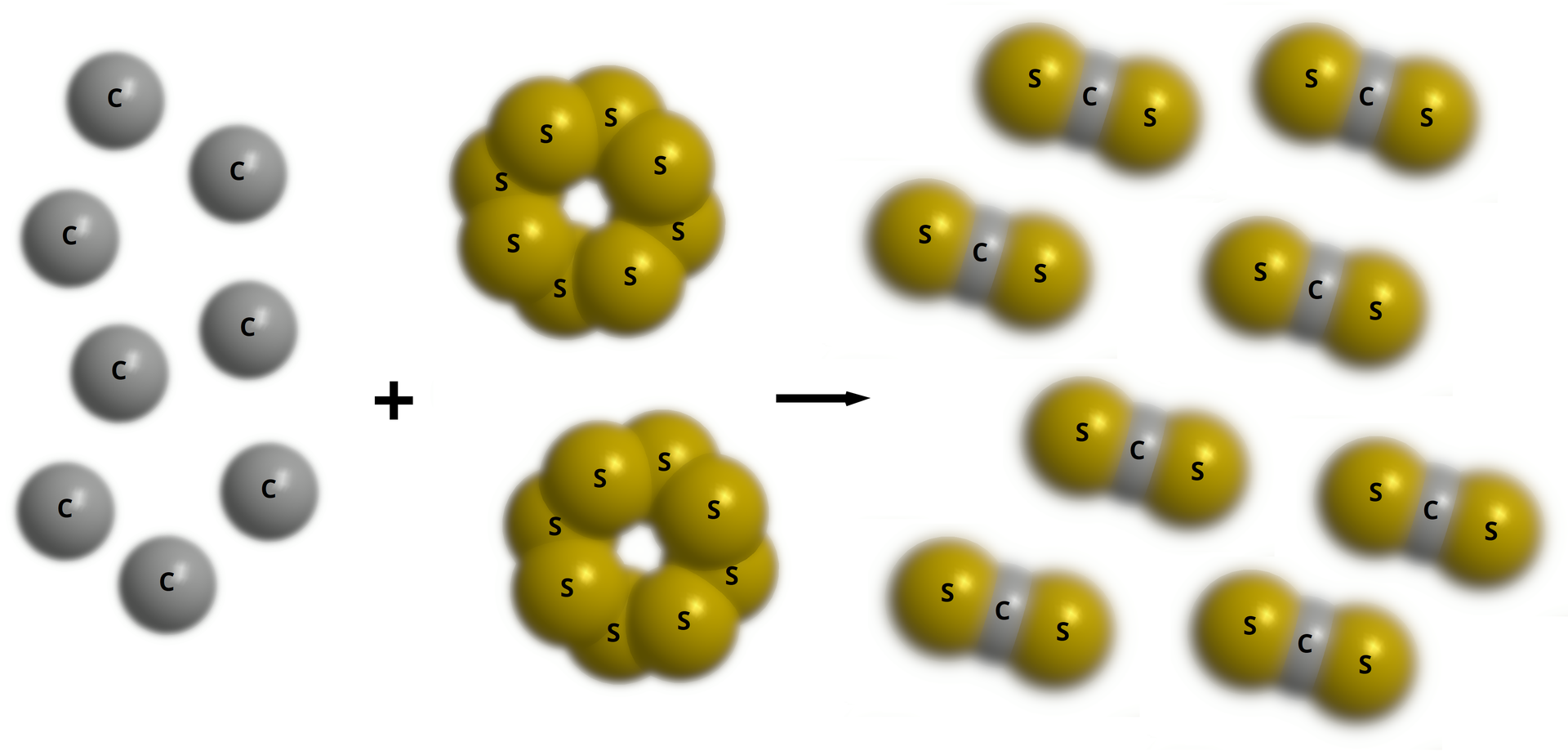
Zapisz i uzgodnij równanie reakcji otrzymywania disiarczku węgla () z siarki i węgla. Załóż, że w warunkach przeprowadzenia reakcji siarka występuje w postaci cząsteczek ośmioatomowych.
Krok 1. Zapisz równanie reakcji.
Krok 2. Uzgodnij równanie reakcji.
Interpretacja w makroświecie: moli atomów węgla reaguje z molami cząsteczek siarki, w wyniku czego powstaje moli disiarczku węgla.
Interpretacja masowa: Na podstawie mas atomowych z układu okresowego dla danych pierwiastków możesz odczytać i obliczyć, że:
moli atomów węgla ma masę gramów ();
mole cząsteczek siarki mają masę gramów ( · · 32 g = 512 g);
W wyniku tej reakcji otrzymujemy 608 gramów disiarczku węgla ( · (12 g + · 32 g) = 608 g).
Na tej podstawie, znając ilość jednego dowolnego reagenta, możemy określić ilość otrzymanego produktu. Ilość jednego reagenta określa ilość wszystkich pozostałych reagentów. Wolna siarka występuje w postaci 8‑atomowych cząsteczek (), jednak w równaniach reakcji chemicznych często stosuje się uproszczony zapis siarki (), tak jakby występowała ona w postaci pojedynczych atomów.
Oblicz masę siarki, jaka jest potrzebna do przereagowania z 3 g węgla. Załóż, że siarka, w warunkach przeprowadzenia reakcji, występuje w postaci cząsteczek dwuatomowych.
Krok 1. Zapisz równanie reakcji i uzgodnij współczynniki.
Krok 2. Korzystając z układu okresowego, ustal masy molowe poszczególnych substratów.
Krok 3. Ułóż proporcję.
Zgodnie z równaniem reakcji 12 g węgla reaguje z 64 g siarki (2 · 32 g), a więc 3 g węgla reagują z x g siarki:
Odpowiedź: masa siarki potrzebna do przereagowania z 3 g węgla wynosi 16 g.
Jak z równań reakcji chemicznych odczytać objętości reagentów?
W XIX w. Louis Gay‑Lussac [ge lüsạk] sformułował prawo stosunków objętościowych, które brzmi:
Jeżeli wszystkie objętości mierzono w tych samych warunkach ciśnienia i temperatury, to stosunek objętości reagujących gazów i gazowych produktów pozostają do siebie w stosunku niewielkich liczb całkowitych.
Równe objętości różnych gazów w tych samych warunkach temperatury i ciśnienia zawierają jednakowe ilości moli tych gazów.
1 mol gazu, czyli 6,02 · 10Indeks górny 2323 cząsteczek (bądź w przypadku gazów szlachetnych - atomów), w warunkach normalnych, zajmuje objętość 22,41 .
Stosunek objętościowy reagentów gazowych jest równy ich stosunkowi molowemu.
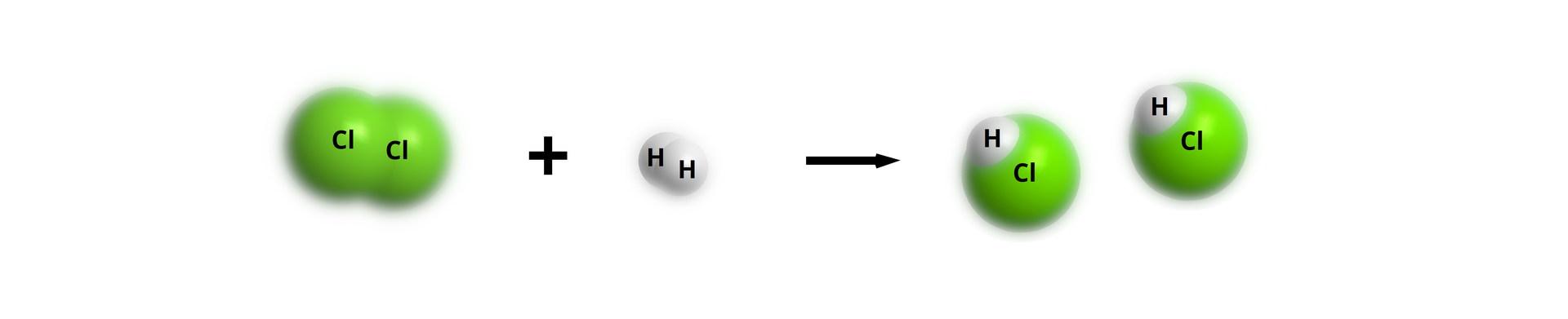
Zinterpretuj objętościowo równanie chemiczne otrzymywania chlorowodoru () z wodoru i chloru.
Krok 1. Zapisz równanie reakcji i ustal współczynniki stechiometryczne.
Krok 2. Zapisz, ile moli produktów bierze udział w reakcji.
Interpretacja objętościowa: 1 objętość cząsteczkowego chloru reaguje z 1 objętością cząsteczkowego wodoru, w wyniku czego powstają 2 objętości cząsteczkowego chlorowodoru. Oznacza to, że 22,41 chloru reaguje z 22,41 wodoru, dając 44,82 chlorowodoru.
Czasami jednak objętość gazów w reakcji się zmienia (np. maleje). Spójrz jeszcze raz na równanie reakcji syntezy amoniaku:
Równanie to można zinterpretować następująco: 22,41 azotu reaguje z 67,23 wodoru, dając 44,82 amoniaku, czyli objętość substratów wynosi 89,64 , a objętość produktów 44,82 . W tej reakcji objętość maleje dwukrotnie.
Należy pamiętać, że TYLKO 1 mol gazu w warunkach normalnych ma objętość 22,41 . Zależność ta nie dotyczy cieczy i ciał stałych.
Słownik
liczba cząstek (atomów, cząsteczek, jonów etc.) w molu dowolnej substancji chemicznej; jedna z najważniejszych stałych uniwersalnych; NIndeks dolny AA = 6,02214076 · 10Indeks górny 2323 molIndeks górny -1-1
jednostka liczności (ilości) materii, podstawowa w układzie SI; Jeden mol materii zawiera dokładnie 6,02214076×10Indeks górny 2323 obiektów elementarnych (jest to definicja obowiązująca od 20 maja 2019 r. – poprzednio mol definiowano jako liczność materii układu, zawierającego liczbę cząstek równą liczbie atomów w masie 0,012 kg izotopu węgla ); stosując termin „mol”, należy określić rodzaj obiektów (np.: atomy, cząsteczki, jony, elektrony, inne cząstki albo określone zespoły takich cząstek); w obliczeniach zwykle przyjmuje się, że mol jest to około 6,02 · 10Indeks górny 2323
zapis jakościowej i ilościowej informacji o zachodzącej przemianie chemicznej za pomocą wzorów lub symboli chemicznych.
umownie przyjęte wartości ciśnienia (tzw. ciśnienie normalne) pIndeks dolny 00 = 1 atm = 1013,25 hPa oraz temperatury (tzw. temperatura normalna) TIndeks dolny 00 = 0°C = 273,15 K, dla których podaje się zwykle wartości wielkości fizycznych, charakteryzujących ciała
Bibliografia
Atkins P., Jones L., Chemia ogólna. Cząstki, materia, reakcje, Warszawa 2018.
Bielański A., Podstawy chemii nieorganicznej, Warszawa 2007.
Encyklopedia PWN
Zadania maturalne CKE