Przeczytaj
E‑materiały powiązane z tematem krwi
Techniki mikroskopowe
Istnieją rozmaite techniki badań biochemicznych i molekularnych, dzięki którym można obserwować komórki i ich najmniejsze nawet cząsteczki. Do najbardziej powszechnych metod należą badania prowadzone za pomocą mikroskopów (gr. mikros – mały, skopeo – patrzę, obserwuję) – przyrządów optycznych pozwalających na otrzymywanie powiększonych obrazów obiektów niewidocznych gołym okiem.
Wynalezienie mikroskopu najczęściej przypisuje się dwóm Holendrom – Hansowi i Zachariaszowi Janssenom (ojcu i synowi) – którzy na przełomie XVI i XVII w. skonstruowali urządzenie składające się z dwóch soczewek zamocowanych na obu końcach rury. Przyrząd ten, zwany mikroskopem sprzężonym, pozwalał na zaledwie 10‑krotne powiększenie obserwowanego obiektu. Obserwacja komórek stała się możliwa nieco później – w połowie XVII w. – dzięki wynalezieniu mikroskopu optycznego (świetlnego) przez angielskiego przyrodnika i eksperymentatora Roberta Hooke’a (1635–1703).
Współcześnie najczęściej stosowanymi mikroskopami są: mikroskopy optyczne (świetlne), mikroskopy fluorescencyjne oraz mikroskopy elektronowe.
Więcej na temat mikroskopów i mechanizmów ich działania w e‑materiale Rodzaje mikroskopów używanych w badaniach biologicznychRodzaje mikroskopów używanych w badaniach biologicznych
Obserwacja mikroskopowa elementów morfotycznych krwi
Aby przeprowadzić obserwację mikroskopową danego obiektu biologicznego, należy obiekt ten odpowiednio przygotować, pamiętając, że nie każdy obiekt można obserwować pod każdym mikroskopem, a ponadto – że każdy rodzaj mikroskopu wymaga innego sposobu wykonania preparatu.
Preparatem mikroskopowym wykonywanym w celu zbadania elementów morfotycznych krwi (jej upostaciowanych składników) jest rozmazrozmaz krwi, który poddaje się barwieniubarwieniu. Analizy wybarwionego rozmazu krwi dokonuje się podczas obserwacji pod mikroskopem optycznym (świetlnym) lub elektronowym.
Rozmaz krwi
Rozmaz krwi wykonuje się w każdej sytuacji, w której podejrzewa się występowanie patologicznych zmian w komórkach, gdyż pozwala on na dokładne zbadanie elementów morfotycznych krwi i ich ocenę. Przygotowanie rozmazu można całkowicie zautomatyzować: współczesne analizatory hematologiczne z dużą dokładnością dokonują ilościowej i jakościowej oceny komórek krwi obwodowej. Dzięki temu w wielu przypadkach klinicznych nie ma potrzeby manualnego wykonywania rozmazów. Jednak wykorzystanie ludzkiego oka oraz doświadczenia specjalisty oglądającego preparat mikroskopowy pozostaje niezastąpioną, najdokładniejszą metodą.

Barwienie rozmazów krwi
Aby uwidocznić pod mikroskopem komórki krwi, wykorzystuje się podstawową metodę barwienia rozmazów – metodę PappenheimaPappenheima.
Metoda Pappenheima łączy dwie metody barwienia:
klasyczne barwienie metodą Maya‑Grünwalda,które pozwala na dostrzeżenie ziarnistości granulocytów i uwidocznia wielobarwność erytrocytów;
barwienie metodą Giemsymetodą Giemsy, które doskonale eksponuje jądra komórkowe oraz ziarnistości neutrofili i limfocytów.
Prawidłowo wykonany rozmaz poddaje się analizie przy użyciu mikroskopu. Podczas obserwacji ocenia się liczbę, kształt, rozmiar i barwę elementów morfotycznych krwi. Na podstawie tych informacji można określić grupę możliwych schorzeń i skierować pacjenta na dalsze badania diagnostyczne.
Więcej na temat interpretacji wyników badania krwi w e‑materiale Wartość diagnostyczna badania laboratoryjnego krwiWartość diagnostyczna badania laboratoryjnego krwi
Pierwsze badanie komórek krwi przy użyciu rozmazu miało miejsce w XIX w. Dokonał tego francuski lekarz patolog Gabriel Andral: nałożył na szkiełko kroplę krwi i rozprowadził ją silnym podmuchem powietrza.
Określenia „rozmaz” pierwszy raz użył w 1879 r. Paul Ehrlich. Ten niemiecki chemik i bakteriolog także jako pierwszy dokonał barwienia tkanek, w tym krwi – stało się to w 1887 r.
Instrukcja przygotowania preparatu mikroskopowego z krwi obwodowej
Aby przygotować preparat z krwi obwodowej należy: (1) pobrać materiał, (2) wykonać rozmaz oraz (3) poddać go barwieniu.
Pobranie materiału
Materiałem wykorzystywanym do wykonania rozmazu krwi jest krew pełna obwodowa, zawiera bowiem pełny skład fizjologiczny krwi.
Krew jest pobierana:
bez antykoagulantuantykoagulantu (krew natywna) – tylko wtedy, gdy rozmaz zostanie wykonany natychmiast po pobraniu;
na antykoagulant (sól potasową kwasu etyleno‑diaminotetraoctowego – EDTAEDTA; zalecanym antykoagulantem jest KIndeks dolny 22-EDTA) – jeśli rozmazu nie można wykonać od razu po pobraniu na antykoagulant.
Najlepsze rozmazy otrzymuje się z krwi natywnej, jednak w praktyce krew jest najczęściej pobierana na antykoagulant. Próbkę przekazuje się do laboratorium, gdzie przygotowywany jest preparat do badania mikroskopowego. Istotne jest, by rozmaz z tak pobranej krwi przygotować maksymalnie do 3 godzin, aby można było właściwie ocenić komórki.
Wykonanie rozmazu
Do przygotowania rozmazu krwi potrzebne są dwa szkiełka: podstawowe i rozprowadzające (nakrywkowe), które powinny zostać wcześniej odtłuszczone.
Odpowiednie przygotowanie preparatu jest kluczowym czynnikiem warunkującym prawidłową ocenę krwinek i rzetelne wyniki.
Jakość rozmazu zależy od następujących elementów:
szybkości przesuwania szkiełka rozprowadzającego – szybkie przesunięcie szkiełka rozprowadzającego daje długi i cienki rozmaz. Im wolniej szkiełko jest przesuwane, tym krótszy i grubszy jest rozmaz, przez co jakość rozmazu staje się gorsza;
kąta nachylenia szkiełka rozprowadzającego – kąt większy niż 30° powoduje, że rozmaz jest grubszy; kąt mniejszy niż 30° powoduje, że rozmaz jest cieńszy;
wielkości nałożonej kropli krwi na szkiełko podstawowe – mała kropla krwi może być niewystarczająca do wykonania rozmazu o odpowiedniej długości; zbyt duża może spowodować rozciągnięcie rozmazu poza granice szkiełka.
Barwienie rozmazu krwi metodą Pappenheima (Maya–Grünwalda– Giemsy, MGG)
Materiał do badań:
krew pełna włośniczkowa pobrana bezpośrednio z palca.
Odczynniki:
barwnik Maya‑Grünwalda;
barwnik Giemsybarwnik Giemsy;
woda destylowana o odczynie obojętnym (wcześniej zagotowana i wystudzona);
etanol 98% – do odtłuszczania szkiełek i sterylizacji powierzchni.
Sprzęt:
czyste i odtłuszczone szkiełko podstawowe;
szkiełko podstawowe (rozprowadzające, o ściętych brzegach);
pipeta Pasteura;
szalka Petriego do barwienia preparatów;
automatyczny aparat do nakłuwania lub sterylna igła.
Procedura barwienia:
Pokryj wysuszony rozmaz krwi obwodowej 1 ml roztworu barwnika Maya–Grünwalda i pozostaw na 3 minuty (celem tego kroku jest utrwalenie rozmazu).
Dodaj na szkiełko 1 ml wody destylowanej (odczyn obojętny) i lekko kołysząc, wymieszaj z barwnikiem znajdującym się na szkiełku. Pozostaw na 1 minutę.
Przepłucz szkiełko wodą destylowaną.
Nanieś na szkiełko rozcieńczony roztwór Giemsy (1 ml stężonego roztworu Giemsy i 20 ml wody destylowanej). Pozostaw na 15 minut. Uwaga: mieszanina jest nietrwała, należy ją sporządzać bezpośrednio przed barwieniem.
Przepłucz szkiełko wodą destylowaną.
Dokonaj obserwacji mikroskopowej przygotowanego preparatu.

Film dostępny pod adresem /preview/resource/RxUp0b2sJYTv5
Film nawiązujący do barwienia rozmazu krwi metodą Pappenheima.
Wyniki barwienia
W wyniku barwienia metodą Pappenheima obserwowane pod mikroskopem komórki uzyskują niebieskie, fioletowe lub różowe zabarwienie.
Oceny rozmazu należy dokonywać w miejscu, w którym krwinki czerwone znajdują się obok siebie i odległości pomiędzy nimi nie są zbyt duże.
Komórka | Opis |
|---|---|
LEUKOCYTY (KRWINKI BIAŁE): GRANULOCYTY | |
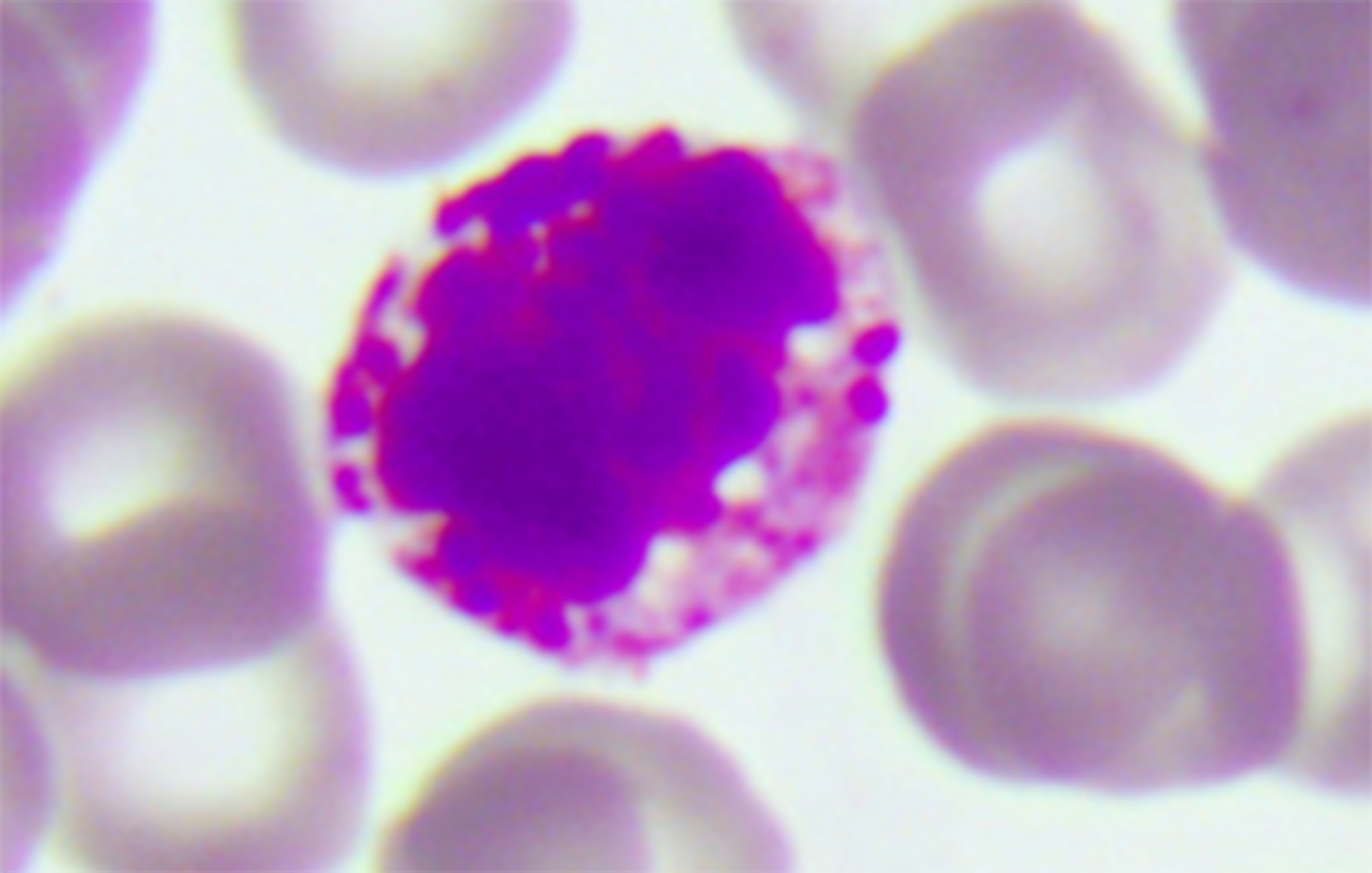 Powiększenie całkowite: 1000× | Granulocyty zasadochłonne (bazofile) |
 Powiększenie całkowite: 1000× | Granulocyty kwasochłonne (eozynofile) |
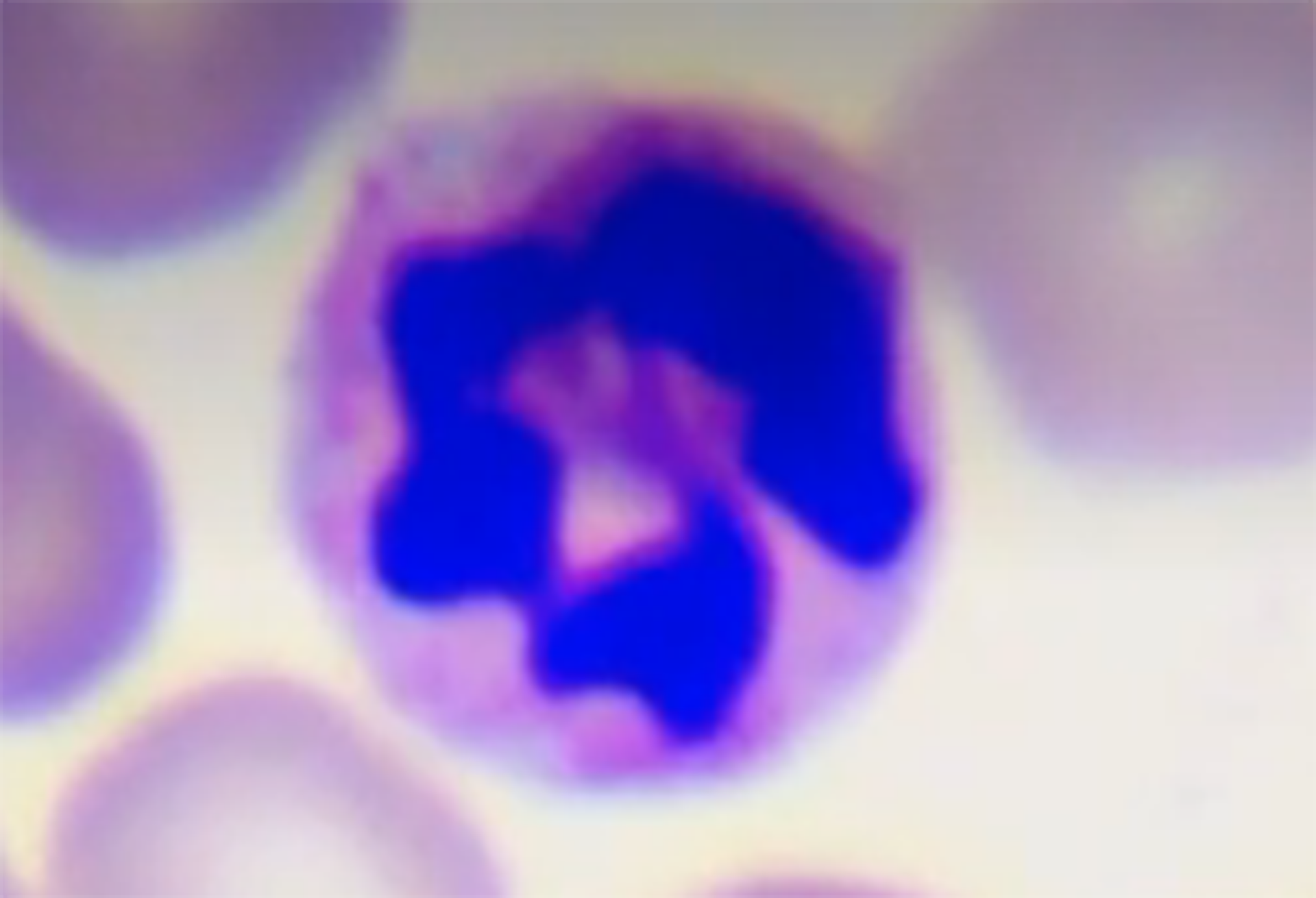 Powiększenie całkowite: 1000× | Granulocyty obojętnochłonne (neutrofile) niedojrzałe Jądro pałeczkowate. |
 Powiększenie całkowite: 1000× | Granulocyty obojętnochłonne (neutrofile) dojrzałe |
LEUKOCYTY (KRWINKI BIAŁE): AGRANULOCYTY | |
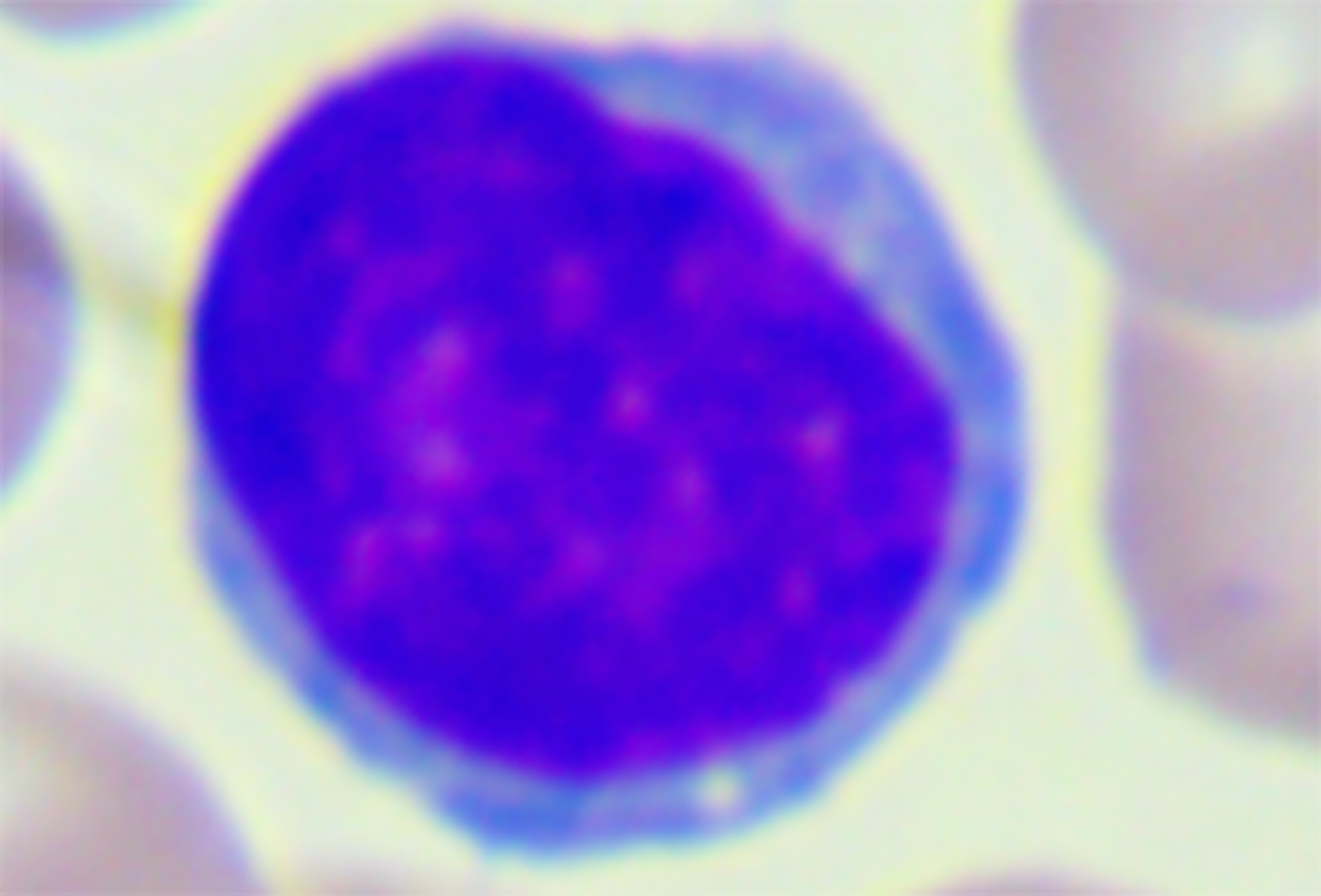 Powiększenie całkowite: 1000× | Małe limfocyty |
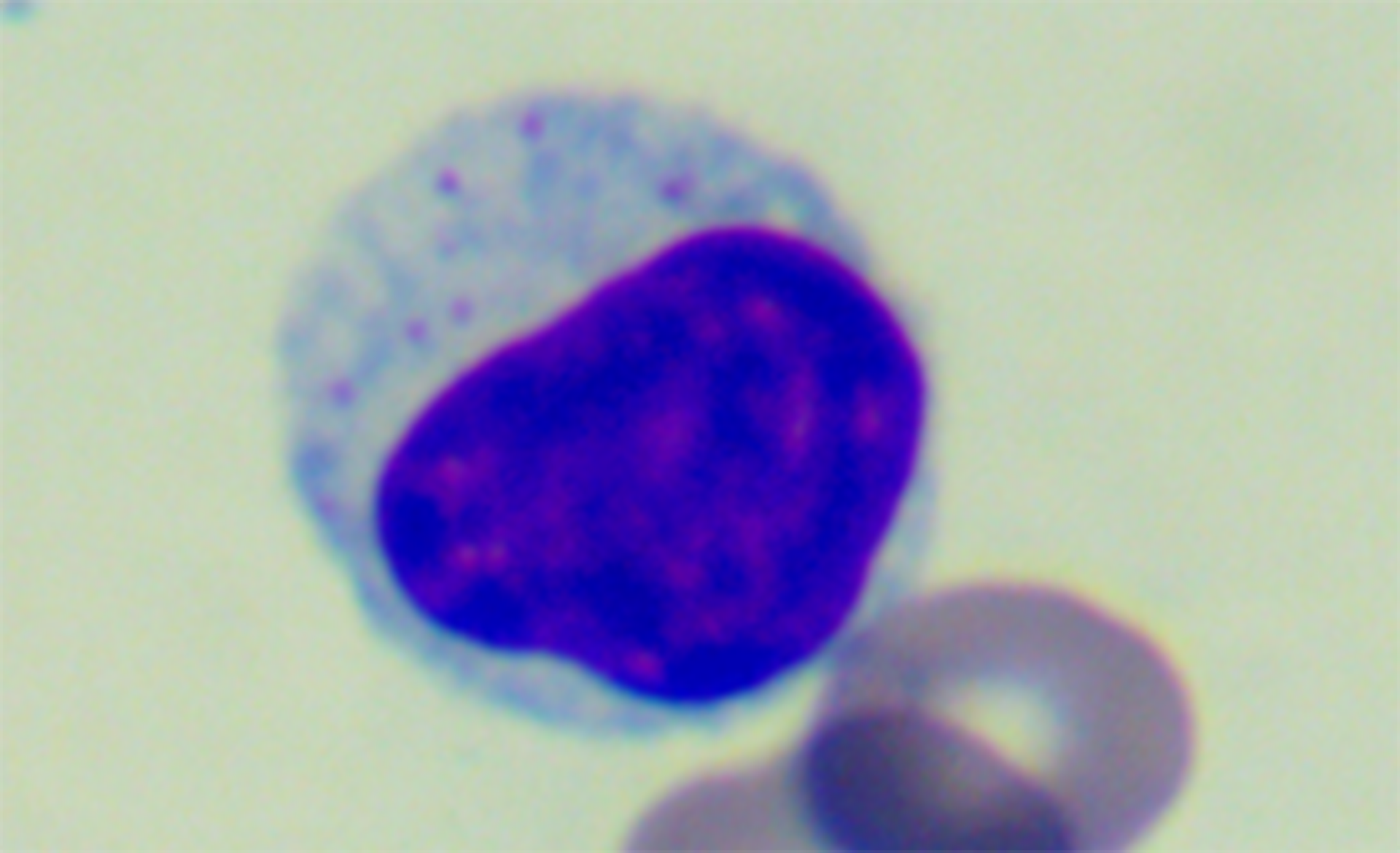 Powiększenie całkowite: 1000× | Duże limfocyty |
 Powiększenie całkowite: 1000× | Monocyty |
TROMBOCYTY (PŁYTKI KRWI) | |
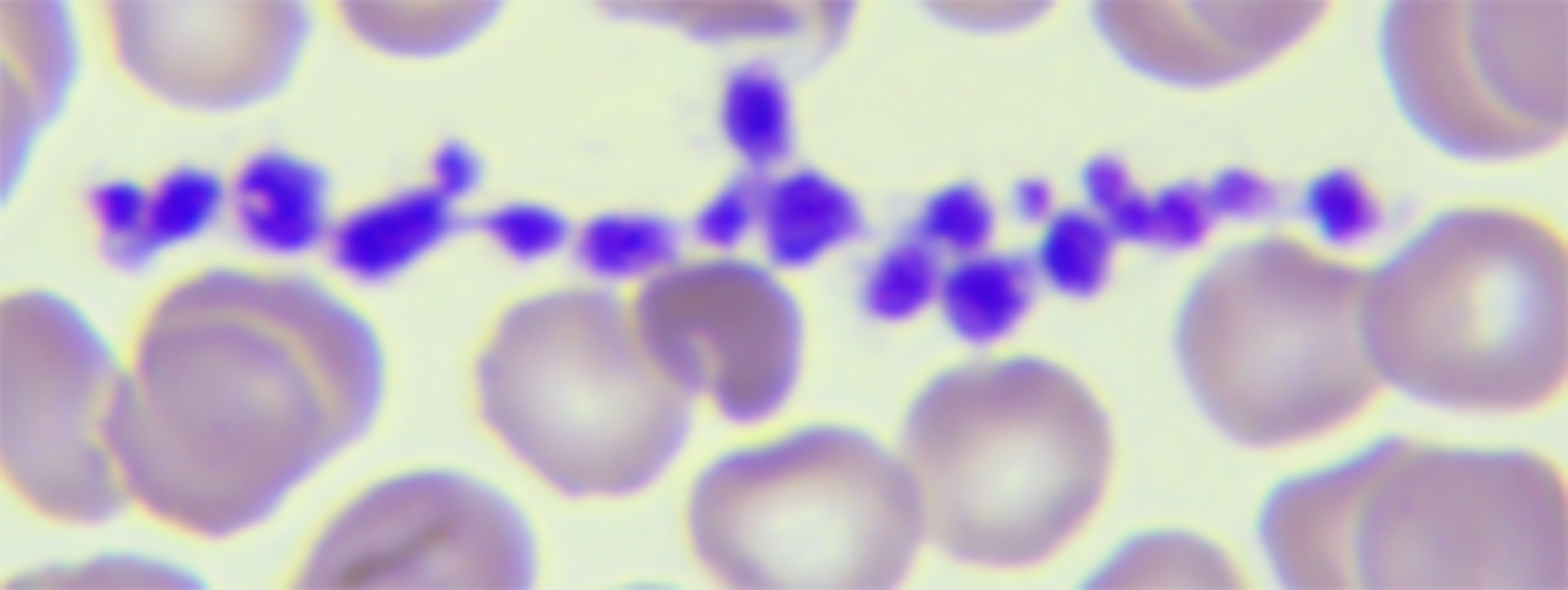 Powiększenie całkowite: 1000× | Bezjądrowe fragmenty cytoplazmy. |
ERYTROCYTY (KRWINKI CZERWONE) | |
 Powiększenie całkowite: 1000× | Brak jądra komórkowego (krwinki są jasne w środku). |
Więcej na temat składników krwi w e‑materiale Krew – specjalny rodzaj tkanki łącznejKrew – specjalny rodzaj tkanki łącznej
Słownik
inhibitor krzepnięcia krwi
zespół metod mających na celu wizualizację określonych struktur, elementów komórkowych lub identyfikację związków chemicznych w materiale roślinnym lub zwierzęcym; barwienie preparatów mikroskopowych dokonuje się przez naniesienie barwnika (związku chemicznego) na szkiełko mikroskopowe
roztwór eozynyeozyny i błękitu metylenowegobłękitu metylenowego, utrwalony przez glicerol
roztwór eozynyeozyny i błękitu metylenowegobłękitu metylenowego
organiczny związek chemiczny, barwnik stosowany do wybarwiania preparatów biologicznych; w temperaturze pokojowej jest to bezwonny, ciemnozielony proszek, którego wodny roztwór ma zabarwienie niebieskie
(gr. chrṓma – barwa) postać materiału genetycznego, która występuje w jądrze komórkowym między podziałami komórkowymi; wyróżnia się dwie podstawowe formy chromatyny: heterochromatyna jest silnie skondensowana i nie ulega transkrypcji, natomiast euchromatyna ma luźniejszą strukturę, która umożliwia transkrypcję
organiczny związek chemiczny, kwas polikarboksylowy i jednocześnie alfa‑aminokwas; jest szeroko stosowanym czynnikiem kompleksującym wiele kationów metali, zwykle w postaci soli disodowej ze względu na jej większą rozpuszczalność w wodzie
bromowa pochodna fluoresceiny; wykazuje właściwości kwasowe, dlatego ma silniejsze powinowactwo do elementów komórki o charakterze kwasochłonnym; stosowana jest m.in. w metodzie barwienia Giemsy; elementy komórkowe zasadochłonne, w tym jądra komórkowe, wybarwiają się na kolor niebieski, a kwasochłonne na kolor czerwony
wartość stosowana do opisu zjawisk okresowych; określa stan ruchu w danej chwili
zjawisko polegające na emitowaniu fal świetlnych przez cząsteczkę fluorochromu wzbudzoną światłem o właściwej długości fali
rodzaj fotoluminescencjifotoluminescencji; zanika w stosunkowo długim czasie (w porównaniu z fluorescencjąfluorescencją)
luminescencja zachodząca w wyniku powrotu do stanu podstawowego cząsteczek lub atomów wzbudzonych do wyższych stanów elektronowych promieniowaniem elektromagnetycznym (zakresu widzialnego i nadfioletu)
hemoproteina zbudowana z czterech łańcuchów polipeptydowych (globiny), z których każdy zawiera związaną grupę hemową; jej funkcją jest wiązanie i transport tlenu oraz jonów wodorowych i dwutlenku węgla we krwi
zjawisko fizyczne nakładania się dwóch (lub więcej) fal, przy którym w różnych punktach przestrzeni następuje wzmacnianie lub osłabianie amplitudy fali wypadkowej
metoda barwienia za pomocą roztworu eozyny i błękitu metylenowego, utrwalonego przez glicerol; metodę tę opracował w 1904 r. Gustav Giemsa (1867–1948), niemiecki chemik i bakteriolog; barwienie metodą Giemsy umożliwia różnicowanie komórek krwi i barwienie chromosomów
metoda barwienia za pomocą roztworu eozyny i błękitu metylenowego, opracowana w 1902 r. przez niemieckich lekarzy internistów – Richarda Maya (1863–1936) i Ludwiga Grünwalda (1863–1927); barwienie metodą Maya–Grünwalda pozwala na dostrzeżenie ziarnistości granulocytów i uwidocznia wielobarwność erytrocytów
niemiecki lekarz, hematolog; twórca metody barwienia zwanej metodą Pappenheima, łączącej metodę Maya–Grünwalda z metodą Giemsy
łatwość, z jaką enzym łączy się z danym substratem
obiekty biologiczne przygotowywane w specjalny sposób do analizy podczas obserwacji mikroskopowej; każdy rodzaj mikroskopu wymaga odmiennego sposobu wykonania preparatu
różnica pomiędzy wartościami fazyfazy dwóch fal, np. świetlnych
przezroczysta przednia część błony zewnętrznej oka kręgowców, właściwa także dla człowieka
rodzaj preparatu mikroskopowego, na którym kroplę krwi, szpiku kostnego, zawiesiny bakterii itp. rozprowadza się na szkiełku podstawowym w celu wykonania badania mikroskopowego