Przeczytaj
Wodorki
Wodorki to związki wodoru z innymi pierwiastkami. Ze względu na skład, możemy je podzielić na:
wodorki niemetali – związki, w których wodór występuje na stopniu utlenieniastopniu utlenienia;
wodorki metali – związki, w których wodór występuje na stopniu utlenienia.
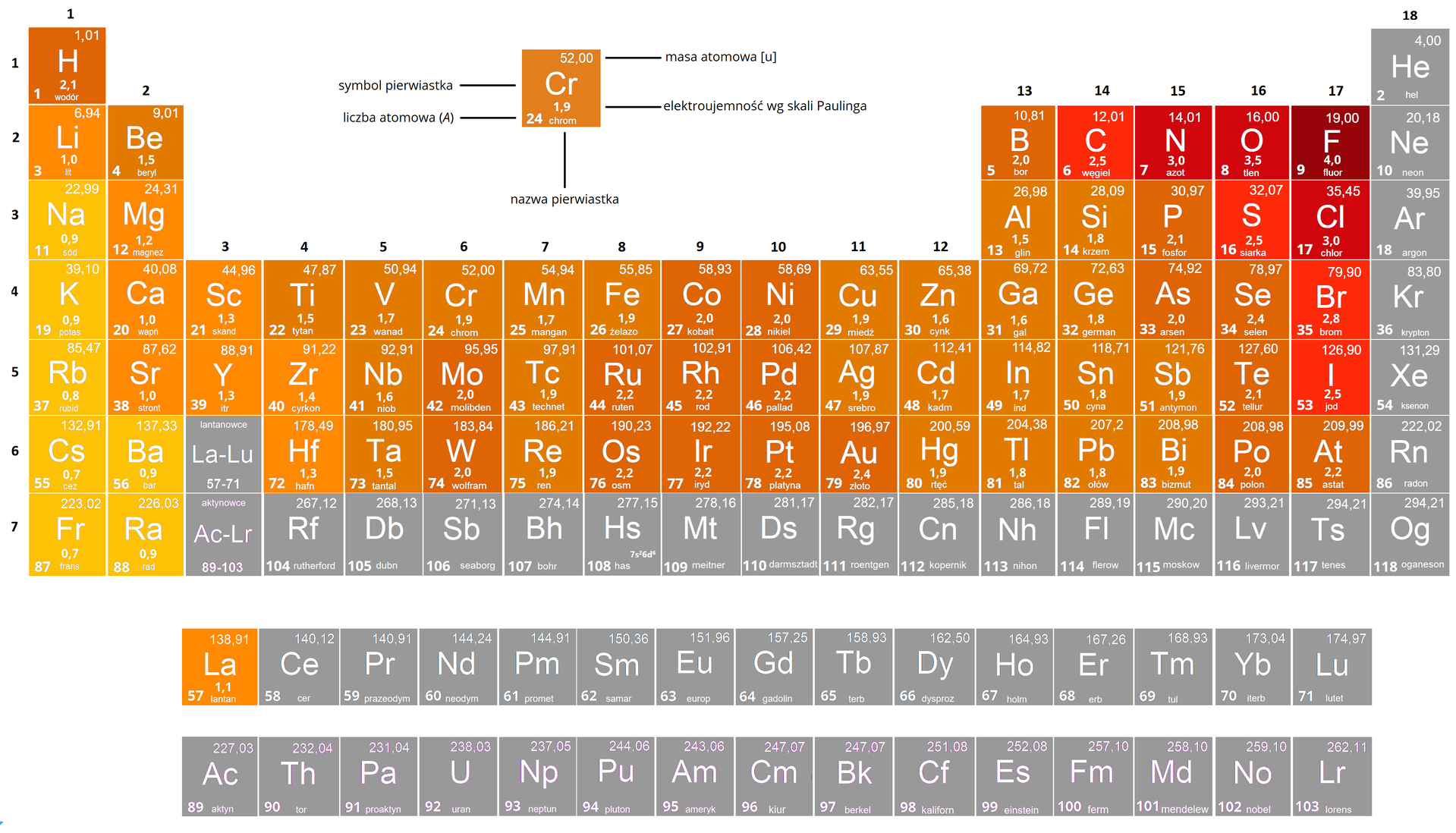
Pierwiastki i grupy tworzą wodorki o budowie jonowej (wyjątek: ). Są to białe lub jasnoszare proszki, które posiadają wysoką temperaturę topienia. Ich struktura krystalicznastruktura krystaliczna przypomina strukturę soli kuchennej.

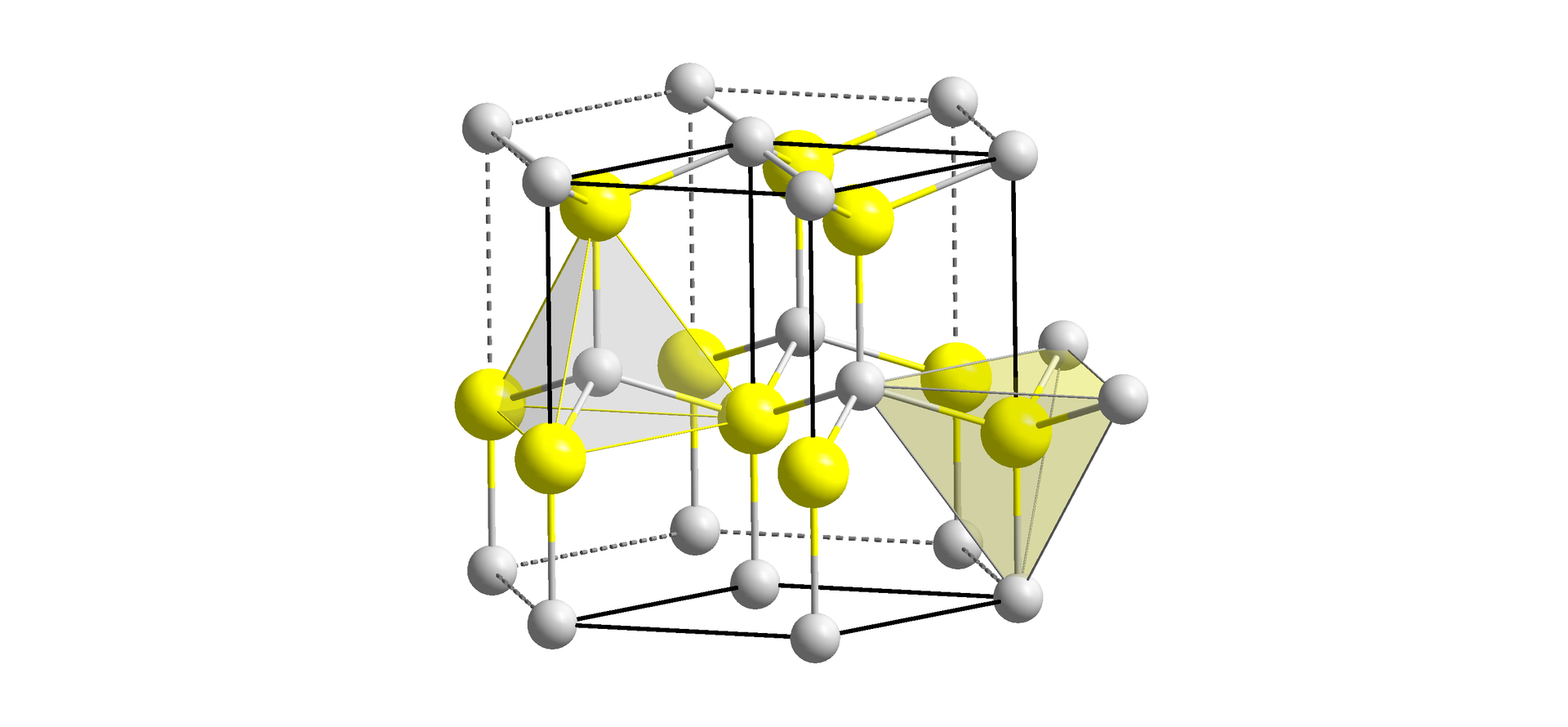
Związki wodoru z pierwiastkami bloku to wodorki metaliczne. Stanowią one czarne proszki, które przewodzą prąd, a ich właściwości są zbliżone do metalu macierzystego, który je tworzy. Składu chemicznego tych wodorków nie da się wyrazić prostymi wzoramiwzorami z indeksami w postaci liczb całkowitych (np. – wodorek palladu). Wynika to z ich budowy – otóż atomy wodoru zajmują w nich położenia międzywęzłowe w sieciach metalicznych, tworząc w ten sposób niestechiometryczne stopy metali z wodorem.
Trzeci i ostatni typ wodorków tworzony jest z pierwiastkami znajdującymi się w bloku , dokładniej grup od do oraz z borem (glin i gal tworzą spolimeryzowane wodorki kompleksowe). Są to związki, w których, pomiędzy tworzącymi je atomami, występuje wiązanie kowalencyjne bądź kowalencyjne spolaryzowane. Wodorki te są lotne i posiadające niskie temperatury topnienia. Biorąc pod uwagę tworzący je wraz z wodorem atom pierwiastka, ich trwałość maleje w dół grupy wraz ze wzrostem masy atomowej pierwiastków oraz w okresie wraz ze wzrostem ich charakteru metalicznego (w lewo). Przykładami tych związków są: amoniak, wodorki fluorowców, lekkie węglowodory (metan, etan) oraz benzen.

Nr grupy w układzie okresowym pierwiastków | |||||||
|---|---|---|---|---|---|---|---|
Wzór ogólny wodorku | oraz (dla i ) |
Jak klasyfikuje się wodorki pod względem ich reaktywności?
Wodorki mogą mieć charakter zasadowy, kwasowy lub obojętny. Charakter ten jest bezpośrednio związany z reaktywnością wodorków wobec wody, wodnych roztworów wodorotlenków i kwasów.
Wodorki zasadowe to wodorki typu soli ( i grupy układu okresowego pierwiastków oraz wodorki metali bloku ) oraz wodorek niemetalu, jakim jest amoniak – . W reakcji z wodą tworzą zasady. Reakcjom tym zazwyczaj towarzyszy gwałtowne wydzielanie wodoru.
Na przykład:
W reakcji z kwasami tworzą sole, np.:
Ciekawym przykładem wodorku jest , który nie tworzy pojedynczych cząsteczek lecz długie łańcuchy. Ze względu na to nie określa się jego charakteru chemicznego.
Wodorki kwasowe to wodorki niemetali bloku , których roztwory wodne to kwasy beztlenowe.
Na przykład:
Natomiast w reakcjach z wodnymi roztworami wodorotlenków tworzą sole, np.:
Wodorki obojętne nie reagują z wodą ani z wodnymi roztworami wodorotlenków i kwasów. Przykładami są: , , .
Zmiana charakteru chemicznego wybranych wodorków na tle układu okresowego
Wodorki to związki, których właściwości zmieniają się okresowo. W miarę wzrostu wartości elektroujemności pierwiastków chemicznych, charakter ich wiązań zmienia się od jonowego do kowalencyjnego (kowalencyjnego spolaryzowanego). Równolegle można zaobserwować zmianę charakteru tych związków od zasadowego przez obojętny aż do kwasowego (patrząc od lewej do prawej strony w układzie okresowym).
Wodorek | Reaktywność z wodą | Reaktywność ogółem | Właściwości redukujące |
|---|---|---|---|
tak (tworzy wodorotlenek) | reaguje z kwasami | tak | |
tak (tworzy wodorotlenek) | reaguje z kwasami | tak | |
brak | wykazuje silne właściwości redukujące | tak | |
brak | brak, ma charakter obojętny | brak | |
brak | wykazuje bardzo słabe właściwości zasadowe i silne właściwości redukujące | tak | |
ropuszcza się i bardzo słabo dysocjuje | reaguje z zasadami i ma charakter kwasowy | tak | |
ropuszcza się i dysocjuje | reaguje z zasadami i ma charakter kwasowy | brak |
Analizując charakter chemiczny wodorków w grupach, spostrzeżemy, że ze wzrostem masy atomowej pierwiastków niemetali wzrasta ich charakter kwasowy (w dół grupy), natomiast dla pierwiastków metali obserwuje się malejący charakter zasadowy (w dół grupy).
Słownik
ładunek jonu, w jaki przekształciłby się atom danego pierwiastka, gdyby wszystkie tworzone przez niego wiązania miały charakter jonowy
związki wodoru z innymi pierwiastkami; ze względu na skład, wodorki możemy podzielić na:
wodorki niemetali – związki, w których wodór występuje na stopniu utlenienia
wodorki metali – związki, w których wodór występuje na stopniu utlenienia
wzór chemiczny, który podaje symbole pierwiastków oraz liczbę ich atomów tworzących dany związek chemiczny, określa skład jakościowy i ilościowy związku chemicznego
pojęcie matematyczne, które oznacza powtarzające się w przestrzeni upakowanie drobin
Bibliografia
Atkins P., Jones L., Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa .
Bielański A., Podstawy Chemii nieorganicznej, t. i , Warszawa .
Encyklopedia PWN
Pac B., Zegar A., Podstawy klasyfikacji związków nieorganicznych w teorii i zadaniach, Kraków .