Przeczytaj
Wzór hydroksykwasów
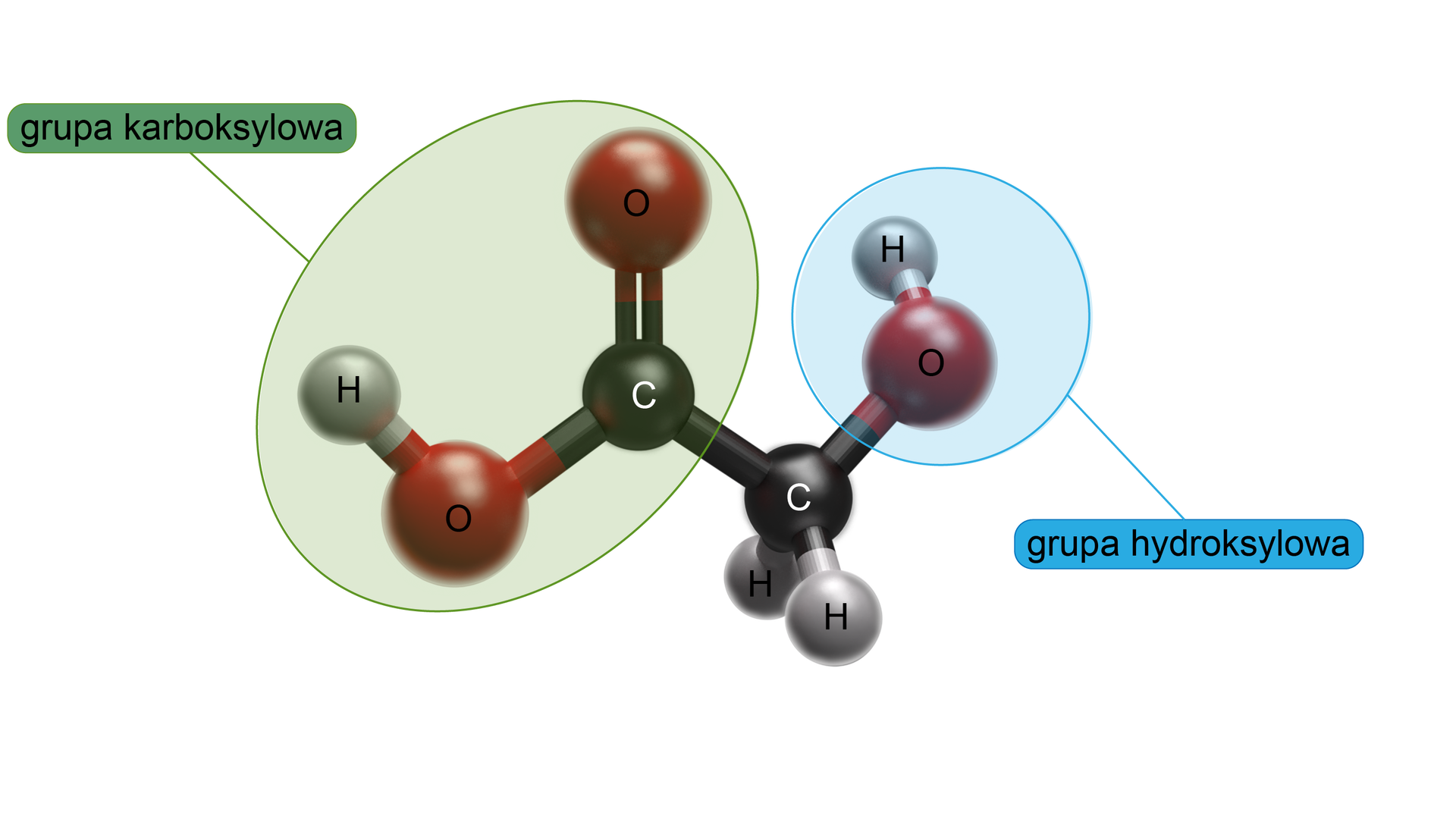
Istnieje wiele grup związków organicznych, zawierających więcej niż jedną grupę funkcyjną. Do takich związków należą hydroksykwasyhydroksykwasy. W swoich cząsteczkach zawierają dwie grupy funkcyjnegrupy funkcyjne: hydroksylową oraz karboksylową – po jednej lub po kilka.

Podział hydroksykwasów
Ze względu na ilość występujących grup funkcyjnych, hydroksykwasy możemy podzielić następująco:

Zaprojektuj model cząsteczki najprostszego hydroksykwasu – kwasu hydroksyoctowego. W skład modelu cząsteczki tego kwasu wchodzą dwa atomy węgla, trzy atomy tlenu oraz cztery atomy wodoru.
Zaprojektuj i narysuj w zeszycie model cząsteczki najprostszego hydroksykwasu – kwasu hydroksyoctowego. W skład modelu cząsteczki tego kwasu wchodzą dwa atomy węgla, trzy atomy tlenu oraz cztery atomy wodoru.
Dlaczego hydroksykwasy, a nie alkohole kwasowe?
Przy nazewnictwie węglowodorów zawierających kilka grup funkcyjnych, obowiązują pewne zasady, m.in. reguła pierwszeństwa grup funkcyjnych. Według niej grupa karboksylowa jest ważniejsza niż grupa hydroksylowa. Grupa karboksylowa jest dominująca i to ona warunkuje główne właściwości hydroksykwasów. Dlatego omawiane związki są kwasami, a nie alkoholami. Przedrostek „hydroksy” (oznaczający grupę hydroksylową) dodajemy do nazwy macierzystego kwasu karboksylowego.
Właściwości chemiczne hydroksykwasów
Grupy funkcyjne determinują właściwości zarówno chemiczne, jak i fizyczne związków organicznych. Przekonajmy się, jakim reakcjom ulegają hydroksykwasy ze względu na obecność grupy karboksylowej, a jakim ze względu na obecność grupy hydroksylowej.
Właściwości związane z obecnością grupy karboksylowej
Właściwości związane z obecnością grupy hydroksylowej
Dzięki obecności grupy hydroksylowej, moc alifatycznych hydroksykwasów jest większa w porównaniu do prostych kwasów karboksylowych o tej samej liczbie węgla.
Już w i wieku p.n.e. ludzie znali wiele sposobów na uśmierzenie bólu. Stosowali np. korę wierzby. Dopiero w r. niemiecki farmaceuta Johann Andreas Buchner (czyt. joan andreas buchne) odkrył jej substancję czynną, którą nazwano salicyną. Substancja ta wykazywała działania przeciwbólowe, przeciwgorączkowe oraz przeciwzapalne. W reakcji salicyny z wodą otrzymano alkohol salicylowy, który po utlenieniu przekształcił się w hydroksykwas – kwas salicylowy. Okazało się, że jest skuteczniejszy w działaniu niż salicyna. Niestety, w codziennym stosowaniu okazał się zbyt szkodliwy dla błony śluzowej żołądka.
Indeks dolny Źródło: https://zdrowieharmonia.pl/kora-wierzby-bialej-jako-naturalna-aspiryna Indeks dolny koniecŹródło: https://zdrowieharmonia.pl/kora-wierzby-bialej-jako-naturalna-aspiryna

Podsumowując, warto podkreślić, że hydroksykwasy są jednym z przykładów wielofunkcyjnych związków organicznych. Posiadają dwie grupy funkcyjne: karboksylową i hydroksylową. Grupą główną jest grupa karboksylowa. Stąd wynika ogólna nazwa dla tych związków. Jednak obie grupy determinują właściwości hydroksykwasów. Omawiane związki ulegają reakcjom typowym dla kwasów karboksylowych i dla alkoholi.
Słownik
związek organiczny zawierający dwie grupy funkcyjne: hydroksylową i karboksylową
(łac. functio „czynność”) atom lub grupa atomów w związkach organicznych, która decyduje o właściwościach danego związku oraz jego przynależności do danej klasy związków
reakcja, która polega na podstawieniu atomu wodoru związku organicznego grupą acetylową . Acetylacji ulegają związki zawierające grupy: hydroksylową, tiolową lub aminową. Najczęstszymi czynnikami acetylującymi są kwas octowy (etanowy), bezwodnik octowy lub chlorek acetylu (chlorek kwasu etanowego)
(gr. mono „pojedynczy”) związek posiadający jedną grupę hydroksylową
(gr. polỳs „liczny”, „duży”, „potężny”) związek posiadający więcej niż jedną grupę hydroksylową
(gr. mono „pojedynczy”) związek posiadający jedną grupę karboksylową
(gr. polỳs „liczny”, „duży”, „potężny”) związek posiadający więcej niż jedną grupę karboksylową
Bibliografia
Bobrański B., Chemia organiczna, Warszawa 1992.
Buczek I., Chrzanowski M., Dymara J., Persona A., Kowalik E., Kuśmierczyk K., Odrowąż E., Sobczak M., Sygniewicz J., Chemia. Rozszerzenie. Repetytorium matura, Warszawa 2014.
Danikiewicz W., Chemia. Związki organiczne. Podręcznik do liceów i techników. Zakres rozszerzony, Warszawa 2016.
Kalembkiewicz J., Lubczak J., Lubczak R., Nazwy związków chemicznych, Rzeszów 1998.
Lautenschläger K. H., Schröter W., Wanninger A., Nowoczesne kompendium chemii, Warszawa 2007.
Litwin M., Styka – Wlazło Sz., Szymońska J., To jest chemia 2. Chemia organiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2016.
McMurry J., Chemia organiczna 3, Warszawa 2003.