Przeczytaj
Substancje powierzchniowo czynne
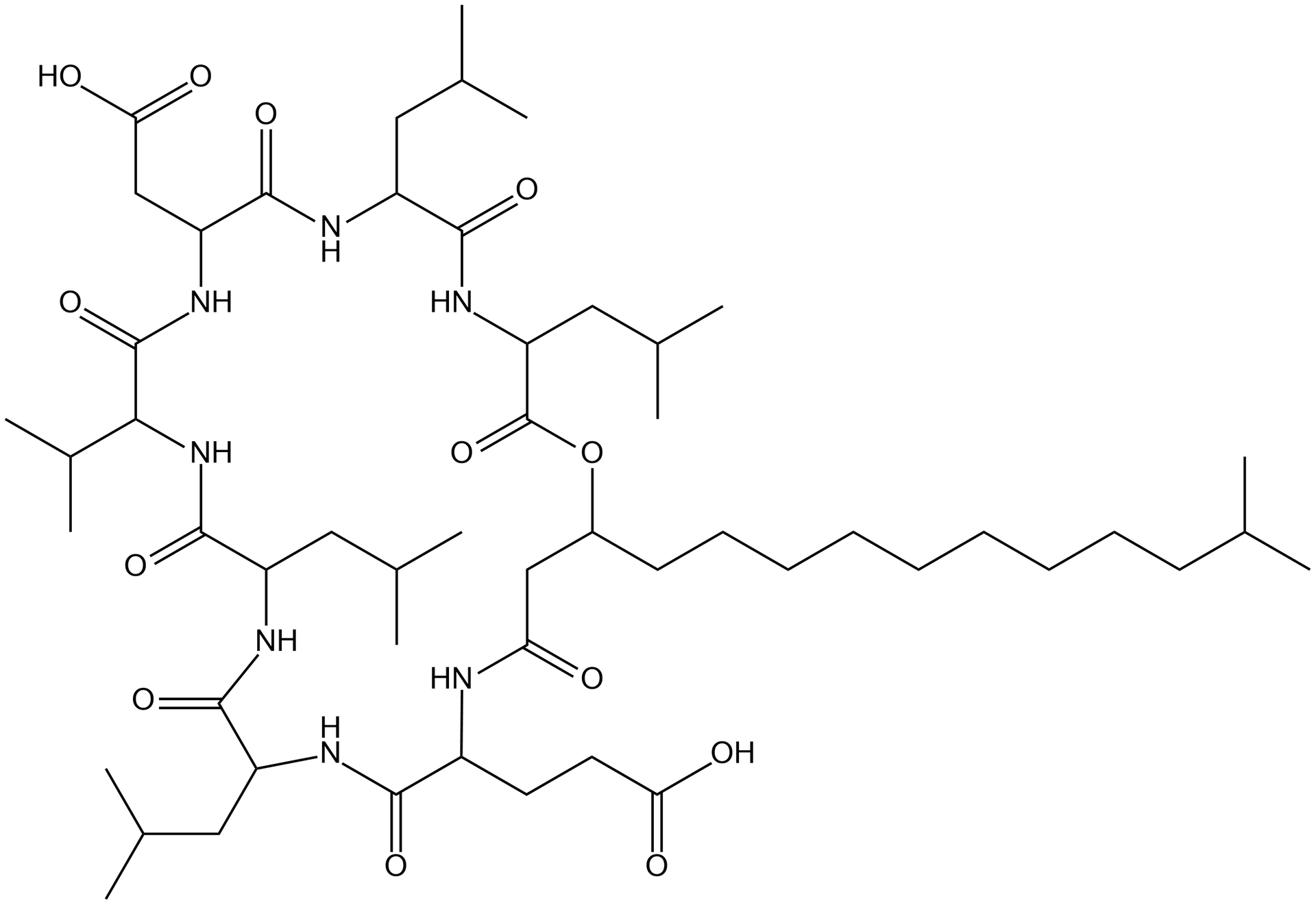
SurfaktantySurfaktanty to inaczej substancje powierzchniowo czynne amfifilowe, zbudowane z części hydrofilowej tzw. „głowy” i części hydrofobowej tzw. „ogonem”. Ze względu na swoją amfifilową (hydrofobowo‑hydrofilową) budowę mają zdolność do obniżania napięcia powierzchniowego na granicy faz układu cieczy, zmieniając tym samym jej energię swobodnąenergię swobodną.
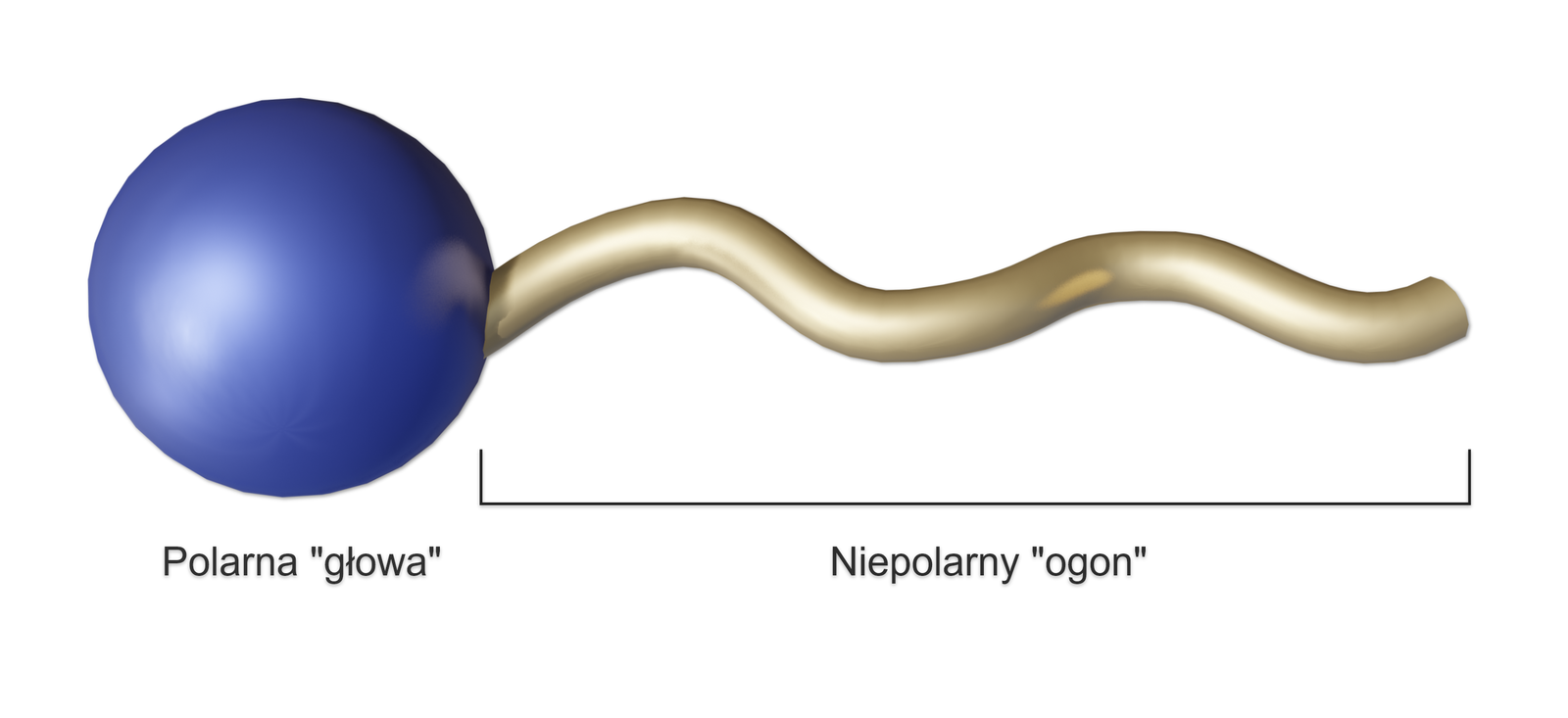
Polarna część hydrofilowa, zwana też lipofobową, charakteryzuje się powinowactwem do cieczy polarnych, dzięki czemu surfaktanty ulegają rozpuszczaniu w wodzie i w innych cieczach polarnych. Tę część surfaktantu stanowi zwykle reszta kwasowa (np. grupa karboksylowa , grupa sulfonowa , grupa fosforanowa ) lub zasadowa (np. pierwszorzędowa grupa aminowa – , drugorzędowa grupa aminowa , trzeciorzędowa grupa aminowa lub grupa pirydyniowa
).
Niepolarna część hydrofobowa, zwana też lipofilową, wykazuje powinowactwo do cieczy niepolarnych. Ta z kolei część surfaktantu ma charakter soli organicznej i może zawierać resztę zasadową lub resztę kwasową. Takie ugrupowanie to najczęściej prosty, długi alifatyczny łańcuch węglowodorowy w tym surfaktancie.
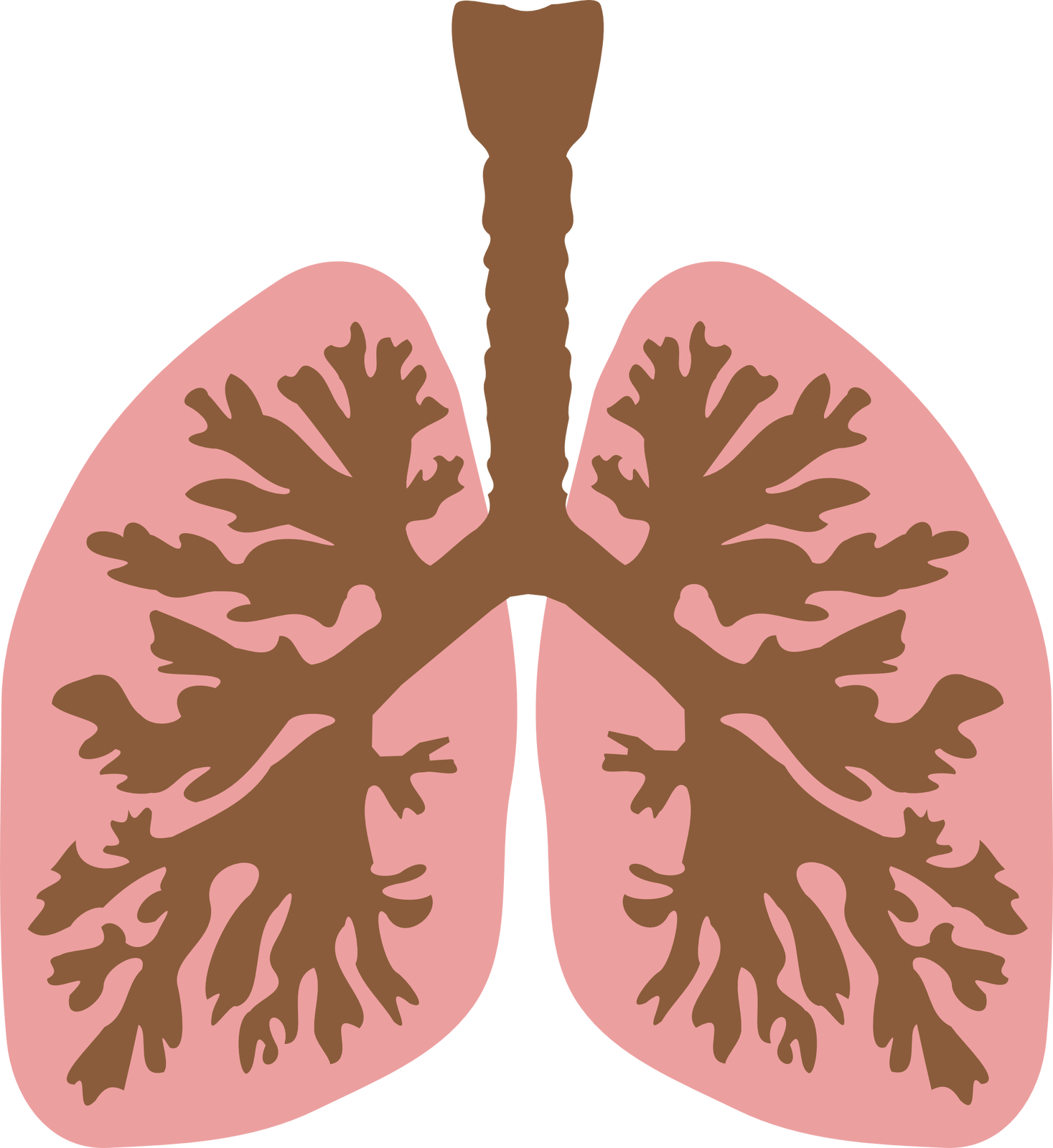
Naturalne surfaktanty możemy znaleźć w płucach jako związek powierzchniowy, który zmniejsza napięcie w pęcherzykach płucnych. Chroni je przed nadmiernym rozciąganiem oraz zapobiega zapadaniu i sklejaniu się ich ścianek w trakcie funkcji oddechowych. Surfaktanty składają się z cząsteczek lipoprotein, wydzielanych przez pneumocyty typu II.
Klasyfikacja surfaktantów
Substancje powierzchniowo czynne można klasyfikować na wiele różnych sposobów. Do najpopularniejszych kryteriów klasyfikacji zalicza się ich budowę, właściwości fizykochemiczne oraz funkcje użytkowe. Analizując budowę, wyróżniamy surfaktanty:
klasyczne – część hydrofilowa położona jest terminalnie na końcu hydrofobowego łańcucha;
bolaformowe – dwie części hydrofilowe są ulokowane terminalnie na końcach hydrofobowego łańcucha;
geminalne – dwie hydrofilowe części są rozdzielone grupą łączącą i posiadają długie łańcuchy hydrofobowe;
związki trimeryczne;
związki polimeryczne.
Istnieją również surfaktanty zwierające zwielokrotnioną liczbę części hydrofobowych i hydrofilowych. Najbardziej znanym podziałem surfaktantów jest klasyfikacja oparta o zdolność hydrofilowej „głowy” do dysocjacji w roztworach wodnych. Podział ten dzieli substancje powierzchniowo czynne na niejonowe oraz jonowe. Do jonowych należą surfaktanty: amfoteryczne, anionowe, kationowe i mezojonowe.
Funkcje użytkowe, dzięki którym surfaktanty znajdują zastosowanie, klasyfikujemy na:
emulgatory/antyemulgatory,
solubilizatory,
środki pieniące/środki antypieniące,
środki myjące, piorące, czyszczące,
środki zwilżające,
środki dyspergujące,
środki antyzbrylające.
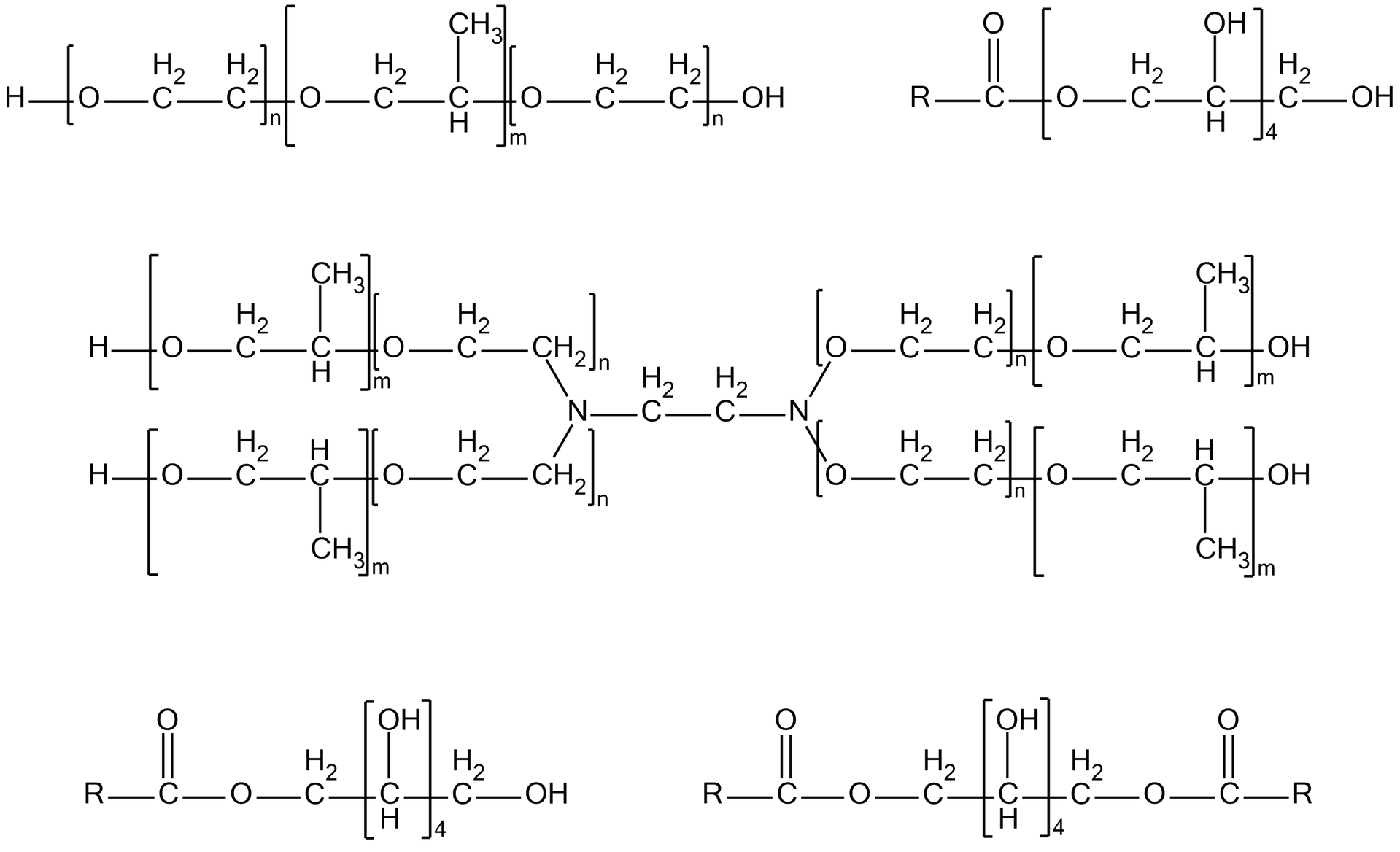
Surfaktanty niejonowe

Niejonowe surfaktanty posiadają niejonowe grupy hydrofilowe – „głowy” – połączone z łańcuchem hydrofobowym. Przykładami tych związków są monoestry, monoglicerydy, alkoholoamidy. Mogą się rozpuszczać w wodzie lub przeciwnie (wówczas rozpuszczają się w tłuszczach) lub mogą ulegać dyspersji.
Surfaktanty jonowe
Amfoteryczne surfaktanty wykazują budowę typową dla jonów obojnaczych, ich polarna „głowa” posiada zarówno ładunek dodatni, jak i ujemny. W zależności od pH roztworu, mogą występować w postaci anionu, kationu oraz jonu obojnaczego.

Przykładami tych związków są alkilobetainy i alkiloamidobetainy (posiadające grupę aminową i karboksylową), siarczanobetainy (zawierające grupę aminową i siarczanową) oraz sulfobetainy (zawierające grupę aminową i sulfonową). Surfaktanty oparte o alkilobetainy i alkiloamidobetainy posiadają właściwości deodorujące oraz bakteriobójcze.

Kationowe surfaktanty posiadają kationowe grupy hydrofilowe – „głowy” – połączone z grupą hydrofobową. Łańcuch hydrofobowy może ulegać rozgałęzieniom i zawierać m.in. pierścienie aromatyczne.
Są to m.in. sole amin, sole alkiloamoniowe oraz czwartorzędowe sole amoniowe zawierające układ heterocykliczny, np. pirydyniowe, imidazoliniowe.

Surfaktanty kationowe, oparte o czwartorzędowe sole amoniowe, mają szerokie zastosowanie aplikacyjne i są stosowane jako zagęstniki, emulgatory, dyspergatory, związki antystatyczne oraz biocydy.
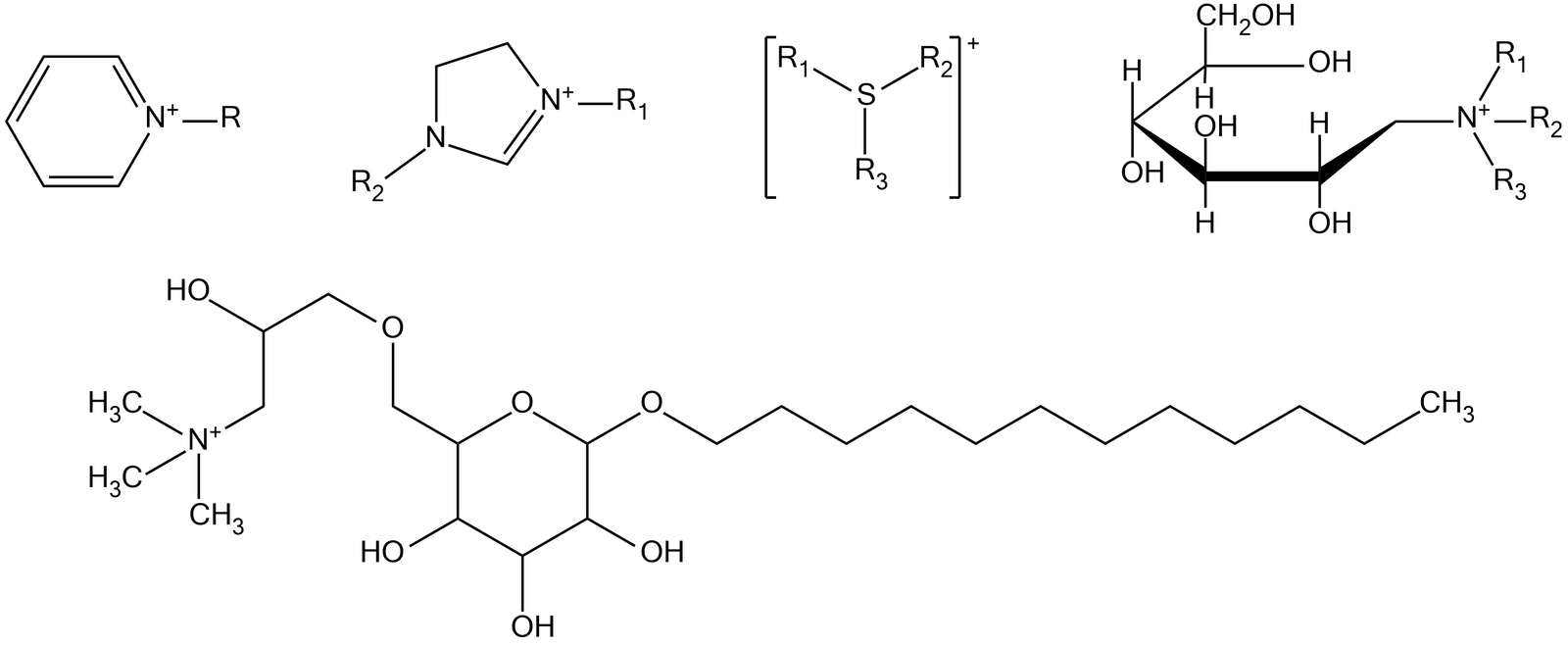
Anionowe surfaktanty posiadają anionowe grupy hydrofilowe – „głowy” – przyłączone do hydrofobowego łańcucha. Stanowią najliczniejszą grupę surfaktantów wród artykułów użytkowych, dlatego też wg klasyfikacji Hetzer’a występuje sześć podgrup.

Pierwszą podgrupę reprezentują związki o właściwościach zwilżających i pianotwórczych: alkilosiarczany, alkilosulfoniany, alkilonaftalenosulfoniany oraz pochodne niższych kwasów tłuszczowych. Druga podgrupa wykazuje dobre właściwości piorące i pianotwórcze – to pochodne wyższych kwasów tłuszczowych, alkenosulfoniany, alkilopolioksyetylenosiarczany oraz pochodne kondensacji aminokwasów z kwasami tłuszczowymi. Kolejna podgrupa zawiera alkanosulfoniany i sulfonowane estry nasyconych kwasów tłuszczowych, które posiadają dobre właściwości zwilżające. Czwartą podgrupę reprezentują związki o dobrych właściwościach dyspergujących i zwilżających. Należą do niej produkty sulfonowania kwasu oleinowego i olejów. Dwie ostatnie podgrupy to przykłady substancji powierzchniowo czynnych o dobrych właściwościach dyspergujących. Podgrupa piąta zawiera związki z dwiema grupami hydrofilowymi (w środku cząsteczki) i jednym długim łańcuchem hydrofobowym, a szósta reprezentowana jest przez surfaktanty, które zawierają trzy grupy hydrofilowe (dwie w środku cząsteczki) z pojedynczym hydrofobowym łańcuchem.

Mezojonowe surfaktanty to związki posiadające hydrofilową „głowę” o rezonansowym rozkładzie ładunku. Przykładami tej grupy związków są aminoimidy oraz pochodne alkilosydnonowe, które powstają w wyniku reakcji N‑alkiloglicyny z kwasem azotowym(III).


Surfaktanty początkowo produkowano wyłącznie z surowców petrochemicznych. Obecnie duży nacisk kładzie się na ochronę środowiska, więc czerpie się surowce do ich produkcji z oleochemikaliów, czyli węglowodorów i kwasów tłuszczowych pochodzenia roślinnego. Taka modernizacja produkcji może doprowadzić do redukcji emisji gazów cieplarnianych w procesie produkcyjnym o około 37% dla . Innymi przykładami ekologicznych surfaktantów są biosurfaktanty.
Indeks górny Żródło: V. Dornburg, I. Lewandowski and M. Patel, Comparing the Land Requirements, Energy Savings, and Greenhouse Gas Emissions Reduction of Biobased Polymers and Bioenergy J. Ind. Ecol., 2003, 7, 93. Indeks górny koniecŻródło: V. Dornburg, I. Lewandowski and M. Patel, Comparing the Land Requirements, Energy Savings, and Greenhouse Gas Emissions Reduction of Biobased Polymers and Bioenergy J. Ind. Ecol., 2003, 7, 93.
Biosurfaktanty
Biosurfaktanty to substancje powierzchniowo czynne produkowane w procesach biotechnologicznych z udziałem mikroorganizmów. Przykładami tych związków są glikolipidy, fosfolipidy, lipopeproteiny/lipopeptydy i związki polimerowe. Biosurfaktanty są na ogół biodegradowalne, charakteryzuje je niska toksyczność w stosunku do syntetycznych tenzydów. Niektóre z nich są aktywne w warunkach ekstremalnych (100°C, zasolone roztwory).
Właściwości fizykochemiczne surfaktantów
Aplikacyjna atrakcyjność surfaktantów jest związana z ich rozpuszczalnością. Ze względu na swoją specyficzną budowę wykorzystuje się je często w układach dwufazowych (woda:rozpuszczalnik organiczny). W zależności od stężenia wodnych roztworów tenzydów, cząsteczki tych związków mogą występować w postaci monomerycznej, tworzyć na powierzchni roztworu warstwę lub tworzyć układy micelarnemicelarne. W warstwie powierzchniowej hydrofilowe „głowy” zwrócone są w stronę polarnego roztworu, natomiast hydrofobowe „ogony” w kierunku przeciwnym. Równowagę pomiędzy postaciami monomerycznymi a zagregowanymi określa krytyczne stężenie micelarne (CMC)krytyczne stężenie micelarne (CMC). Jest to minimalne stężenie surfaktantu, przy którym obie te formy istnieją w roztworze.

Słownik
(ang. Surface Active Agent) inaczej tenzydy, substancje powierzchniowo czynne (ZPC) - związki amfifilowe, których cząsteczki zbudowane są z części hydrofobowej (o małym powinowactwie do wody) oraz części hydrofilowej (o dużym powinowactwie do wody), dzięki czemu charakteryzują się zdolnościami obniżającymi napięcie powierzchniowe na granicy faz danego układu cieczy
wartość stężenia surfaktantu w roztworze, powyżej którego znajduje się on w formie zagregowanej, poniżej zaś w postaci pojedynczych cząsteczek
(łac. mica „okruszyna”) ułożony na kształt kuli zespół cząsteczek związku powierzchniowo czynnego (surfaktantu) lub jonów w roztworze. Posiadają działanie solubilizujące, które umożliwia substancji nierozpuszczalnej w wodzie wprowadzenie do fazy wodnej
jest potencjałem termodynamicznym w procesach przebiegających bez zmiany temperatury i objętości; w procesach odwracalnych zachodzących w stałej temperaturze (izotermicznych) zmiana energii swobodnej jest równa pracy wykonanej nad układem
służy najczęściej do opisu cząsteczek, które mają sprzężone wiązania pi‑elektronowe, np. cząsteczek związków aromatycznych, polialkenów o sprzężonych wiązaniach, oraz niektórych grup funkcyjnych (np. karboksylowa). Cząsteczki takich związków i ich właściwości fizykochemiczne opisuje się tzw. strukturą mezomeryczną, w której występują wiązania o niecałkowitej krotności, lecz wzajemnie równoważne; struktura mezomeryczna jest strukturą wypadkową (pośrednią) wielu możliwych struktur granicznych cząsteczki danego związku, np. w anionie karboksylanowym ładunek ujemny jest zlokalizowany równomiernie na obydwu atomach tlenu połączonych z węglem wiązaniami o identycznej długości
Bibliografia
Encyklopedia PWN
Encyklopedia Zdrowia
Dornburg V., Lewandowski I., Patel M., Comparing the Land Requirements, Energy Savings and Greenhouse Gas Emissions Reduction of Biobased Polymers and Bioenergy, J. Ind. Ecol. 2003, 7, s. 93‑116.
Foley P., Kermanshahi A., Beach E. S., Zimmerman J. B., Derivation and synthesis of renewable surfactants, Chem. Soc. Rev. 2012, 41, s. 1499‑1518.
Hill K., Fats and oils as oleochemical raw materials, Pure Appl. Chem. 2000, 72, 7, s. 1255.
Zieliński R., Surfaktanty: budowa, właściwości, zastosowania, Poznań 2013, wyd. 2.