Przeczytaj
Czy rozdrobnienie substratów ma wpływ na szybkość reakcji chemicznej?
Chemicy, chcąc otrzymać produkt do dalszego użytku, muszą taką reakcję chemiczną zaplanować. Aby proces był korzystny, musi zachodzić w odpowiednim tempie. Gdyby wytwarzanie płynu czyszczącego czy płynu hamulcowego trwało ponad rok, nie byłoby to w ogóle opłacalne. Podobnie byłoby w sytuacji, gdyby produkcja zachodziła zbyt szybko – mogłoby to grozić wybuchem. Dlatego m.in. laboranci wolą kontrolować szybkość reakcji chemicznychszybkość reakcji chemicznych. W niektórych przypadkach można przyspieszyć reakcje, które są zbyt wolne, lub spowolnić, kiedy są one zbyt szybkie. Chcąc uzyskać kontrolę nad szybkością reakcji chemicznej, należy znać czynniki na nią wpływające.
Do takich czynników, wpływających na szybkość reakcji chemicznych, zaliczamy:
temperaturę;
stężenie reagentów;
ciśnienie (dla reakcji, w których występuje faza gazowa);
rozdrobnienie substratówsubstratów;
katalizatory.
- Nazwa kategorii: Czynniki wpływające na szybkość[br]reakcji chemicznych
- Nazwa kategorii: temperatura
- Nazwa kategorii: stężenie[br]reagentów
- Nazwa kategorii: ciśnienie[br](dla reakcji,[br]w których[br]występuje[br]faza gazowa)
- Nazwa kategorii: rozdrobnienie[br]substratów
- Nazwa kategorii: katalizatory Koniec elementów należących do kategorii Czynniki wpływające na szybkość[br]reakcji chemicznych
- Elementy należące do kategorii Czynniki wpływające na szybkość[br]reakcji chemicznych
Silniki samochodowe wykorzystują efekty powierzchniowe do zwiększenia szybkości reakcji. Do każdego cylindra wtryskiwana jest benzyna, która pali się podczas zapłonu przez iskrę ze świecy zapłonowej. Wtryskuje się ją w postaci mikroskopijnych kropelek, ponieważ ma wtedy znacznie większą powierzchnię i może spalać się o wiele szybciej, niż gdyby była podawana do cylindra jako strumień cieczy. Ten przykład pokazuje, że rozdrobnienie substratów wpływa na szybkość reakcji chemicznej, co jest wykorzystywane nie tylko w chemii, ale również w życiu codziennym.

Rozdrobnienie substratów a szybkość reakcji chemicznej
Duży wpływ na szybkość reakcji ma stopień rozdrobnienia substratów. Wynika to faktu, że reakcja chemiczna może zachodzić tylko w miejscu, w którym reagujące substancje stykają się ze sobą, np. na powierzchni metalu zanurzonego w roztworze. Im powierzchnia styku jest większa, tym szybkość reakcji chemicznej wzrasta. Dlatego rozdrobnienie substratu wpływa na zwiększenie jego powierzchni, z kolei zwiększenie powierzchni, gdzie może zachodzić reakcja, powoduje zwiększenie szybkości reakcji.
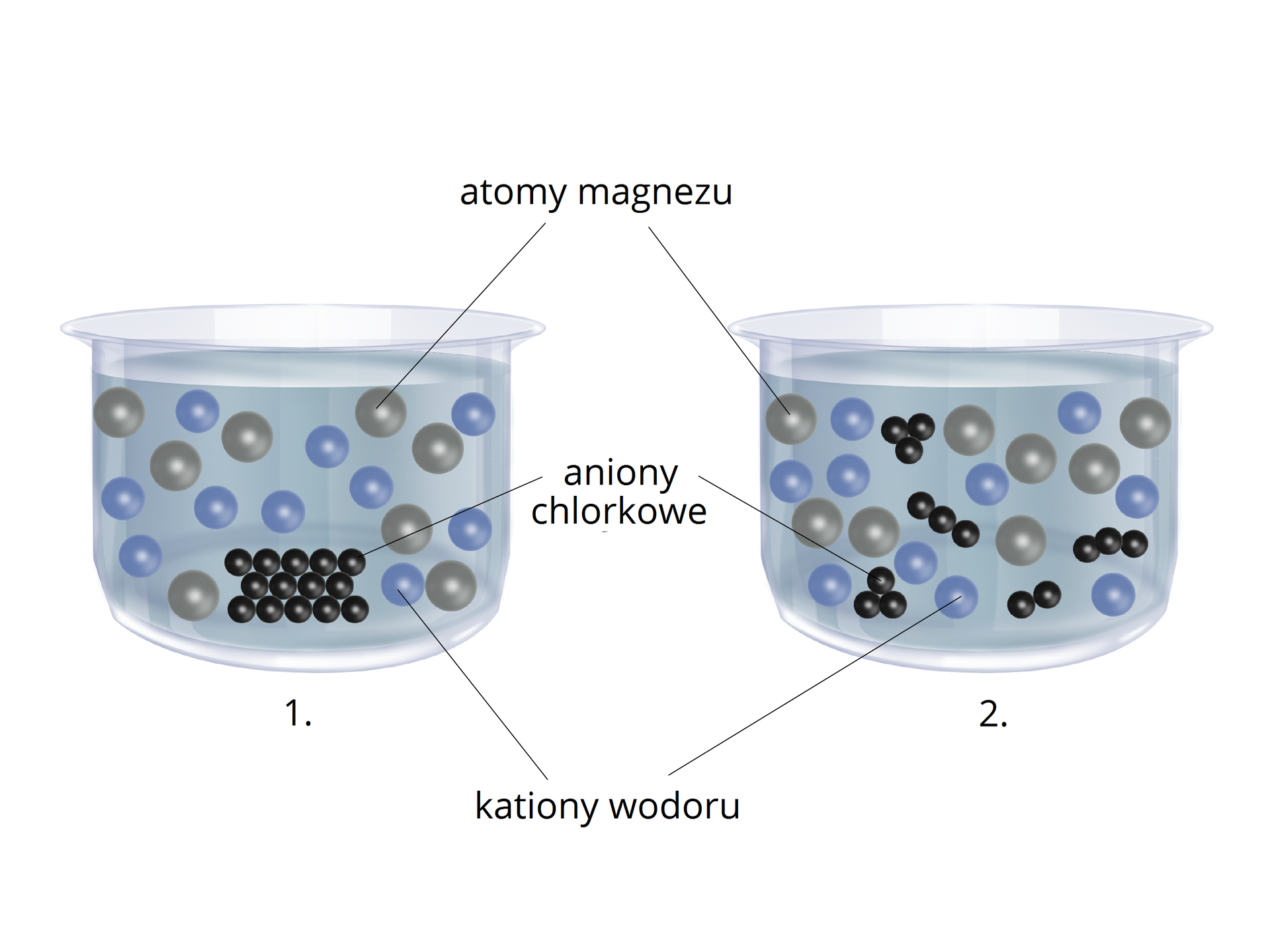
Na przykład, jeśli dodamy kawałek metalu do zlewki z kwasem, kwas początkowo będzie oddziaływać na zewnętrzną część metalu. Wewnętrzna część zacznie reagować dopiero, gdy zewnętrzna się roztworzy. Z drugiej strony, jednakowa ilość proszku metalicznego reaguje szybciej w kwasie, ponieważ jego postać posiada większą powierzchnię aktywną. Tym samym wzrasta możliwość zderzeń aktywnychzderzeń aktywnych. Kwas roztwarza więc proszek metaliczny równomiernie.
Oblicz powierzchnię sześcianu o boku . Teraz wyobraź sobie, że tę kostkę przekrojono na pół. Oblicz, jakie jest teraz pole powierzchni obu figur. Następnie, tak powstałe figury, znowu przekrojono na pół. Jakie jest teraz pole powierzchni wszystkich figur? Jak zmienia się pole powierzchni figur przy rozdrabnianiu substancji?
Badanie wpływu stopnia rozdrobnienia substratu na szybkość reakcji
Doświadczenie
Badanie wpływu rozdrobnienia substratów na szybkość reakcji chemicznej.
Przeprowadzano doświadczenie, w którym zbadano wpływ stopnia rozdrobnienia cynku na szybkość reakcji z kwasem solnym. Do dwóch probówek dodano roztwory kwasu solnego o tym samym stężeniu i tej samej objętości. Do probówki A dodano pył cynkowy, a do probówki B granulki cynku. Jak myślisz, w której probówce reakcja zajdzie szybciej?

W poniższym arkuszu uzupełnij obserwacje, wnioski oraz ich wyjaśnienie.
Wpływ rozdrobnienia substratów na szybkość reakcji chemicznej.
Powierzchnia kontaktu reagujących substratów kluczem do zwiększenia szybkości reakcji chemicznej
Rozdrobnienie substratów ma wpływ na szybkość reakcji. Im bardziej rozdrobnione ciało stałe, większa powierzchnia styku, tym więcej indywiduów zderza sięzderza się ze sobą i wzrasta szybkość reakcji chemicznej. Aby więc przyspieszyć reakcję chemiczną, należy zwiększyć powierzchnię kontaktu reagujących substratów, czyli je rozdrobnić. Czasami, jak w przypadku mąki, jest to niekorzystne zjawisko. W zakładach, gdzie używa się dużych ilości mąki pszennej, zabronione jest używanie otwartego ognia, a maszyny, które pracują w tych pomieszczeniach, muszą mieć dokładnie nasmarowane wszystkie elementy, gdzie następuje tarcie. W przeciwnym wypadku może dojść do wytworzenia iskry, a rozpylona w powietrzu mąka może spowodować wybuch. Podobnie zachowuje się żelazo w postaci nanoproszku – w połączeniu z powietrzem może dojść do wybuchu, co również jest spowodowane rozdrobnieniem i dużą powierzchnią tych substancji.
Słownik
zmiana stężenia reagentów (substratów lub produktów) w jednostce czasu
minimalna ilość energii, którą muszą mieć indywidua chemiczne, aby mogła zajść między nimi reakcja chemiczna
teoria chemii fizycznej, która zakłada, że reakcje chemiczne zachodzą na skutek zderzeń reagujących ze sobą cząsteczek
takie zderzenie cząsteczek substratów, które może doprowadzić do rozerwania wiązań bądź tworzenia nowych wiązań chemicznych
substancja wyjściowa biorąca udział w reakcji chemicznej
Bibliografia
Atkins P., Jones J., Chemical Principles: The Quest for Insight, 5th Edition, New York 2009.
Penkala T., Podstawy Chemii Ogólnej, Warszawa 1982.
Encyklopedia PWN