Przeczytaj
Budowa
HydroksykwasyHydroksykwasy to doskonały przykład organicznych związków wielofunkcyjnych. Posiadają one dwie grupy funkcyjne: karboksylową i hydroksylową – po jednej lub po kilka. Dlatego mogą ulegać reakcjom charakterystycznym zarówno dla kwasów karboksylowych, jak i alkoholi. Grupą dominującą jest grupa karboksylowa, ponieważ to ona warunkuje właściwości chemiczne hydroksykwasów. Niektóre hydroksykwasy to związki optycznie czynnezwiązki optycznie czynne, czyli zdolne do skręcania płaszczyzny światła spolaryzowanego. Warto przypomnieć, że czynność optyczna jest konsekwencją budowy cząsteczki związku chemicznego. Dokładniej mówiąc, izomeria optycznaizomeria optyczna związków chemicznych jest powiązana z różnym rozmieszczeniem przestrzennym atomów wokół asymetrycznegoasymetrycznego (chiralnego) atomu węgla. Zatem przyjrzyjmy się chiralnościchiralności hydroksykwasów.
Kwas hydroksyetanowy
Kwas hydroksyoctowy, inaczej kwas glikolowy, to najprostszy hydroksykwas.

Przyglądając się wzorowi półstrukturalnemu kwasu glikolowego, zauważymy, że jego cząsteczka nie zawiera asymetrycznego atomu węgla. Wobec tego, związek ten jest achiralny i nie występuje w postaci izomerów optycznych.
Kwas 2‑hydroksypropanowy
Z kolei kwas 2‑hydroksypropanowy, zwyczajowo nazywany kwasem mlekowym, posiada asymetryczny atom węgla. Stąd związek ten jest chiralny i wykazuje czynność optyczną.

Kwas mlekowy występuje w postaci izomerów optycznych, czyli enancjomerówenancjomerów, które nie są identyczne, ponieważ ich odbicia lustrzane nie nakładają się na siebie. Eksperymentalnie udowodniono, że izomer o wzorze nr 1 skręca płaszczyznę polaryzacji światła o około 4° w prawo, dlatego przyjmuje następujące oznaczenie (+). Z kolei izomer nr 2 skręca płaszczyznę polaryzacji światła o ten sam kąt, tylko że w lewo, dlatego oznaczamy go następująco (-).
Poniżej przedstawiono enancjomery kwasu mlekowego za pomocą wzorów stereochemicznychwzorów stereochemicznych (perspektywicznych).

Izomery optyczne omawianego hydroksykwasu, możemy również przedstawić za pomocą wzorów projekcyjnych Fischera. Enancjomer, który ma grupę hydroksylową po prawej stronie we wzorze projekcyjnym, oznaczamy literą D. Natomiast enancjomer, posiadający grupę hydroksylową po lewej stronie we wzorze projekcyjnym, oznaczamy literą L.
Warto przypomnieć, że konfiguracja D i L jest konfiguracją względną, wyznaczaną względem konfiguracji wzorca (aldehydu glicerynowego). Nie jest powiązana z żadną doświadczalnie zbadaną skręcalnością światła spolaryzowanego odpowiedniego związku.

lub
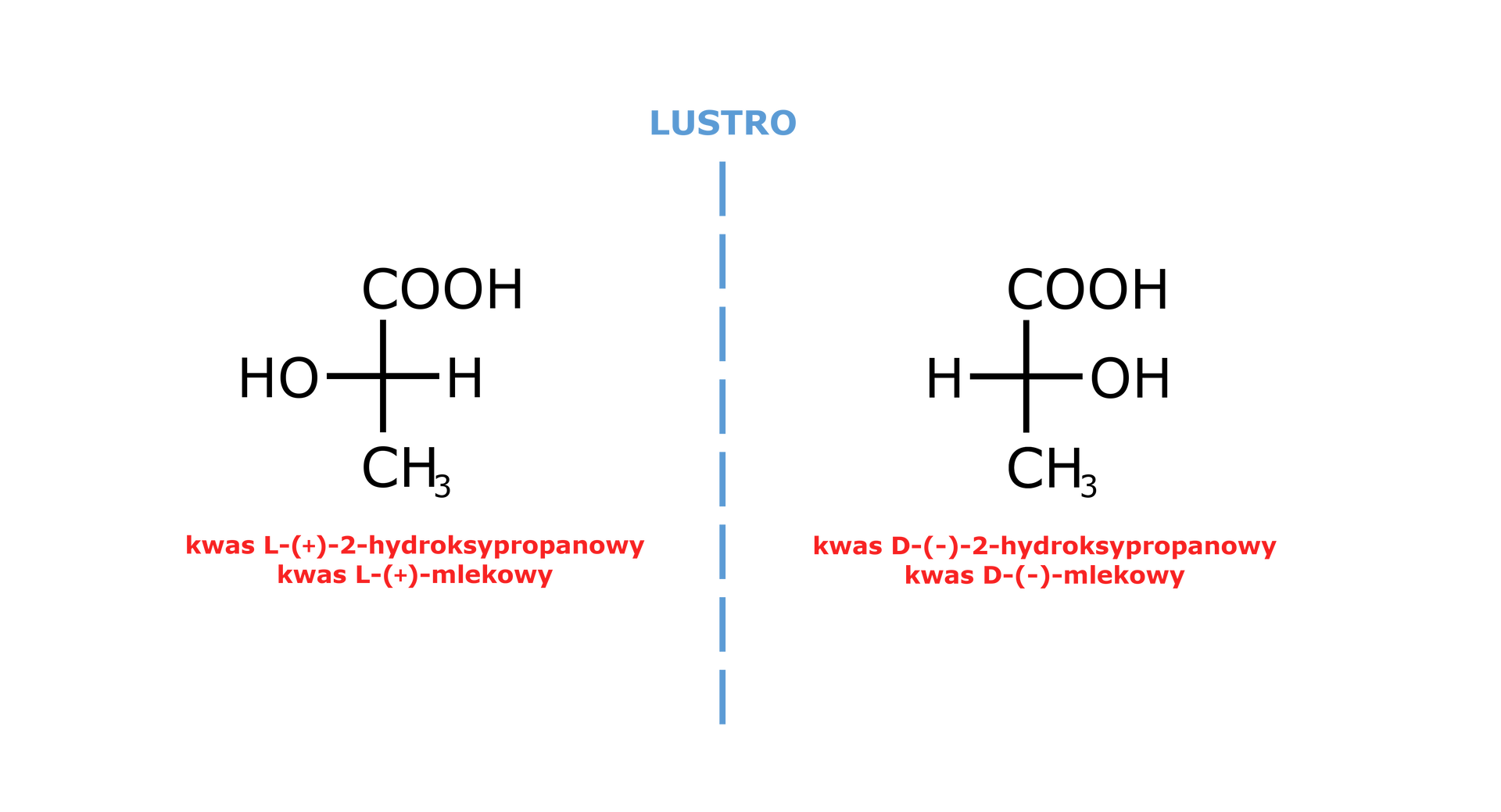
Wzory projekcyjne enancjomerów kwasu mlekowego. Wzór kwasu mlekowego o konfiguracji D, skręca płaszczyznę polaryzacji światła w lewo. Z kolei wzór kwasu mlekowego o konfiguracji L, skręca płaszczyznę polaryzacji światła w prawo.
Oba izomery optyczne kwasu mlekowego pełnią różną rolę w organizmach żywych. Kwas prawoskrętny (kwas L-(+)-mlekowy) powstaje w mięśniach podczas intensywnego wysiłku fizycznego. Z kolei kwas lewoskrętny (kwas D-(-)-mlekowy) powstaje w wyniku fermentacji mlekowej. Fermentacja mlekowa zachodzi podczas kiszenia warzyw, m.in. ogórków, kapusty czy buraków, a także w trakcie produkcji m.in. jogurtów. Warto zaznaczyć, że kwas mlekowy, otrzymany syntetycznie, jest racematemracematem (kwas mlekowy (±)).
Człowiek wciąż nie potrafi zsyntetyzować tylko jednego enancjomeru. Natomiast potrafi rozdzielić racemat, wykorzystując czysty enancjomer. Wciąż organizmy żywe są jedynym pierwotnym źródłem izomerów optycznych.
Kwas 2‑hydroksybenzoesowy
Przyjrzyjmy się przedstawicielowi hydroksykwasów aromatycznych – kwasowi 2‑hydroksybenzoesowy, zwyczajowo nazywanego kwasem salicylowym.

Analizując wzór półstrukturalny kwasu salicylowego, możemy zauważyć, że jego cząsteczka nie zawiera asymetrycznych atomów węgla, dlatego jest achiralna. Dodatkowo cząsteczka posiada płaszczyznę symetrii, którą stanowi pierścień aromatyczny. Wobec tego, kwas salicylowy nie posiada izomerów optycznych.
Zastosowanie hydroksykwasów
Przemysł farmaceutyczny i medyczny
Kwas salicylowy (kwas 2-hydroksybenzenokarboksylowy, C7H6O3) wykazuje działanie bakteriobójcze. Popularnym środkiem odkażającym jest spirytus salicylowy. Jest to 2-procentowy etanolowo-wodny roztwór kwasu salicylowego.
Kwas salicylowy jest również składnikiem leków przeciwtrądzikowych. Jednak to pochodne kwasu salicylowego znajdują większe zastosowanie.

Licencja: CC 0.

Autor: Adam Rędzikowski. Licencja: CC BY SA 3.0.

Licencja: Contentplus.pl
Innym przykładem jest kwas p-aminosalicylowy (PAS) – lek przeciwgruźliczy. Obecnie stosowany jako lek drugiego wyboru, ze względu na liczne skutki uboczne.
Spirytus salicylowy można wykorzystać jako atrament sympatyczny. Tekst zapisany takim atramentem, ukazuje się po użyciu odpowiedniego czynnika. W przypadku spirytusu salicylowego, stosuje się roztwór chlorku żelaza(III) (FeCl3). Przy wywołaniu napisu zachodzi reakcja chemiczna pomiędzy kwasem salicylowym a solą żelaza, której efektem jest ciemnofioletowe zabarwienie napisu.
Kwas migdałowy (kwas 2-fenylo-2-hydroksyetanowy, C8H8O3) jest stosowany jako lek antyseptyczny oraz odkażający drogi moczowe. Wodny roztwór kwasu cytrynowego (2-hydroksypropano-1,2,3-trikarboksylowy, C6H8O7) o stężeniu 3-5% działa przeciwwymiotnie.

Licencja: CC 2.0.
Stosowany także jako środek pobudzający apetyt w przypadku bezsoczności żołądka. Sole magnezowe kwasu cytrynowego wykorzystuje się w suplementacji. Ponadto, kwas cytrynowy to popularny regulator kwasowości. Z kolei kwas winowy (kwas 2,3-dihydroksybutanodiowy, C4H6O6) w mniejszych dawkach wykazuje działanie przeciwbiegunkowe, a w większych przeczyszczające. Kwas winowy pobudza procesy regeneracji nabłonka przewodu pokarmowego oraz zapobiega niestrawności.
Do wypalania brodawek używa się mieszaniny kwasu mlekowego i salicylowego. Hydroksykwasy są również wykorzystywane w recepturze aptecznej.
Przemysł spożywczy
Kwas mlekowy (kwas 2-hydroksypropanowy, C3H6O3) wykorzystywany jako konserwant (E270), zapobiega rozwojowi grzybów w produktach spożywczych. Stosuje się go w produkcji przetworów kwaszonych (ogórki czy kapusta) oraz produktów mlecznych, m.in. jogurtów. W przemyśle cukierniczym stosowany jako regulator kwasowości.

Licencja: CC 0.
Kwas cytrynowy i winowy są wykorzystywane w produkcji serów topionych. Kwas jabłkowy (kwas 2-hydroksybutanodiowy, C4H6O5) znalazł zastosowanie jako konserwant (E296) np. w produkcji soków owocowych.
Przemysł kosmetyczny
Hydroksykwasy, a w szczególności α-hydroksykwasy, regulują procesy złuszczania naskórka. Wpływają na regenerację, nawilżenie oraz spowolnienie procesów starzenia skóry. Rozjaśniają ją i poprawiają jej koloryt. Kwas winowy i migdałowy hamują wydzielanie łojotoku. Hydroksykwasy są wykorzystywane w preparatach przeznaczonych m.in. do walki z trądzikiem, zmarszczkami czy przebarwieniami. Stosowane w postaci kremów, maseczek, peelingów.
Inne
Kwas galusowy (kwas 3,4,5-trihydroksybenzoesowy, C7H6O5) jest wykorzystywany do wyrobu barwników i atramentów. Kwas glikolowy i mlekowy w przemyśle garbarskim i tekstylnym, a hydroksykwasy w przemyśle chemicznym do syntez organicznych.
Słownik
związek organiczny zawierający dwie grupy funkcyjne: hydroksylową i karboksylową
(czyt. alfa‑hydroksykwasy; skrót AHA) – związek organiczny zawierający dwie grupy funkcyjne: hydroksylową i karboksylową; jego charakterystyczną cechą jest położenie grupy hydroksylowej w pozycji alfa (alfa) w stosunku do grupy karboksylowej, co oznacza że grupa hydroksylowa jest przyłączona do drugiego atomu węgla (tzw. atomu alfa - alfa); związek ten często jest określany jako kwas owocowy
związek chemiczny, występujący w postaci nieidentycznych izomerów przestrzennych, które są swoimi odbiciami lustrzanymi; izomery te skręcają płaszczyznę polaryzacji światła o taki sam kąt, lecz w przeciwnych kierunkach (prawo, lewo)
zjawisko występowania związku chemicznego w postaci dwóch nieidentycznych izomerów przestrzennych (optycznych), które są swoimi odbiciami lustrzanymi i skręcają płaszczyznę polaryzacji światła o taki sam kąt, lecz w przeciwnych kierunkach (prawo, lewo); warunkiem izomerii optycznej jest występowanie chiralnego atomu węgla w związku chemicznym
(gr. asymmetria „niewspółmierność”) atom węgla połączony z czterema różnymi podstawnikami w cząsteczce
fakt występowania przedmiotu, który nie jest identyczny ze swoim odbiciem lustrzanym, np. dłonie ludzkie. Przedmiot taki jest określany jako chiralny
cecha przedmiotu/związku chemicznego, który jest identyczny ze swoim odbiciem lustrzanym
(gr. cheir „ręka”) cecha przedmiotu/związku chemicznego, który jest nieidentyczny ze swoim odbiciem lustrzanym
(gr. enantio „przeciwny”) izomery optyczne danego związku chemicznego, które są chiralne i różnią się rozmieszczeniem atomów w przestrzeni; enancjomery skręcają płaszczyznę światła spolaryzowanego o pewien kąt, lecz w przeciwnych kierunkach
wzór przestrzenny cząsteczki, w którym obowiązują następujące zasady:
wiązanie, znajdujące się w płaszczyźnie rysunku, rysujemy linią ciągłą o normalnej grubości;
wiązanie skierowane za płaszczyznę rysunku rysujemy linią przerywaną;
wiązanie skierowane przed płaszczyznę rysunku rysujemy klinem - jego ostrze jest wymierzone w kierunku asymetrycznego atomu węgla
pokazuje cząsteczkę jako prostokątny rzut na płaszczyznę rysunku; we wzorze rzutowym, w punkcie przecięcia linii pod kątem prostym znajdują się asymetryczne atomy węgla; linie poziome pokazują wiązania znajdujące się przed płaszczyzną kartki; linie pionowe pokazują wiązania znajdujące się za płaszczyzną kartki; w linii poziomej rysujemy podstawniki, a w pionowej główny łańcuch węglowy
(łac. achylia „bezkwas”) brak wydzielania soku żołądkowego
równomolowa mieszanina enancjomerów. Mieszanina racemiczna nie skręca płaszczyzny polaryzacji światła
Bibliografia
Bobrański B., Chemia organiczna, Warszawa 1992.
Buczek I., Chrzanowski M., Dymara J., Persona A., Kowalik E., Kuśmierczyk K., Odrowąż E., Sobczak M., Sygniewicz J., Chemia. Rozszerzenie. Repetytorium matura, Warszawa 2014.
Danikiewicz W., Chemia. Związki organiczne. Podręcznik do liceów i techników. Zakres rozszerzony, Warszawa 2016.
Grynkiewicz G., Hennig J., Związki naturalne w farmacji i medycynie. Kwas salicylowy i fenolokwasy, „Standardy medyczne/ Pediatria” 2010, 7, s. 10‑16.
Hassa R., Mrzigod A., Mrzigod J., To jest chemia. Podręcznik dla szkół ponadgimnazjalnych. Zakres podstawowy, Warszawa 2016.
Hassa R., Mrzigod J., Nowakowski J., Podręczny słownik chemiczny, Katowice 2004.
Jachowicz R., Receptura apteczna. Podręcznik dla studentów farmacji, Warszawa 2008.
Jastrząb R., Zabiszak M., Nowak M., Kwasy owocowe (alfa‑hydroksykwasy) i ich związki kopleksowe, [w:] Na pograniczu chemii i biologii, t. 33, Poznań 2014.
Lautenschläger K. H., Schröter W., Wanninger A., Nowoczesne kompendium chemii, Warszawa 2007.
Litwin M., Styka–Wlazło Sz., Szymońska J., To jest chemia 2. Chemia organiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2016.
Malinka W., Zarys chemii kosmetycznej, Wrocław 1999.
Marzec A., Chemia kosmetyków. Surowce. Półprodukty. Preparatyka wyrobów, Toruń 2005.
Marzec A., Chemia nowoczesnych kosmetyków. Substancje aktywne w nowoczesnych preparatach i zabiegach kosmetycznych, Toruń 2010.
Rajtar‑Cynke G., Farmakologia. Podręcznik dla Studentów i Absolwentów Wydziałów Pielęgniarstwa i Nauk o Zdrowiu Akademii Medycznych, Lublin 2007.