Przeczytaj
W chemii wyróżniamy m.in. reakcje szybkie i powolne. Na szybkość reakcji może mieć wpływ wiele czynników, takich jak: rozdrobnienie substancji, stężenie substratów, temperatura(środowiska reakcji), mieszanie, rozpuszczalnik, ciśnienie (w przypadku, jeżeli reagenty są gazami), promieniowanie elektromagnetyczne (w przypadku reakcji fotochemicznych), katalizatorkatalizator. Ten ostatni jest substancją, która zwiększa szybkość zbliżania się układu do stanu równowagi i kieruje reakcję do określonego produktu.
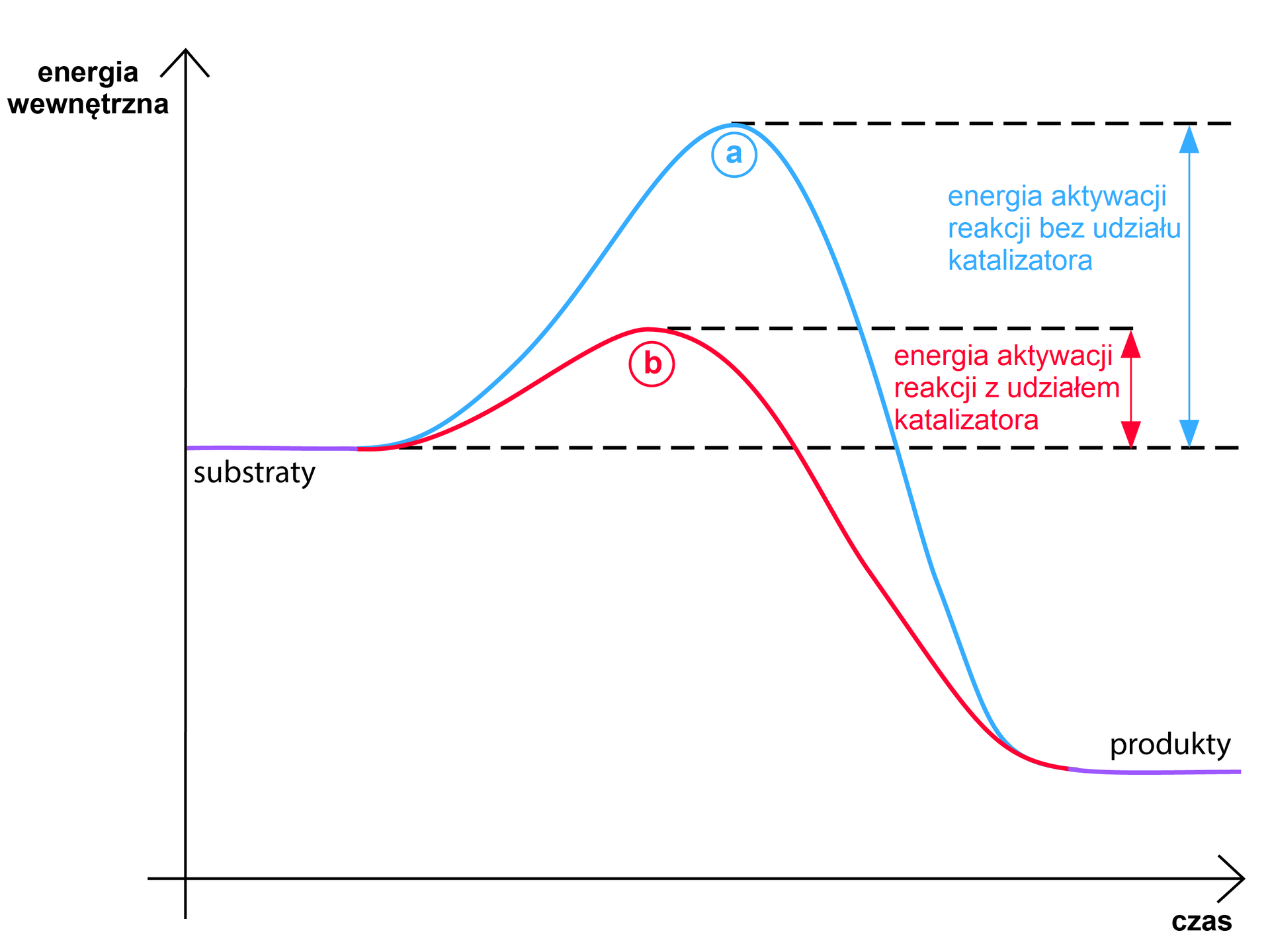
a) z udziałem katalizatora
b) bez udziału katalizatora
Katalizator w istotny sposób nie jest zużywany w reakcji chemicznej, tzn. nie ulega trwałej przemianie chemicznej. Inaczej mówiąc, katalizator to substancja, która przyspiesza reakcję chemiczną, a po jej zakończeniu pozostaje w niezmienionym stanie.
Zjawisko przyspieszania reakcji chemicznej przez katalizator nazywa się katalizą. Przeciwieństwem katalizatorów są inhibitory, które działają odwrotnie i spowalniają reakcję.
Charakterystyka katalizatorów
Katalizatory cechują się:
-
aktywnością, będącą miarą szybkości reakcji;
-
selektywnością, czyli preferencją jednego kierunku przemiany;
-
stabilnością, będącą żywotnością katalizatora w czasie jego eksploatacji;
-
zakresem temperaturowym, w którym katalizator działa efektywnie.
Katalizator to substancja używana podczas estryfikacjiestryfikacji. Z kolei estryfikacja jest to reakcja między kwasem (karboksylowymkarboksylowym lub nieorganicznymnieorganicznym) a alkoholemalkoholem lub fenolemfenolem.
Taka substancja jest wówczas katalizowana mocnym kwasem nieorganicznym, najczęściej kwasem siarkowym(VI) , ale może to być również , oraz kwasem tosylowym (4‑toluenosulfonowy).
Reakcja ta ma charakter odwracalny, dlatego najczęściej stosuje się nadmiar kwasu lub alkoholu, aby przesunąć równowagę w kierunku powstawania estru.
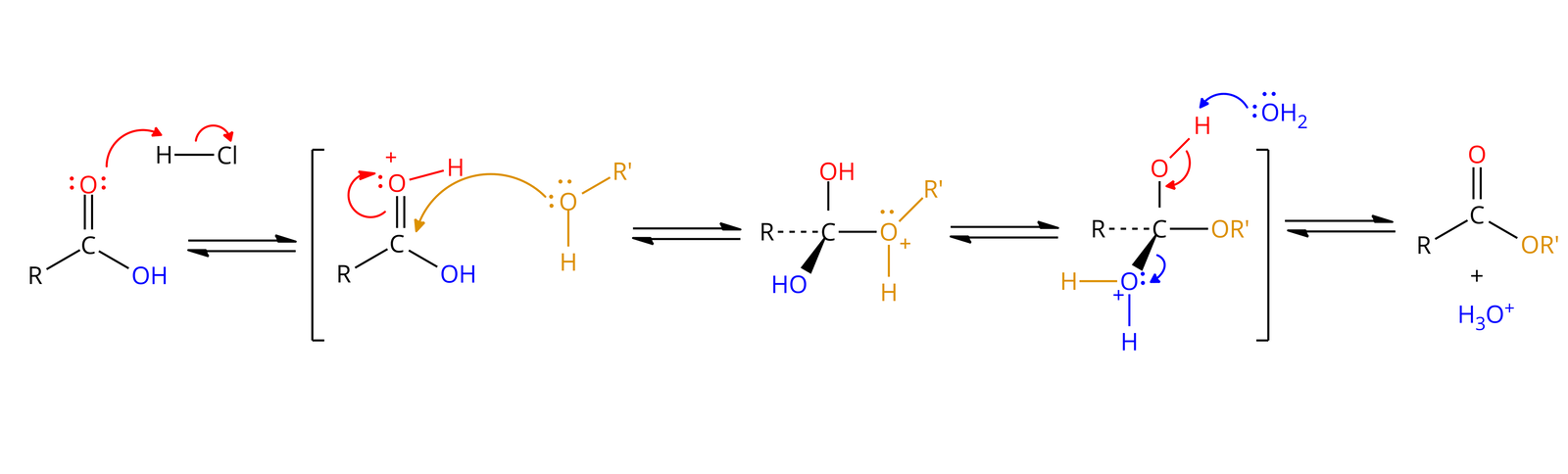
Ogólny schemat reakcji estryfikacji kwasów karboksylowych alkoholem przy użyciu katalizatora kwaśnego został przedstawiony poniżej.
-
1. Przeniesienie protonu z kwaśnego katalizatora na tlen karbonylowy, co zwiększa elektrofilowość węgla karbonylowego.
-
2. Węgiel karbonylowy zostaje zaatakowany przez nukleofil, którym jest atom tlenu pochodzący od alkoholu.
-
3. Przeniesienie protonu z jonu oksoniowego do drugiej cząsteczki alkoholu daje aktywowany związek kompleksowy.
-
4. Protonowanie jednej z grup hydroksylowych aktywowanego kompleksu daje nowy jon oksoniowy.
-
5. Utrata wody z jonu oksoniowego i deprotonowanie kolejnego daje ester.
Równania reakcji otrzymywania estrów
Znając przebieg reakcji estryfikacji, można zapisać równania reakcji otrzymywania wybranych estrów pochodzących:
od kwasów karboksylowych;
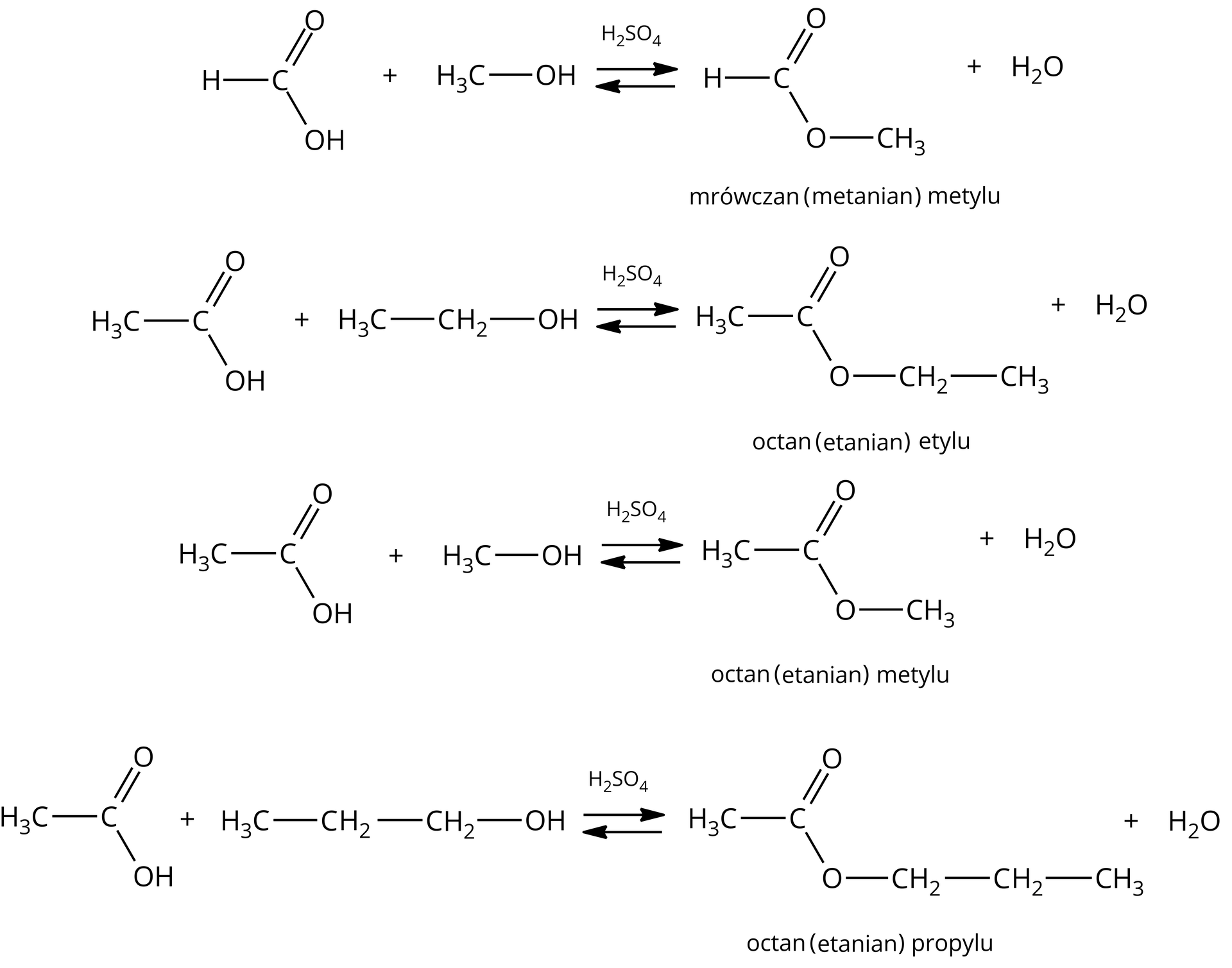
od kwasów nieorganicznych (tlenowych).

Kwas siarkowy(VI) pełni rolę katalizatora w reakcjach estryfikacji. Dostarcza protonów oraz, jako substancja higroskopijna, wiąże wodę, która powstaje w środowisku reakcji.
Słownik
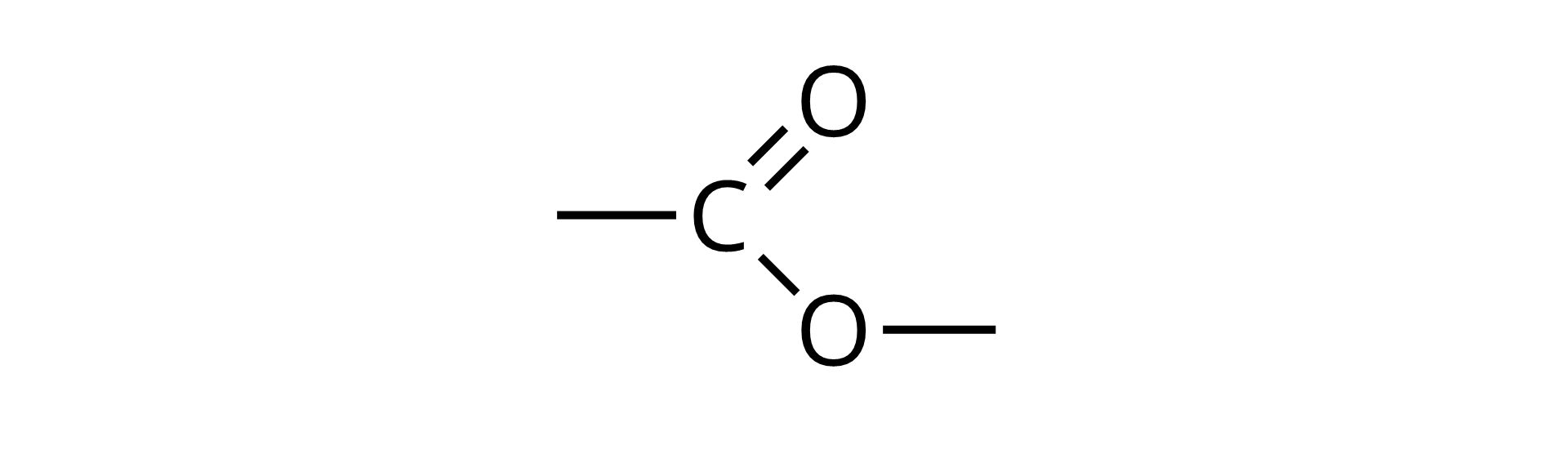
(niem. essigäther „octan etylu” essig „ocet” i Äther „eter”) związek organiczny, który powstaje w wyniku działania kwasów na alkohole lub fenole
reakcja chemiczna między alkoholem (lub fenolem) a kwasem, w wyniku czego powstaje ester i woda
wiązanie powstałe między grupą -OH, pochodzącą od alkoholu, a grupą -COOH, pochodzącą od kwasu karboksylowego
(gr. katálysis „rozłożenie”) zjawisko polegające na tym, że obecność stosunkowo niewielkiej ilości obcej substancji, zwanej katalizatorem, przyspiesza reakcję chemiczną
substancja, która zwiększa szybkość reakcji chemicznej, nie naruszając stanu końcowej równowagi i właściwości termodynamicznych układu, pozostając w stanie niezmienionym po zakończeniu reakcji
(arab. al‑kuhl „delikatny proszek”) związki organiczne; pochodne węglowodorów, których cząsteczki zawierają grupę hydroksylową (wodorotlenową) zamiast atomu wodoru, związanego w związku macierzystym z atomem węgla grupy alkilowej lub cykloalkilowej
związki organiczne, mono-, di- i polihydroksylowe pochodne benzenu oraz alkilobenzenów, których cząsteczki zawierają grupy hydroksylowe (), związane z atomem węgla pierścienia benzenowego
, związek organiczny, podstawowy węglowodór aromatyczny
związki organiczne, których cząsteczki zawierają grupę karboksylową ()
związki chemiczne odznaczające się charakterystycznymi właściwościami, m.in. kwaśnym smakiem, zdolnością wywoływania reakcji barwnych ze wskaźnikami (np. barwią lakmus na czerwono), roztwarzaniem wielu substancji; np. kwas fosforowy(V)
Bibliografia
Bortel E., Koneczny H., Zarys technologii chemicznej, Warszawa 1992.
Grzybowiska‑Świerkosz B., Elementy katalizy heterogennej, Warszawa 1993.
Mastalerz P., Podręcznik chemii organicznej, Wydawnictwo Chemiczne, Wrocaw 1998.
McMurry J., Chemia organiczna, tom 1‑2, Warszawa 2000.
Morrison R. T., Boyd R. N., Chemia organiczna, tom 1‑2, Warszawa 1997.
Oleksik. J.,Krasodomski W., Zastosowanie cieczy jonowych i katalizatorów stałych w syntezie biokomponentów paliwowych, „Nafta‑Gaz” 2015, nr 4, s. 256–265.