Przeczytaj
Czym jest reakcja strącenia?
Reakcja strącaniaReakcja strącania, jak sama nazwa wskazuje, polega na strącaniu substancji trudno rozpuszczalnej. Gdy połączymy dwie odpowiednio dobrane, dobrze rozpuszczalne substancje, otrzymamy produkt trudno rozpuszczalny. Zachodzi wówczas reakcja wytrącania osadu oraz wymiany podwójnej, podczas której produkt wytrąca się w postaci osadu. W wyniku tych procesów otrzymany produkt można oddzielić od reszty roztworu i przeprowadzić odpowiednie badania chemiczne.
Zapoznaj się z instrukcją doświadczenia, a następnie zapisz hipotezę i problem badawczy oraz równanie reakcji.
Schemat doświadczenia:
Powstający osad chlorku srebra. Na zdjęciu znajduje się probówka zawierająca przeźroczysty roztwór oraz powstający biały, kłaczkowaty osad chlorku srebra .
Model sieci krystalicznej . Ilustracja przedstawiająca model sieci krystalicznej chlorku srebra. Naprzemiennie ułożone atomy srebra symbolizowane przez szare kulki i chloru symbolizowane przez zielone kulki. Cała struktura tworzy kształt przypominający sześcienną kostkę.
W jaki sposób opisuje się reakcje strącenia?
W opisanej w doświadczeniu reakcji nastąpiło wytrącenie chlorku srebra() w postaci białego osadu. Reakcję tę można opisać równaniem chemicznym w formie cząsteczkowej.
Powyższy proces przebiega w środowisku wodnym, a użyte reagenty są solami dobrze rozpuszczalnymi w wodzie, dlatego ulegają dysocjacjidysocjacji elektrolitycznej i występują w roztworze w postaci jonów. Odpowiednie dwa jony, w wyniku połączenia, tworzą trudno rozpuszczalny osad. Uwzględniając w równaniu postać, w jakiej występują sole, opisywane równanie chemiczne można zapisać w następujący sposób:
Zapis jonowy pełny:
W powyższym równaniu chemicznym – zarówno po stronie substratów, jak i produktów – występują takie same jony, a reakcja zachodzi tylko pomiędzy kationem srebra oraz anionem chlorkowym. Skreślając po obu stronach równania identyczne jony, otrzymujemy skrócony zapis jonowy tego równania.
Zapis jonowy skrócony:
Jak teoretycznie można przewidzieć przebieg reakcji strącenia?
Substancje dobrze rozpuszczalne w wodzie dysocjują, czyli występują w roztworze w postaci jonów (dodatnich – kationów – oraz ujemnych – anionów). Po zmieszaniu dwóch roztworów może zajść reakcja, w wyniku której kation jednej substancji utworzy trudno rozpuszczalną sól z anionem drugiej substancji.
W jaki sposób możemy teoretycznie przewidzieć, czy w danej reakcji wytrąci się osad?
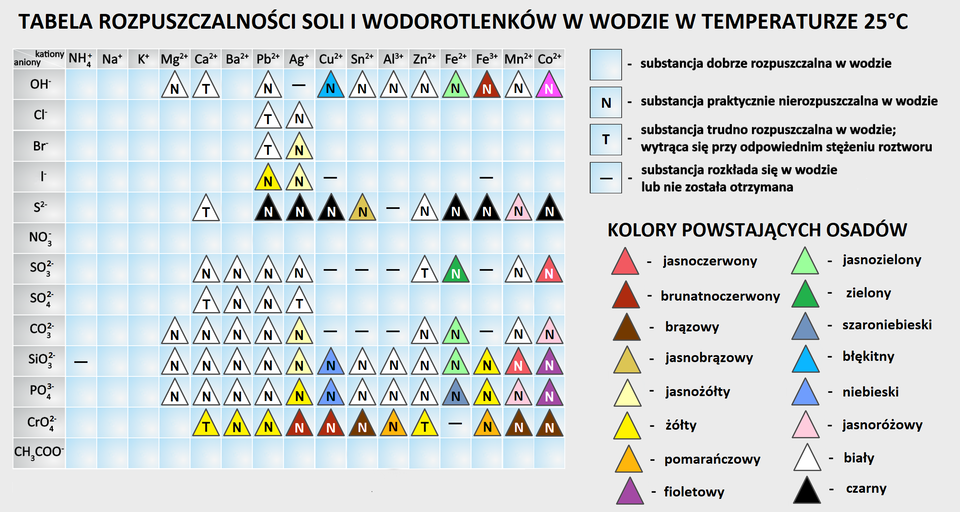
Otóż rozpuszczalnośćrozpuszczalność soli można sprawdzić, posługując się tabelą rozpuszczalności. Jeśli podczas doświadczenia chcemy otrzymać sól trudno rozpuszczalną, korzystamy z tabeli i dobieramy jony, które po zmieszaniu utworzą związek trudno rozpuszczalny. Pamiętajmy, że chcemy otrzymać tylko jeden produkt trudno rozpuszczalny. Trzeba jednak pamiętać, że warunkiem wytrącenia osadu są odpowiednio dobrane stężenia reagentów. Jeżeli stężenia są zbyt małe, osad może się nie wytrącić.
Reakcje strąceniowe są wykorzystywane w analizie jakościowej, w celu potwierdzenia obecności danego jonu w próbce.
Wyobraź sobie, że dostajesz próbkę roztworu do analizy, w którym prawdopodobnie znajduje się sól srebra().
W jaki sposób sprawdzisz obecność jonów srebra w otrzymanej próbce?
Tutaj z pomocą przychodzą reakcje, w wyniku których otrzymasz osad o charakterystycznym wyglądzie. Dobrym przykładem jest powyższa reakcja otrzymywania chlorku srebra(). Następnym jest reakcja otrzymywania jodku srebra() o charakterystycznym wyglądzie. Jodek srebra() otrzymuje się jako żółtawy osad. Jego obecność wskazuje, że w analizowanym roztworze znajdowała się sól srebra.
Czy w wyniku wymieszania niektórych soli, może powstać osad jodku srebra()? Korzystając z tabeli rozpuszczalności, należy wybrać dobrze rozpuszczalne sole, zawierające kation srebra oraz anion jodkowy, np. i .

Następnym przykładem barwnej reakcji strącania jest otrzymywanie trudno rozpuszczalnego, żółtego chromianu() ołowiu(). Reakcja przebiega po zmieszaniu roztworu azotanu() ołowiu() i chromianu() potasu.
Zapisz przebieg opisanej reakcji równaniem chemicznym w formie cząsteczkowej, jonowej pełnej i jonowej skróconej.
Słownik
związek chemiczny, który składa się z kationów i anionów reszty kwasowej
reakcje chemiczne, w wyniku których powstają substancje trudno rozpuszczalne w wodzie
rozpad substancji chemicznej na jony dodatnie i ujemne pod wpływem rozpuszczalnika, np. wody
określa maksymalną ilość substancji, jaka może się rozpuścić w
rozpuszczalnika w danej temperaturze i pod stałym ciśnieniem
Bibliografia
Atkins P., Jones L., Chemia ogólna: cząsteczki, materia, reakcje, Warszawa 2009.
Minczewski J., Marczenko Z., Chemia analityczna, Warszawa 2004.
Pac B., Zegar A., Podstawy klasyfikacji związków nieorganicznych w teorii i zadaniach, Kraków 2020.
Pac B., Zegar A., Reakcje w roztworach wodnych w teorii i zadaniach, Kraków 2020.