Przeczytaj
Tlenki
- zbudowane są z atomu tlenu i atomu innego niemetalu lub atomów metali bloku , które znajdują się na najwyższych stopniach utlenienia;
- reagują z zasadami;
- nie reagują z kwasami;
- przykłady: tlenek węgla( ), tlenek siarki( ), tlenek siarki() , tlenek azotu() , tlenek fosforu() . , tlenki zasadowe
- zbudowane są z atomu tlenu i atomu metalu , grupy lub atomów niektórych metali przejściowych;
- ogólny wzór tlenków metali grupy to , natomiast metale grupy tworzą tlenki o wzorze ogólnym ; wzór tlenków metali przejściowych zależy od stopnia utlenienia atomu metalu;
- reagują z kwasami;
- nie reagują z zasadami;
- przykłady: tlenek sodu , tlenek potasu , tlenek magnezu , tlenek wapnia , tlenek manganu() , tlenek chromu() . , tlenki amfoteryczne
- zbudowane są z atomu tlenu i atomu metalu;
- charakter amfoteryczny mają tlenki, które znajdują się w układzie okresowym na przekątnej od berylu do polonu (na granicy między metalami a niemetalami);
- reagują zarówno z kwasami, jak i wodnymi roztworami wodorotlenków;
- przykłady: tlenek glinu oraz tlenek cynku .
tlenki kwasowe
- zbudowane są z atomu tlenu i atomu innego niemetalu lub atomów metali bloku , które znajdują się na najwyższych stopniach utlenienia;
- reagują z zasadami;
- nie reagują z kwasami;
- przykłady: tlenek węgla(IV) , tlenek siarki(IV) , tlenek siarki(VI) , tlenek azotu(V) , tlenek fosforu(V) .
- zbudowane są z atomu tlenu i atomu metalu I, II grupy lub atomów niektórych metali przejściowych;
- ogólny wzór tlenków metali I grupy to , natomiast metale II grupy tworzą tlenki o wzorze ogólnym ; wzór tlenków metali przejściowych zależy od stopnia utlenienia atomu metalu;
- reagują z kwasami;
- nie reagują z zasadami;
- przykłady: tlenek sodu , tlenek potasu , tlenek magnezu , tlenek wapnia , tlenek manganu(II) , tlenek chromu(II) .
- zbudowane są z atomu tlenu i atomu metalu;
- charakter amfoteryczny mają tlenki, które znajdują się w układzie okresowym na przekątnej od berylu do polonu (na granicy między metalami a niemetalami);
- reagują zarówno z kwasami, jak i wodnymi roztworami wodorotlenków;
- przykłady: tlenek glinu oraz tlenek cynku .
tlenki zasadowe
tlenki amfoteryczne
Otrzymywanie soli w wyniku reakcji pomiędzy tlenkami
W wyniku reakcji tlenku zasadowego lub amfoterycznegoamfoterycznego z tlenkiem kwasowym otrzymuje się sól kwasu tlenowego.
Reakcja tlenku metalu z tlenkiem niemetalu
W celu sprawdzenia, w jaki sposób przebiega reakcja pomiędzy tlenkami, zaprojektowano poniższe doświadczenia.
Zapoznaj się z poniższym doświadczeniem, uzupełnij brakujące pola w dzienniku laboratoryjnym.
Doświadczenie
Tlenek sodu będzie reagował z tlenkiem siarki(VI), tworząc sól.
– probówka z ciekłym ;
– tlenek sodu;
– łyżeczka, palnik.
1. Za pomocą łyżeczki, umieść tlenek sodu w probówce z tlenkiem siarki(VI).
2. Probówkę z tlenkami ogrzewaj.
3. Obserwuj zachodzące zmiany.
Schemat doświadczenia:
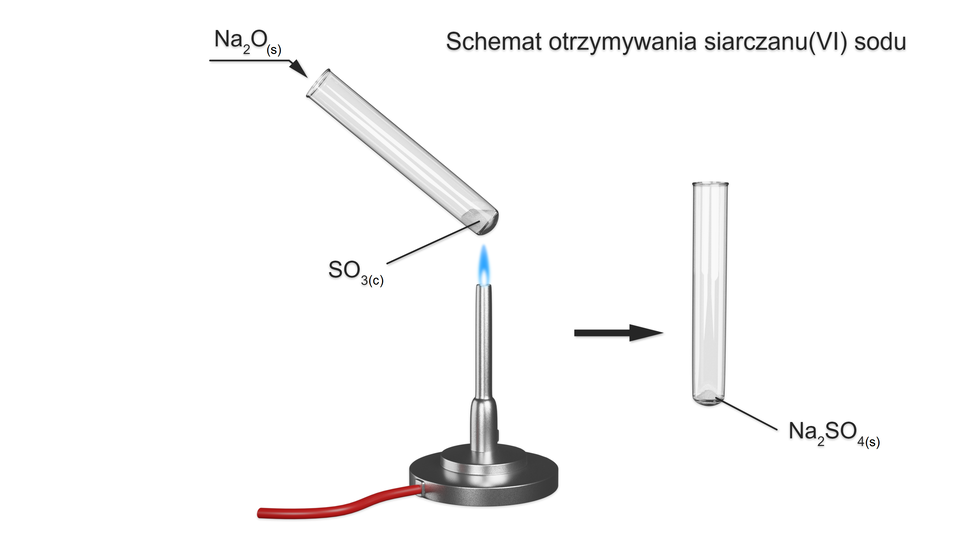
Obserwacje:
Po dodaniu ciała stałego do cieczy, obserwujemy powstanie jednolitej białej masy, która po ostygnięciu staje się białym proszkiem.
Równania reakcji:
Zapis cząsteczkowy równania reakcji:
Słownik
zdolność związku chemicznego do reakcji zarówno z kwasami, jak i z zasadami
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa .
Jelińska–Kazimierczuk M., Megiel E., Teraz matura. Chemia. Vademecum, Warszawa .
Litwin M., Styska–Wlazło Sz., Szymońska J., To jest chemia . Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa .