Przeczytaj
Kwasy według teorii Arrheniusa
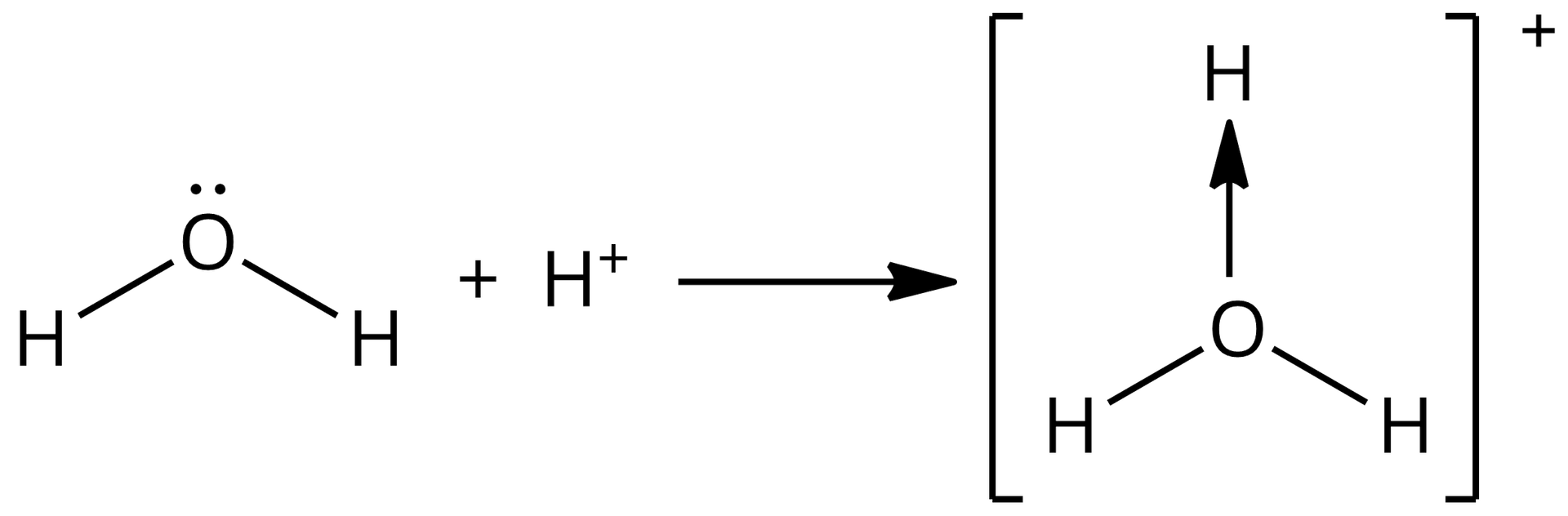
Kwas w roztworze wodnym tworzy jony. Rozpuszczając się w wodzie, oddaje jon wodorowy () cząsteczce wody, tworząc jon oksoniowy ().
Przykłady:
1.
2.
3.
4.
Doświadczenie 1
Schemat doświadczenia
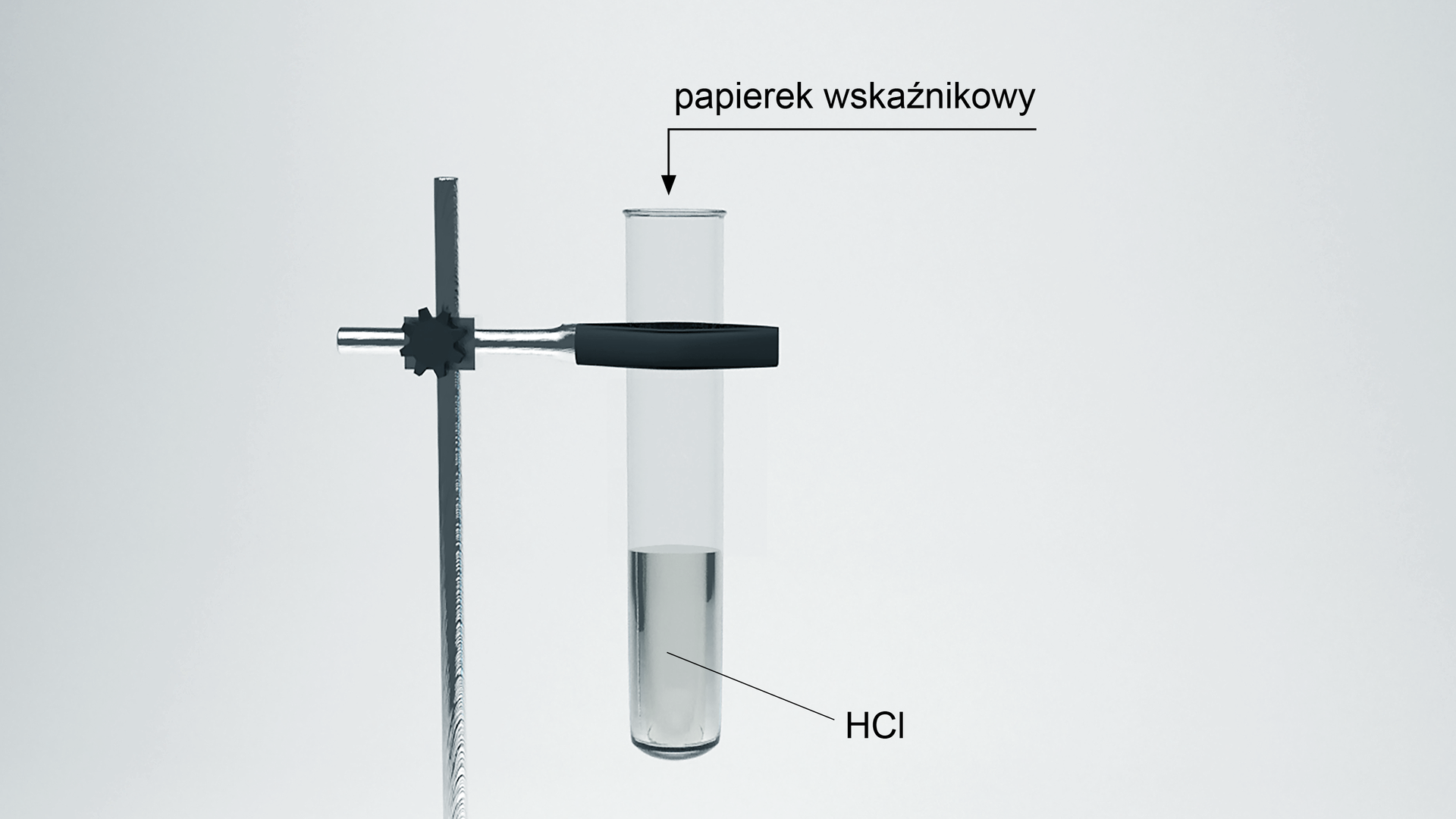
Teoria Arrheniusa ma jedno dość poważne ograniczenie, albowiem stosuje się ją tylko do roztworów wodnych, a często substancje rozpuszcza się także w innych rozpuszczalnikach.
Kwasy według teorii Brønsteda‑Lowry’ego
W 1923 r. Brønsted oraz Lowry podali równocześnie i niezależnie od siebie najszerzej używaną w dzisiejszych czasach definicję kwasu. Brønsted szerzej przedstawił swoją teorię, dlatego definicje kwasu wiąże się głównie z jego nazwiskiem.
Według teorii Brønsteda kwas jest substancją zawierającą cząsteczki zdolne do oddawania protonów (), czyli kwas jest donorem protonu.
W powyższej reakcji kwas chlorowodorowy jest donorem protonu, czyli oddaje proton cząsteczce wody. Reakcja, w której cząsteczka kwasu traci proton, jest nazywana deprotonowaniem, czyli dysocjacją kwasową.
Kwas, tracąc proton, staje się zasadą, natomiast zasada, przyjmując proton, staje się kwasem, w ten sposób tworzą się pary sprzężonychsprzężonych kwasów i zasad. Przeanalizujmy jeszcze raz przykład:
HClIndeks dolny (aq) Indeks dolny koniec (aq) | |||
|---|---|---|---|
Kwas 1 | Zasada 2 | Kwas 2 | Zasada 1 |
W wyniku reakcji chlorowodoru (donor protonu, czyli kwas 1) z wodą (akceptor protonu, czyli zasada 2) tworzy się jon oksoniowy, który może być donorem protonu, oraz anion chlorkowy, który może być akceptorem protonu. W ten sposób powstają dwie pary sprzężonych kwasów i zasad. Pierwszą parą jest z , a drugą parę tworzy i .
W powyższej reakcji woda jest donorem protonu (kationu wodorowego), który jest przyjmowany przez cząsteczkę amoniaku. Woda jest więc kwasem, natomiast amoniak zasadą Brønsteda-Lowry'ego.
Jon przyjął proton (kation wodorowy) (jest więc w stanie go z powrotem oddać) jest więc sprzężonym kwasem – słabszym jednak od wody. Anion wodorotlenowy jest natomiast słabszą od amoniaku sprzężoną zasadą.
NHIndeks dolny 33 | |||
|---|---|---|---|
Zasada 1 | Kwas 2 | Kwas 1 | Zasada 2 |
Zauważ, że według teorii Brønsted’a woda jest traktowana zarówno jako kwas, jak i zasada.
Woda jest zasadą w reakcji:
Woda jest kwasem w rekacji:
Kwasy wieloprotonowe
Związki, które są kwasami wg. teorii kwasów Bronsteda, są również kwasami wg teorii Arheniusa. Dodatkowo, definicja kwasów wg Bronsteda obejmuje również substancje, które nie są kwasami wg teorii Arheniusa. Na przykład kwas siarkowy(VI) jest kwasem wieloprotonowymkwasem wieloprotonowym, więc dysocjacja tego kwasu przebiega w kilku etapach. W poniższym zapisie równania reakcji rozpatrzymy drugi etap dysocjacji tego kwasu:
Kwasy według teorii Lewisa
Teoria kwasów Lewisa jest najbardziej ogólną teorią, która wiąże właściwości kwasowo‑zasadowe ze strukturą elektronową. W teorii tej kwasem jest każda substancja chemiczna, która w swojej strukturze posiada lukę elektronową, czyli może być akceptorem wolnej pary elektronowej.
Przykładem kwasu według teorii Lewisa jest na przykład , ponieważ posiada on lukę elektronową i ulega reakcji z zasadą.
W wyniku powyższej reakcji powstał kompleks , atom azotu łączy się z atomem boru poprzez wiązanie koordynacyjne (atom azotu jest donorem pary elektronowej).
W reakcji kwasu i zasady Lewisa wszystkie tworzące się wiązania są wiązaniami koordynacyjnymi, na przykład kwas chlorowodorowy przekazuje proton cząsteczce wody, tworząc jon oksoniowy. Proton jest kwasem wg teorii Lewisa, ponieważ może przyjąć wolną parę elektronową, a woda jest zasadą wg teorii Lewisa, ponieważ jest donorem pary elektronowej, a utworzony jon oksoniowy jest kompleksem.
Kwas | Zasada | Addukt |
|---|---|---|
Słownik
to związek zawierający wodór i uwalniający w wodzie jony wodorowe (powstają jony oksoniowe, ), np. , , lecz nie
jest donorem protonu (), np. , , ,
cząsteczka, która jest akceptorem pary elektronowej, np. , ,
proton, który może zostać przekazany zasadzie; atom wodoru, który może odłączyć się w wodzie i utworzyć jon oksoniowy
kwas Bronsteda z jednym kwasowym protonem, np.
kwas Bronsteda, który może przekazać więcej niż jeden proton, np.
kwas Bronsteda utworzony z zasady Bronsteda poprzez przyłączenie do niej protonu, np. jest kwasem sprzężonym z zasadą
Bibliografia
Atkins P., Jones L., Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2014.
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1987.