Przeczytaj
Czym są białka?
BiałkaBiałka pełnią wiele funkcji w świecie przyrody. Są składnikiem budulcowym organizmów, jak np. miozyna, która buduje mięśnie szkieletowe człowieka, czy keratyna, która jest głównym składnikiem ludzkiego włosa. Mogą również tworzyć hormony odpowiedzialne za prawidłowe funkcjonowanie organizmu ludzkiego, jak insulina utrzymująca odpowiedni dla całego ustroju poziom glukozy we krwi. Struktury białkowe są również enzymami, np. pepsyna ma za zadanie rozkład przyjmowanych do organizmu białek na prostsze związki, które mogą zostać wchłonięte w układzie pokarmowym. Dodatkowo mogą również transportować inne związki do dalszych części ciała jak hemoglobina, dostarczająca tlen do tkanek organizmu. Te wszystkie funkcje białek są możliwe dzięki ich strukturze. wet jej najmniejsza zmiana może doprowadzić do utraty pełnienia zadania przez określone białko.
Białka zbudowane są z aminokwasówaminokwasów. Ich konstrukcję można scharakteryzować poprzez ich rzędowośćrzędowość, czyli stopień zaawansowania budowy. Wyróżnia się cztery rodzaje struktur:
Jake oddziaływania stabilizują struktury białkowe?
Każda z tych rzędowości jest stabilizowana przez różnego rodzaju oddziaływania. Teraz omówimy każdą z nich po kolei wraz z oddziaływaniami odpowiedzialnymi za stabilizację tej struktury.
Wiązania jonowe
Jest to oddziaływanie polegające na elektrostatycznym przyciąganiu się dwóch różnoimiennych jonów.
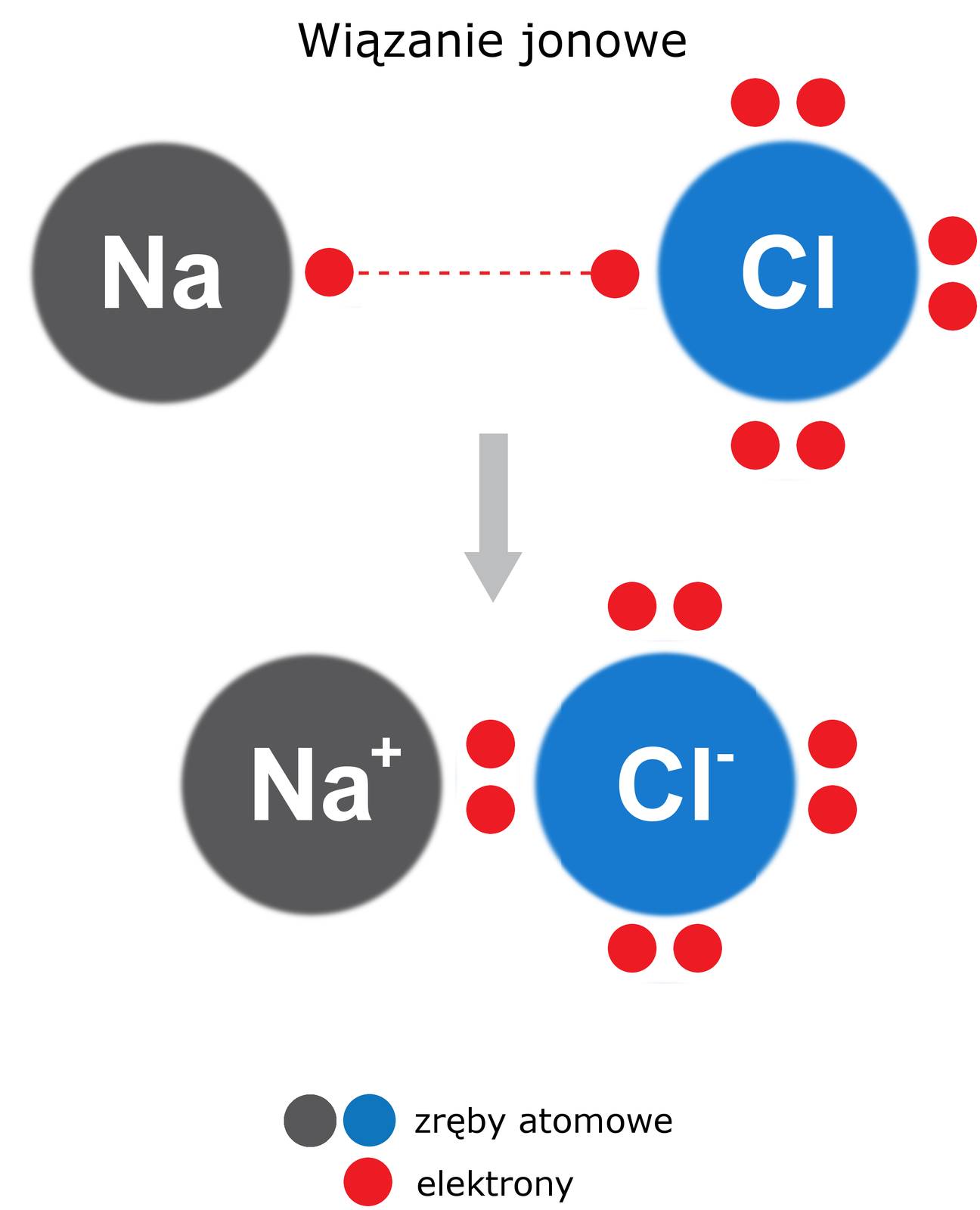
Atom sodu () posiada jeden wolny elektron na swojej zewnętrznej powłoce elektronowej. Atom chloru () posiada 7 elektronów na swojej zewnętrznej powłoce elektronowej. Dla obu tych pierwiastków, taka sytuacja jest niekorzystna energetycznie i w momencie, kiedy zbliżają się do siebie, dochodzi do oddania jednego elektronu sodu dla chloru. Sód poprzez oddanie elektronu dostaje ładunek dodatni (+), a chlor po otrzymaniu elektronu posiada ładunek ujemny (-). Różnica elektrostatyczna która występuje sprawia, że oba jony przyciągają się do siebie.
W białkach występują najczęściej pomiędzy dodatnio naładowanymi grupami aminowymi a ujemnie naładowanymi grupami karboksylowymi.
Oddziaływania hydrofobowe
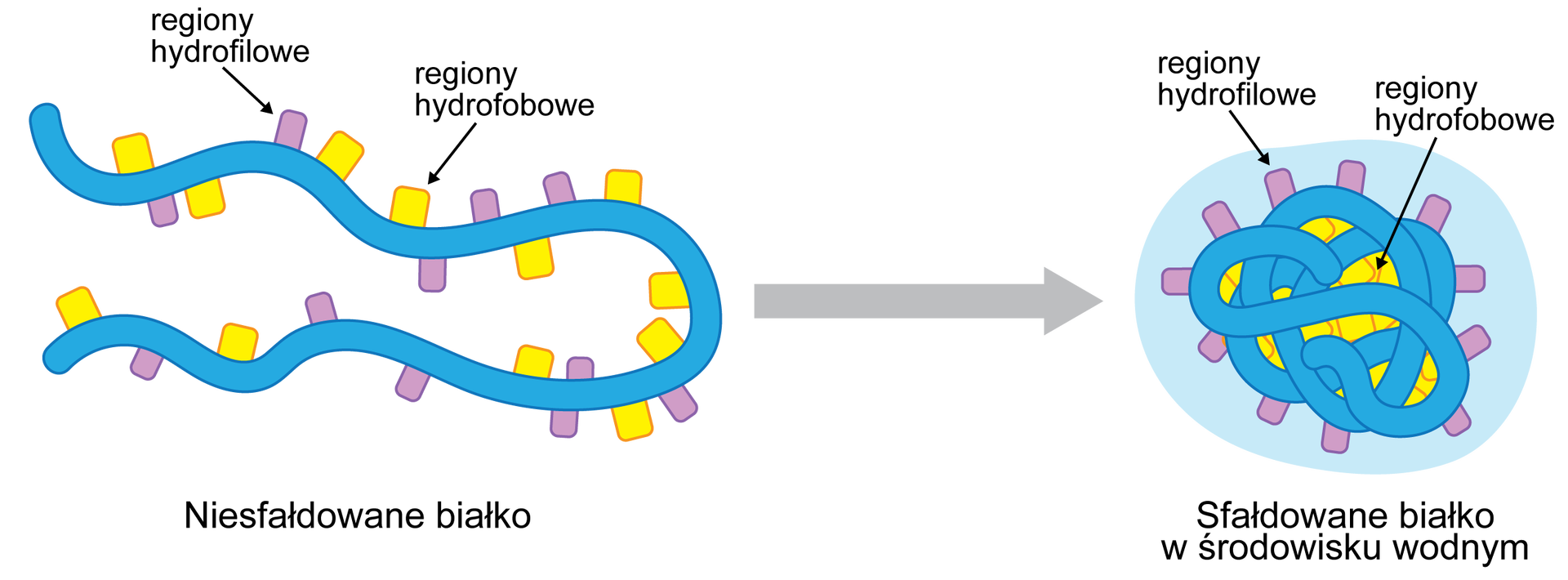
Oddziaływania te występują w cząsteczkach, które posiadają w swojej budowie regiony hydrofobowe i hydrofilowehydrofilowe. Regiony hydrofilowe to takie części cząsteczki, o których można powiedzieć, że „lubią” wodę, co naukowo znaczy – mają budowę polarną. Woda jest cząsteczką polarną, co oznacza, że w swojej cząsteczce ma ładunki elektryczne, rozłożone nierównomiernie. W myśl zasady: podobne rozpuszcza się w podobnym – w wodzie rozpuszczają się cząsteczki polarne. tomiast regiony hydrofobowe to takie części cząsteczki, które przeciwnie do regionów hydrofilowych „boją się wody”, czyli mają budowę niepolarną. Dzięki tej różnicy, występującej w związkach, może dochodzić do oddziaływań hydrofobowych. Polegają one na ograniczeniu dostępu do wody tym częściom cząsteczki, które są hydrofobowe. Jeżeli w jednej, dużej cząsteczce występują odpowiednio regiony hydrofobowe i hydrofilowe, to taka cząsteczka ulega zwijaniu i zmianom w położeniu do takiego stopnia, aby zmniejszyć kontakt z wodą odcinkom hydrofobowym. Używając obrazowego języka możemy stwierdzić, że cząsteczka na zewnątrz, czyli w kierunku cząsteczek wody, kieruje swoje hydrofilowe fragmenty, a fragmenty hydrofobowe chowa niejako do swojego wnętrza. Oddziaływania hydrofobowe zostały zaprezentowane na poniższym obrazku:
Siły van der Waalsa
Są to bardzo słabe oddziaływania pomiędzy atomami występującymi blisko siebie. Większość części białka jest upakowanych, dzięki czemu siły van der Waalsasiły van der Waalsa mogą między nimi zachodzić. Mają bardzo duże znaczenie w przyrodzie, ponieważ to dzięki nim zachodzi wiele procesów fizykochemicznych. Odpowiedzialne za budowę białek czy adsorpcjęadsorpcję, są powszechnie występującymi oddziaływaniami. Odgrywają ważną rolę w oddziaływaniach białko‑białko, gdzie dochodzi do dopasowania, jak klucza do zamku. Przykładem takiej sytuacji jest rozpoznawanie antygenuantygenu przez przeciwciałoprzeciwciało.
Wyróżnia się kilka rodzajów sił van der Waalsa:
oddziaływanie dipoldipol - dipol - dwie cząsteczki mające moment dipolowymoment dipolowy przyciągają się,
oddziaływanie dipol - dipol indukowany - jedna cząsteczka z momentem dipolowym indukuje moment dipolowy u drugiej cząsteczki i dochodzi do ich przyciągania,
oddziaływanie dipol indukowany - dipol indukowany - obie cząsteczki nie posiadające momentu dipolowego uzyskują chwilowe momenty dipolowe i przyciągają się.
Wiązanie wodorowe
Jest rodzajem oddziaływania elektrostatycznego pomiędzy atomem wodoru a atomem elektroujemnym, który zawiera wolne pary elektronowe. W białkach wiązanie wodorowe powstaje pomiędzy grupą karbonylową jednego aminokwasu a grupą iminową drugiego aminokwasu. Rolą wiązania wodorowegowiązania wodorowego w białkach jest stabilizacja struktury alfa‑helisy i beta‑kartki.

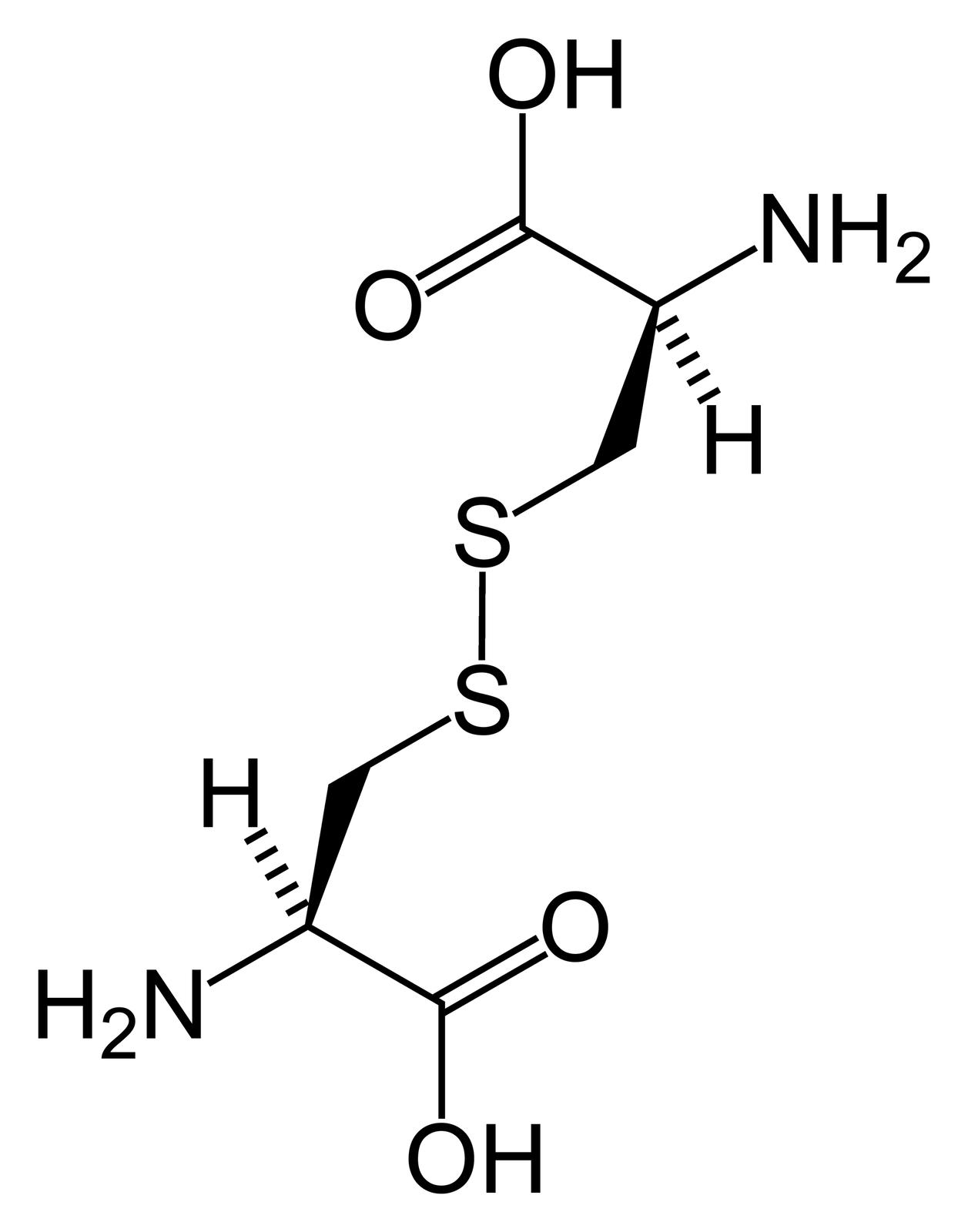
Mostki disiarczkowe
Te struktury powstają, gdy dwie grupy tiolowe () połączą się ze sobą. Grupy te mogą występować w dwóch różnych związkach albo w jednym. Odgrywają ważną rolę w fałdowaniu i stabilności wielu białek. Utrzymuje części białka razem stabilizując jego zwiniętą formę. Mostki disiarczkowe mogą również tworzyć centra hydrofobowe – regiony hydrofoboweregiony hydrofobowe białka układają się wokół mostków disiarczkowych, tym samym ograniczając swój kontakt z wodą. Mostek disiarczkowy zaprezentowano na galerii poniżej.
Podsumowanie
W ten sposób zostały scharakteryzowane wszystkie oddziaływania stabilizujące struktury białkowe. Niektóre z nich są charakterystyczne dla konkretnej rzędowości białka, podczas gdy inne występują w kilku przypadkach. Istotą ich funkcji jest utrzymywanie takiej struktury białkowej (czyli prościej mówiąc takiego jego kształtu), które umożliwia wykonywanie danej czynności białka. Zerwanie tych wiązań powoduje zaburzenie struktury - białko nie może pełnić swojej funkcji.

Słownik
(ang. deoxyribonucleic acid „kwas deoksybonukleinowy”) związek chemiczny, który koduje informację genetyczną organizmu
kompleksy białkowe, występujące w komórkach organizmów żywych i biorące udział w procesie syntezy materiału genetycznego
wielkocząsteczkowe związki zbudowane wyłącznie lub w dużej mierze z aminokwasów; stanowią największą część występujących w żywej komórce związków organicznych
(ang. amino acid „kwas aminowy”) związek organiczny, posiadający co najmniej dwie grupy funkcyjne: i
hierarchia w budowie struktur białkowych, wyróżnia się cztery rodzaje: pierwszo-; drugo-; trzecio- i czwarto- rzędowa
wiązania występujące pomiędzy grupą aminową a grupą karbonylową białkach. Łańcuchy polipeptydowe – aminokwasy połączone wiązaniami peptydowymi i tworzące długie ciągi
wiązania występujące pomiędzy atomem wodoru a elektroujemnym atomem sąsiedniej cząsteczki
(gr. hydros „woda”, phobos „strach”)regiony apolarne; nie rozpuszczają się w wodzie, tylko w rozpuszczalnikach apolarnych
(gr. hydros „woda”, philia „umiłowanie”) regiony polarne; rozpuszczają się w wodzie a nie rozpuszczają w rozpuszczalnikach apolarnych
cząsteczka posiadająca zerowy moment dipolowy
słabe oddziaływania pomiędzy atomami oddalonymi od siebie
(łac. ad- „przy”, sorbere „pochłaniać”) proces zachodzący na granicy dwóch faz, poprzez związanie cząstek jednej fazy przez cząstki drugiej fazy.
substancja, która, wprowadzona do organizmu, wywołuje u niego reakcję immunologiczną
glikoproteiny o zdolnościach swoistego wiązania antygenów
(gr. dipolos „dwa bieguny”) układ dwóch różnoimiennych ładunków, wytwarzających pole dipolowe i posiadających moment dipolowy
wielkość fizyczna charakteryzująca dipol
Bibliografia
Doonan S., Białka i peptydy, tłum. Z. Zawadzki, Warszawa 2008, wyd. 1.
Stryer L., Berg J. M., Tymoczko J. L., Biochemia. Część 1. Molekularny wzór życia, Warszawa 2009, wyd. 4.